浅谈氯气的制法
2015-02-20张泽覃
张泽覃
(甘肃省庄浪县紫荆中学)
氯气是中学化学中最常见的气体之一,有关氯气的实验室制法装置、原理及操作在各类考题中经常出现,也是高考热点之一。现总结如下:
1.实验原理:常用MnO2与浓盐酸来制取氯气,注意盐酸浓度要比较大,不能用稀盐酸。
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
注意:在实验中,也可用KMnO4、KClO3、Ca(ClO)2等氧化剂来代替MnO2制取氯气。这三种氧化剂的氧化性比MnO2强,一般不需要加热即可与浓盐酸反应。
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
KClO3+6HCl=KCl+3Cl2↑+3H2O
Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O
2.实验装置:常用下列装置来制取氯气。
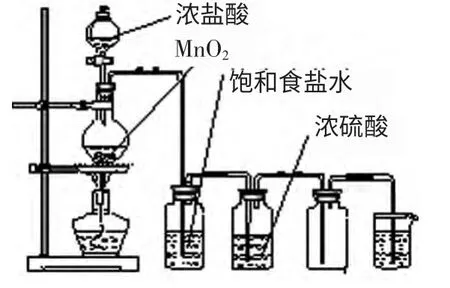
注意:
(1)盛饱和食盐水和浓硫酸的两个洗气瓶分别用于吸收氯气中混有的氯化氢和水蒸气,两个洗气瓶的位置不能互换。通常干燥气体的装置紧放在收集装置之前。
(2)盛装碱液的烧杯用以吸收尾气中的Cl2。
例1.【2014·全国卷】下列除杂方案错误的是 ( )
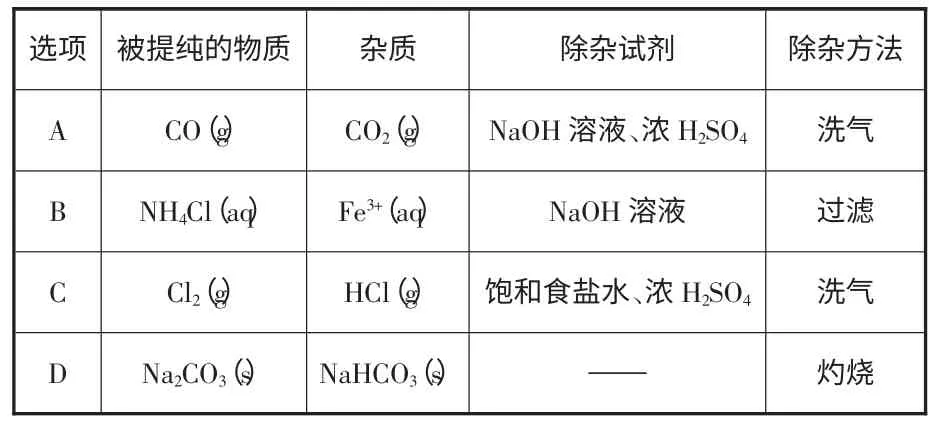
除杂方法洗气杂质CO2(g)除杂试剂NaOH 溶液、浓H2SO4过滤Fe3+(aq) NaOH 溶液HCl(g) 饱和食盐水、浓H2SO4 洗气NaHCO3(s) —— 灼烧选项A B C D被提纯的物质CO(g)NH4Cl(aq)Cl2(g)Na2CO3(s)
解析:混合气体通过盛有NaOH 溶液的洗气瓶时,CO2被吸收,再通过盛有浓硫酸的洗气瓶时可将带出的水蒸气除去,得干燥、纯净的CO,A 项正确;NaOH 溶液可与NH4Cl 溶液发生反应NaOH+
NH4Cl=NaCl+NH3↑+H2O,B 项错误;Cl2 在饱和食盐水中的溶解度很小,而HCl 在饱和食盐水中的溶解度很大,混合气体通过盛有饱和食盐水的洗气瓶时HCl 气体被吸收,再通过盛有浓硫酸的洗气瓶时可除去带出的水蒸气,C 项正确;灼烧时,杂质NaHCO3发生反应2NaHCO3Na2CO3+CO2↑+H2O,D 项正确。
3.操作过程:安装连接仪器→检验装置的气密性→向烧瓶和分液漏斗中添加试剂→加热烧瓶内盐酸和MnO2的混合物并收集氯气→仪器的清洗、整理。
例2.【2012·福建理综化学卷25】实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如右图所示)。
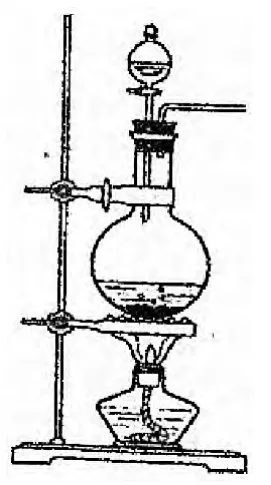
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是(填序号)。
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
解析:(1)加药顺序一般是先加入固体药品,再加入液药品,最后再加热。则依次顺序是ACB。考查实验的细节,看学生是否真的做过实验,引导实验课要真正地上,而不是在黑板上画。
4.氯气收集的改进装置。
收集氯气时,既可用向上排空气法,也可用排饱和食盐水法。当收集多瓶氯气时可用下面装置,防止氯气泄露,污染空气;(该装置设计的依据是启普发生器原理,装置Ⅱ中盛有的是饱和NaCl 溶液,装置Ⅱ可看作一个储气瓶。)也可用装置Ⅱ作为防堵塞、防爆炸的安全瓶。
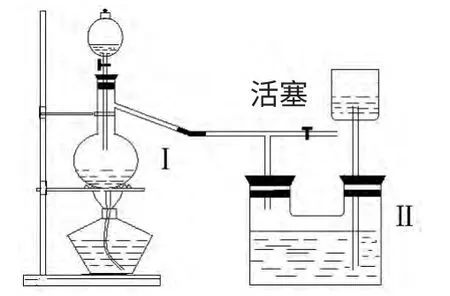
例3.【2014·湖北咸宁期末】高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用。
如下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
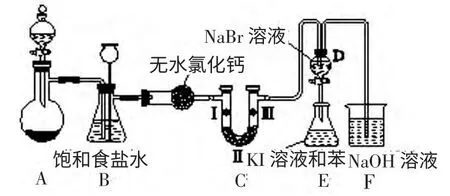
(1)制备氯气选用的药品为高锰酸钾和浓盐酸,相应的离子方程式为________________。
(2)装置B 的作用是____________,实验进行时C 中可能发生堵塞,请写出发生堵塞时B 中的现象:_________________。
解析:(1)实验室制取氯气时,可用高锰酸钾代替二氧化锰且不用加热。离子方程式为:
2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
(2)由于盐酸易挥发,反应制取的氯气中含有氯化氢,装置B中饱和食盐水的作用是除去Cl2中的HCl;装置B 也兼起安全瓶的作用,实验进行时若C 中发生堵塞,锥形瓶B 中的压强增大,液面下降;长颈漏斗中的液面上升,形成水柱。
注意:装置用途的多样性。
