miR-200c对舌癌Tca8113细胞增殖和凋亡的影响*
2015-02-20朱名毅姚金光
朱名毅,姚金光,刘 津,姜 艳△
(1.右江民族医学院科学实验中心,广西百色 533000;2.右江民族医学院附属医院,广西百色 533000)
miR-200c对舌癌Tca8113细胞增殖和凋亡的影响*
朱名毅1,姚金光2,刘 津2,姜 艳1△
(1.右江民族医学院科学实验中心,广西百色 533000;2.右江民族医学院附属医院,广西百色 533000)
目的 探讨miR-200c对人舌鳞状细胞癌Tca8113细胞增殖和凋亡的影响。方法 将miR-200c的模拟物通过脂质体转染到人舌鳞状细胞癌Tca8113细胞内,通过四甲基偶氮唑盐(MTT)法检测细胞增殖能力、流式细胞术检测细胞周期和细胞凋亡率、Westernblot检测半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)和Bcl-2蛋白的表达。结果 与对照组相比,miR-200c模拟物20、40、80nmol/L组的Tca8113细胞生长受到明显抑制,差异有统计学意义(P<0.05),miR-200c模拟物的浓度越大,作用时间越长,抑制效果越明显(P<0.05);转染miR-200c模拟物48h后,Tca8113细胞停滞于G0/G1期,细胞凋亡率显著增加,差异有统计学意义(P<0.05);Westernblot证明20、40、80nmol/L组Bcl-2蛋白表达量明显低于对照组,而Caspase-3蛋白表达量明显高于对照组(P<0.05)。结论miR-200c过表达可抑制舌癌Tca8113细胞增殖并诱导细胞凋亡。
舌肿瘤;miR-200c;细胞增殖;细胞凋亡
微RNA(microRNA,miRNA)是近年来发现的一类由18-25个短寡核苷酸组成的内源性非编码单链小分子RNA。miRNA广泛存在于各种生物中,参与细胞的发育、分化、增殖、凋亡、迁移等多种生物学过程[1]。miRNA可作为癌基因或抑癌基因,与许多肿瘤的发生、发展密切相关,目前的研究发现舌鳞癌中存在 miRNA 差异性表达,改变某些特异 miRNA 的表达水平,可影响舌癌的发生、发展[2-3]。miR-200c具有调节下游靶基因表达的作用,在肿瘤中miR-200c主要通过调控转录因子的表达参与肿瘤转移的上皮间质转化过程[4-6]。很少有文献报道miR-200c在肿瘤细胞增殖、凋亡过程中的作用及其机制。本文通过体外将miR-200c模拟物转染入舌癌细胞,上调 miR-200c的表达,观察其对舌癌细胞增殖、凋亡的影响,并检测Bcl-2和Caspase-3蛋白表达的变化,分析其相关机制。
1 材料与方法
1.1 材料 人舌鳞状细胞癌Tca8113细胞株由广西医科大学邝晓聪教师赠送。miRNA模拟物及其阴性对照由上海吉玛制药技术有限公司合成,miR-200c模拟物序列:5′-UAA UAC UGC CGG GUA AUG AUG GA-3′;miR-200c模拟物阴性对照序列:5′-UUC UCC GAA CGU GUC ACG UTT-3′;miRNA inhibitor negative control-FAM序列:5′-UUC UCC GAA CGU GUC ACG UTT-3′。RPMI 1640培养液和胎牛血清购自美国HYCLONE公司。Opti-MEMⅠ培养液和LipofectamineTM2000转染试剂盒购自美国Invitrogen公司。四甲基偶氮唑盐(MTT) 和细胞周期检测试剂盒购自美国sigma公司,细胞凋亡检测试剂盒购自BD公司,二甲基亚砜(DMSO)购自上海生工生物工程公司。
1.2 方法
1.2.1 细胞培养和瞬时转染 将舌鳞癌细胞株Tca8113复苏后,接种于25 cm2培养瓶中,加入含有10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养液,置于培养箱中(37 ℃、5%CO2)常规培养,选择对数生长期细胞用于实验。转染前1 d,选择生长状态良好的Tca8113细胞,用100 μL无抗生素RPMI 1640培养液按3×103每孔的浓度接种到96孔板,24 h后细胞浓度为50%~70%时进行转染实验。其具体步骤为:先用12.50 μL Opti-MEM Ⅰ稀释miRNA模拟物;再将0.25 μL Lipofectamine 2000加入到12.50 μL Opti-MEM Ⅰ中,室温静止5 min;然后把二者混匀,室温放置20 min;最后把混合液全部均匀加入到96孔板中,继续培养4 h后换成含血清和抗生素的RPMI 1640培养液进行后续实验。将羧基荧光素(caboxyfluorescein,FAM)标记的miR-200c阴性对照转染到Tca8113细胞中,细胞常规培养24 h后,在荧光显微镜下观察转染效率。
1.2.2 MTT法检测miR-200c对Tca8113细胞增殖的影响 为了解miR-200c模拟物(mimics)、转染试剂以及背景效应之间的差异,以排除非序列特异性的效应,本研究在预实验中设计了3组对照:(1)空白对照组(A组);(2)脂质体试剂对照组(B组);(3)miR-200c模拟物阴性对照组(C组)。Tca8113细胞接种于96孔板后,在同样的实验条件下,先观察以上3组细胞之间生长情况,证实它们对细胞的生长没有明显影响,后续的实验中均以B组作为对照组。实验组分为20、40、80 nmol/L组,按上述转染方法分别将终浓度为20、40、80 nmol/L的miR-200c模拟物转染Tca8113细胞,常规孵育24、48、72 h后,弃培养液,每孔加入质量浓度5 g/L的MTT溶液20 μL继续培养4 h后,洗净该盐,每孔加入150 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解。每组细胞设5个平行孔,重复3次实验。用酶标仪测量各孔的吸光度值(A值),以细胞增殖率反映细胞增殖情况,细胞增殖率=转染细胞A值/对照细胞A值×100%。
1.2.3 流式细胞术检测miR-200c对细胞周期的影响 Tca8113细胞转染miR-200c模拟物48 h后,对常规胰酶消化、离心收集转染后的细胞,用预冷的磷酸盐缓冲液(PBS)洗涤2次,之后加入2倍体积的预冷70%乙醇于4 ℃固定过夜,第2天PBS洗涤2次后,加500 μL PBS(含100 μg/mL RNaseA,50 g/mL溴化乙锭),于4 ℃避光孵育30 min,200目筛网过滤后上机检测细胞周期,实验重复3次,取平均值。
1.2.4 流式细胞术检测miR-200c对细胞凋亡的影响 Tca8113细胞转染miR-200c模拟物48 h后,以适量胰酶消化,离心收集转染后的细胞,用PBS洗涤细胞2次,用500 μL Binding Buffer调整细胞浓度为(1~5)×105个/mL,向重悬液中加入5 μL Annexin V-FITC 染色,随后加入5 μL碘化丙啶(PI)染色,室温下避光孵育 15 min,流式细胞仪检测凋亡率,实验重复 3 次。
1.2.5 Western blot检测miR-200c对细胞Bcl-2和半胱氨酸天冬氨酸蛋白酶(Caspase-3)蛋白表达的影响 Tca8113细胞转染miR-200c模拟物48 h后,常规胰酶消化,离心收集转染后的细胞,加入适量含有苯甲基磺酰氟(PMSF)的细胞裂解液于冰上裂解细胞,提取总蛋白,用蛋白浓度测定试剂盒进行蛋白定量。15%聚丙烯酰胺凝胶电泳(SDS-PAGE),电转移到聚偏氟乙烯(PVDF)膜。37 ℃下用10%脱脂奶粉封闭1 h,分别加入Bcl-2、Caspase-3抗体,4 ℃冰箱过夜孵育,洗膜后加入二抗,室温孵育2 h,洗膜后加入增强化学发光(ECL)试剂曝光、显影,以β-actin为内参。将胶片扫描后,用Image Pro PLUS 7.0软件分析Bcl-2、Caspase-3和β-actin的灰度值,以目的蛋白与内参照β-actin的比值为目的蛋白的相对表达量。

2 结 果
2.1miR-200c转染效率的观察FAM标记的miR-200c阴性对照转染Tca8113细胞24h后,在荧光显微镜下观察,发现大部分细胞均含有荧光,转染效率可达到90%以上。
2.2miR-200c对Tca8113细胞增殖的影响Tca8113细胞经转染miRNA-200c模拟物后,细胞增殖比未转染的细胞明显减缓。转染24h时,40、80nmol/L组miRNA-200c模拟物对细胞生长抑制与对照组比较,差异有统计学意义(P<0.05);转染48、72h时,3组不同浓度miRNA-200c模拟物对细胞生长抑制与对照组比较,均差异有统计学意义(P<0.05),miRNA-200c模拟物的浓度越大,其抑制效果越明显,见图1。

a:P<0.05,与对照组比较。
图1miR-200c对Tca8113细胞增殖的影响
2.3 流式细胞术检测miR-200c对细胞周期和凋亡的影响 与对照组比较,实验组miR-200c模拟物可以使G0/G1期细胞比例增加、S期细胞比例减少,差异有统计学意义(P<0.05);miR-200c模拟物还可以使细胞的凋亡率明显增加,且miR-200c模拟物浓度越大,凋亡率越高(P<0.05),见表1。
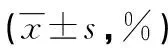
表1 各组细胞周期和凋亡情况比较
a:P<0.05,与对照组比较。
2.4miR-200c对Tca8113细胞Bcl-2和Caspase-3蛋白表达的影响 以对照组组目的蛋白/β-actin的比值为1,Westernblot法检测结果显示,转染miR-200c模拟物48h后,随着miR-200c模拟物浓度增加,20、40、80nmol/L组细胞Bcl-2蛋白相对表达量递减,细胞Caspase-3蛋白相对表达量递增,与对照组相比,差异有统计学意义(P<0.05),见表2。

表2 各组细胞Bcl-2和Caspase-3蛋白表达比较
a:P<0.05,与对照组比较。
3 讨 论
研究表明舌癌具有独特的miRNA表达谱,miRNA的表达改变在舌癌的发生、发展中发挥着重要的作用。李莎莎等[7]学者采用RT-qPCR和原位杂交法检测发现miR-21在舌鳞癌细胞及组织标本中都呈高表达;舌鳞癌分化程度越低,miR-21表达越高;miR-21表达与患者生存期呈负关;miR-21高表达患者的预后较低表达者差。Jia等[8]学者认为miR-195的低表达与舌鳞癌大小和临床分期有关,同时miR-195的低表达还能降低患者的生存时间;增加miR-195在舌癌细胞SCC-15和CAL27中的表达,可以抑制细胞增殖,促进细胞凋亡,与降低周期素D1(CyclinD1)和Bcl-2的表达有关。miR-200c是miR-200家族成员之一,近年来许多研究表明,miR-200c在头颈部肿瘤、乳腺癌、胰腺癌、肾癌膀胱癌和肝癌等肿瘤中呈低表达[9]。miR-200c参与肿瘤发生、发展、转移和耐药等过程,miR-200c在肺癌患者血清中呈低表达,高表达miR-200c会降低肺癌患者的生存时间;miR-200c也能通过靶向作用蛋白锌指E盒结合同源盒蛋白1/2(ZEB1/2),上调E-钙黏蛋白的表达,从而抑制肿瘤转移过程中的上皮间质转化过程;此外miR-200c不但能提高肿瘤细胞对药物的敏感性,也能增加肿瘤细胞对化疗药物的耐药性[10]。王晟[11]发现miR-200c在高度恶性乳腺癌细胞株和乳腺癌标本中呈低表达,过表达乳腺癌细胞株的miR-200c,可以下调G13信号通路、突触传递信号通路、神经冲动传递信号通路和细胞内代谢负调控信号通路等基因的表达,还发现内皮素受体A(EDNRA)可能是miR-200c的调控靶点。本研究通过MTT实验检测发现舌癌Tca8113细胞转染miR-200c模拟物,上调miR-200c的表达,可抑制细胞的增殖;miR-200c模拟物浓度越大,对细胞增殖的抑制率越高。流式细胞术结果显示,miR-200c能够使G0/G1期细胞增多,而S期细胞减少,从而抑制舌癌细胞的生长。
Bcl-2家族的表达和调控是影响细胞凋亡的关键因素之一,bcl-2基因家族包括促进凋亡基因如bax等和抑制凋亡的基因如bcl-2等,过表达bcl-2或下调bax可抑制肿瘤细胞凋亡[12-13]。细胞凋亡的过程也就是Caspase酶被激活,引起“瀑布式”级联反应,对底物进行切割,降解DNA修复酶,使染色体、细胞骨架和核蛋白等裂解成小片段,最终导致细胞死亡[14]。Bcl-2能够通过抑制细胞色素C的释放,从而阻断Caspase断裂重要的细胞内基质,细胞凋亡信号逐级放大,激活的Caspase-3介导细胞死亡[15]。本研究还发现,miR-200c模拟物转染舌癌Tca8113细胞后,细胞凋亡率显著增加,而且与miR-200c模拟物浓度呈正相关。Western-blot结果显示Bcl-2蛋白表达水平下降,而Caspase-3蛋白表达水平增高,说明上调Tca8113细胞中miR-200c的表达,可以降低Bcl-2的表达,从而激活Caspase-3酶的活性,促进细胞凋亡。
综上所述,上调舌癌细胞中miR-200c的表达后,Tca8113细胞增殖水平明显受到抑制,流式细胞术检测显示G0/G1期细胞增加,细胞凋亡率也明显增加,Western-blot结果显示细胞Bcl-2蛋白表达水平降低,Caspase-3活化增强。本实验初步证明miR-200c可以作为舌癌的一种抑癌基因,能够降低与抗凋亡相关基因Bcl-2的表达,通过激活Caspase-3的活化从而抑制舌癌细胞增殖促进其凋亡。针对miR-200c的治疗策略可能会给舌癌的治疗提供新的思路和治疗靶点。
[1]OkamuraK,LadewigE,ZhouL,etal.FunctionalsmallRNAsaregeneratedfromselectmiRNAhairpinloopsinfliesandmammals[J].GenesDev,2013,27(7):778-792.
[2]Pérez-SayánsM,PilarGD,Barros-AngueiraF,etal.CurrenttrendsinmiRNAsandtheirrelationshipwithoralsquamouscellcarcinoma[J].JOralPatholMed,2012,41(6):433-443.
[3]EndoH,MuramatsuT,FurutaM,etal.Potentialoftumor-suppressivemiR-596targetingLGALS3BPasatherapeuticagentinoralcancer[J].Carcinogenesis,2013,34(3):560-569.
[4]JurmeisterS,BaumannM,BalwierzA,etal.MicroRNA-200crepressesmigrationandinvasionofbreastcancercellsbytargetingactin-regulatoryproteinsFHOD1andPPM1F[J].MolCellBio,2012,32(3):633-651.
[5]DavalosV,MoutinhoC,VillanuevaA,etal.DynamicepigeneticregulationofthemicroRNA-200familymediatesepithelialandmesenchymaltransitionsinhumantumorigenesis[J].Oncogene,2012,31(16):2062-2074.
[6]ZhangZ,LiuZB,RenWM,etal.ThemiR-200familyregulatestheepithelial-mesenchymaltransitioninducedbyEGF/EGFRinanaplasticthyroidcancercells[J].IntJMolMed,2012,30(4):856-862.
[7]李莎莎,周旋,张强,等.STAT3与miRNA-21在舌鳞状细胞癌中异常表达的相关性研究[J].中国肿瘤临床,2013,40(6):323-327.
[8]JiaLF,WeiSB,GongK,etal.PrognosticimplicationsofmicoRNAmiR-195expressioninhumantonguesquamouscellcarcinoma[J].PLoSOne,2013,8(2):e56634.
[9]FengX,WangZ,FillmoreR,etal.MiR-200,anewstarmiRNAinhumancancer[J].CancerLett,2014,344(2):166-173.
[10]朱名毅,姚金光,刘津,等.miR-200c在肿瘤发生发展中的研究进展[J].右江民族医学院学报,2014,36(1):80-82.
[11]王晟.miRNA-200c在乳腺癌中的表达及其调控基因网络的筛选[D].南昌:南昌大学,2013.
[12]CzabotarPE,LesseneG,StrasserA,etal.ControlofapoptosisbytheBCL-2proteinfamily:implicationsforphysiologyandtherapy[J].NatRevMolCellBiol,2014,15(1):49-63.
[13]HudsonSG,HalleranDR,NevaldineB,etal.MicroarraydeterminationofBcl-2familyproteininhibitionsensitivityinbreastcancercells[J].ExpBioMed,2013,238(2):248-256.
[14]DhandayuthapaniS,MarimuthuP,HörmannV,etal.InductionofapoptosisinHeLacellsviacaspaseactivationbyresveratrolandgenistein[J].JMedFood,2013,16(2):139-146.
[15]CaliU,CavkaytarS,SirvanL,etal.Placentalapoptosisinpreeclampsia,intrauterinegrowthretardation,andHELLPsyndrome:Animmunohistochemicalstudywithcaspase-3andbcl-2[J].CliExpObstetGynecol,2013,40(1):45-48.
Effects of miR-200c on proliferation and apoptosis of tongue carcinoma Tca8113 cells*
ZhuMingyi1,YaoJinguang2,LiuJin2,JiangYan1△
(1.MedicalScientificExperimentalCenter,YoujiangMedicalUniversityforNationalities,Baise,Guangxi533000,China;2.AffiliatedHospitalofYoujiangMedicalUniversityforNationalities,Baise,Guangxi533000,China)
Objective To investigate the effects of miR-200c on proliferation and apoptosis of tongue squamous cell carcinoma (TCCS) Tca8113 cells.Methods The mimics of miR-200c were transfected into Tca8113 cells using liposome.The Tca8113 cell proliferation was detected by 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) assay.The flow cytometry assay was used to determine the cell cycle and the apoptosis rate of Tca8113 cell.The protein expression levels of Bcl-2 and Caspase-3 in Tca8113 cell was detected by Western-blot.Results The 20,40,80 nmol/L miR-200c mimics groups inhibited the growth of Tca8113 cells,the difference compared with the control group showing statistical significance(P<0.05).The greater the miR-200c mimics concentration and the longer duration of action,the more significant the inhibition effect(P<0.05).After 48h transfecting by miR-200c mimics,the Tca8113 cells were arrested in the G0/G1phases of cell cycle,and the apoptosis rate of the miR-200c mimics groups was significantly increased,the difference compared with the control group showing statistical significance(P<0.05);Western blot verified that the expression amount of Bcl-2 protein in the 20,40,80 nmol/L miR-200c groups was significantly lower than that in the control group,while the expression amount of Caspase-3 protein was significantly higher than that in the control group(P<0.05).Conclusion The overexpression of miR-200c might inhibit the proliferation of Tca8113 cell and induces their apoptosis.
tongue neoplasms;miR-200c;cell proliferation;apoptosis
��·基础研究
10.3969/j.issn.1671-8348.2015.10.009
广西高等学校科研资助项目(201204LX329);右江民族医学院科研资助项目[右医科字(2011)1号]。 作者简介:朱名毅(1982-),讲师,硕士研究生,主要从事肿瘤分子生物学研究。△
,Tel:(0776)2837119;E-mail:jiangyan19852005@126.com。
R
A
1671-8348(2015)10-1322-03
2014-10-30
2014-12-18)
