融合蛋白CR2-GDH固定化及不对称还原制备(S)-4-氯-3-羟基丁酸乙酯
2015-02-18王爽穆晓清聂尧张荣珍徐岩
王爽,穆晓清,聂尧,张荣珍,徐岩
(江南大学生物工程学院工业生物技术教育部重点实验室,江苏 无锡 214122)
融合蛋白CR2-GDH固定化及不对称还原制备(S)-4-氯-3-羟基丁酸乙酯
王爽,穆晓清,聂尧,张荣珍,徐岩
(江南大学生物工程学院工业生物技术教育部重点实验室,江苏 无锡 214122)
比较介孔分子筛材料SBA-15、MCM-41、海藻酸钙、改性二氧化硅4种载体固定化融合蛋白CR2-GDH其酶固载量和酶活回收率,选择SBA-15为固定化载体。研究固定化条件对固定化融合酶量的影响以及固定化酶的稳定性,固定化酶在双相体系催化不对称还原反应。结果表明,在pH值为5.5、酶浓度为1.4mg/mL、反应1h条件下,固定化酶量为27.7mg/g。加入25mmol/L的Ca2+,固定化酶的酶活回收率由58.6%提高到78.1%。与游离酶相比,固定化酶的热稳定性显著提高,40℃条件下酶活回收率提高19.1%。固定化酶水相中反复使用7批次后,剩余活性仍超过30%,具有较好的操作稳定性。与游离酶相比,固定化酶更耐受烷烃类有机溶剂。在水/有机溶剂双相反应体系中,Ca2+/SBA-15固定化酶和游离酶催化相比,产物得率提高23.8%。
融合蛋白;SBA-15;固定化;双相体系;不对称还原
氧化还原酶不对称还原制备手性醇具有绿色高效和成本低廉等优点,是近年来国内外手性合成的研究热点,但氧化还原酶对昂贵的辅酶等当量需求限制了其工业化规模应用[1]。利用多基因共表达和融合表达技术,构建具有辅酶酶法耦联再生的一锅法反应体系,是目前最为有效的解决途径,而葡萄糖脱氢酶能够通过氧化葡萄糖生成NAD(P)H从而实现辅酶再生,研究较为广泛[2-3]。
利用融合表达技术得到的融合蛋白是一种具有辅酶再生能力的多功能蛋白,不仅可以克服利用多基因共表达构建全细胞催化剂带来的底产物传质阻力,也可以减少双酶偶联催化反应中两种催化剂的两步纯化成本[4],具有重要的潜在工业应用价值。利用固定化技术不仅能够实现融合蛋白的重复利用,同时也可以有效改善其稳定性。与目前成功实现的氧化还原酶多酶共固定化[5]相比,融合蛋白固定化过程简单、成本低,是多酶复合反应体系的研究热点。由于氧化还原酶在固定化过程中酶活性容易受到固定化载体的修饰作用而失活,因此目前氧化还原酶主要采用对酶活力影响较小的吸附法[6]。具有高比表面积和规则有序孔道结构的新型介孔分子筛材料,广泛应用于吸附法固定化[7]。Humphrey[8]和董颖超[9]等利用修饰后SBA-15实现了胰蛋白酶固定化,明显提高了操作稳定性和热稳定性,后者通过固定化酶催化,使反应6批次后剩余活性仍超过40%。
本文基于陈星星[10]对羰基还原酶CR2和葡萄糖脱氢酶GDH双酶偶联不对称还原4-氯乙酰乙酸乙酯(COBE)为(S)-4-氯-3-羟基丁酸乙酯(S-CHBE)的研究,将前期表达的融合蛋白CR2-GDH通过固定化载体的选择和固定化条件优化,实现融合蛋白的固定化,并考察其热稳定性、操作稳定性、有机溶剂耐受性,为其工业化应用奠定基础。
1 材料与方法
1.1 材料与仪器
介孔分子筛材料SBA-15、MCM-41,南京吉仓纳米科技有限公司;改性二氧化硅,四川大学功能高分子实验室提供;海藻酸钙,自制。
COBE、(S)-CHBE,Sigma-Aldrich公司;正己烷、异丙醇(色谱纯),damas beta公司;酵母膏、蛋白胨,英国Oxoid公司;其余试剂,中国医药集团。
高速冷冻离心机,美国Sigma公司;XC92-11DN超声破碎仪,南京新辰生物科技有限公司;pH 计、AB204-E分析天平,瑞士Mettler Toledo公司;AKTA purifier,美国GE公司;酶标仪,美国Thermo Fisher Scientific公司;高效液相色谱仪(HPLC),6820A气相色谱仪(GC),美国Agilent公司。
1.2 菌种及培养方法
实验菌种:E. coliBL21/pET-cr2-linter-gdh由作者自己构建。
LB培养基:酵母提取物5g/L,蛋白胨10g/L,氯化钠10g/L,使用前加入氨苄青霉素至终浓度100mg/L,卡那霉素至终浓度50mg/L。
挑取重组菌株性E. coliBL21/ pET-cr2-linter-gdh单菌落接种于5mL的LB液体培养基中(卡那抗性,200r/min,37℃振荡培养12h,按2%的接种量转接于50mL LB液体培养基中(卡那抗性),200r/min,37℃振荡培养至OD600为0.6~0.8后,加入诱导物异丙基-D-硫代半乳糖苷(IPTG)1mmol/L,于17℃下诱导培养10h;10000r/min离心10min并收集菌体,用生理盐水洗涤两次。
1.3 融合蛋白的纯化
将诱导表达后离心获得的E.coliBL21(DE3)/ pET-cr2-linter-gdh湿菌体用缓冲液A(100mmol/L磷酸钾,150mmol/L NaCl,5mmol/L 咪唑)悬浮,超声破碎,离心取上清液待上样进行纯化。用缓冲液A平衡镍柱10min 后上样,先用缓冲液A将未结合的蛋白洗脱下来,再用 0~500mmol/L的咪唑缓冲液进行梯度洗脱,收集洗脱液测定酶活,并用SDS-PAGE 检验蛋白纯度。
1.4 融合蛋白的酶活和蛋白质含量测定
羰基还原酶CR2的酶活测定条件:总反应体系0.1mL,包括0.1mol/L乙酸缓冲液(pH值5.5),1.2mmol/L NADPH,20mmol/L COBE以及适量酶液。
葡萄糖脱氢酶GDH的酶活测定条件:总反应体系0.1mL,包括0.1mol/L乙酸缓冲液(pH 值5.5),1.2mmol/L NADP+,10mmol/L 葡萄糖以及适量酶液。
上述皆在340nm处测定吸光度的变化。
酶活力单位(U)定义为:在上述条件下,每分钟催化1μmol NADP+还原所需的酶量或每分钟催化1μmol NADPH氧化所需的酶量。
蛋白质含量测定采用Bradford法。
1.5 固定化融合蛋白CR2-GDH的制备
取一定量的介孔分子筛材料SBA-15加入到一定浓度的融合蛋白溶液中,将装置置于摇床中,200r/min 振荡一定时间后,将溶液以12000r/min速度离心5min,保留上清液,沉淀用缓冲液洗涤多次,直到检测不到蛋白为止,制得固定化酶,由式(1)、式(2)计算固载率和固载量。

式中,A0为固定化前的融合蛋白量;A1为固定化后上清融合蛋白量,m给酶量为总的给酶量;m载体为载体的质量。
1.6 金属离子对固定化融合蛋白其酶活回收率的影响
用游离酶、相同量游离酶制得的固定化酶、添加25mmol/L Ca2+固定化酶进行催化反应,以游离酶表现出的活性为100%,测得固定化酶的酶活回收率和Ca2+对酶活回收率的影响。
1.7 固定化融合蛋白热稳定性的测定
在不加底物的条件下,将游离酶和固定化酶在不同温度下温育1h,然后进行催化反应,以比较酶固定化前后酶活性的变化。以放在4℃下游离酶和固定化酶为对照100%。
1.8 固定化融合蛋白水相中操作稳定性的测定
第一次反应体系:62.5mmol/L底物COBE,表现出4U的固定化酶。反应产率为100%时,反应时间为2h。对固定化酶已完成催化反应的体系离心分离,用缓冲液清洗固定化酶2~3次,重新进行催化反应,反应时间和第一次完成催化反应的时间一致(2h),定为反应一次。重复上述操作,比较固定化酶表现出酶活随使用次数的变化情况。
1.9 固定化融合蛋白有机溶剂耐受性的测定
取一定浓度的游离酶和相同浓度游离酶固定化后的固定化酶,按照1∶1的体积比(游离酶∶有机溶剂)分别添加不同有机溶剂(正己烷、正辛烷、壬烷、仲辛醇、异丙醇、苯甲醇、异丁醇、丙酮、乳酸乙酯、乙酸乙酯、邻苯二甲酸二丁酯),固定化酶加入与游离酶中相同体积的有机溶剂,于25℃、200r/min 的摇床中震荡1h,将溶液离心分离,弃除有机溶剂,将游离酶和固定化酶进行催化反应,从而测定不同有机溶剂对融合蛋白的影响。以不进行任何处理的游离酶和固定化酶为对照,活性均为100%。
1.10 固定化融合蛋白双相反应体系催化COBE
模式1:起始双相反应体系2mL,COBE浓度125mmol/L,4U游离融合蛋白,反应10h。
模式2:起始双相反应体系2mL,COBE浓度125mmol/L,表现出4U的固定化酶,反应10h。
模式3:起始双相反应体系2mL,COBE浓度125mmol/L,表现出4U的固定化酶,25mmol/L的Ca2+,反应10h。
1.11 固定化融合蛋白在双相反应体系中重复使用性
反应体系:双相反应体系2mL,底物COBE为62.5mmol/L,表现出4U的固定化酶,第一次反应8h,反应完全。按照1.8节中的方法,对其重复使用。
1.12 产物得率及光学纯度检测
检测产物得率及光学纯度的方法参考乐庸堂等[11]报道的方法。
2 结果与讨论
2.1 固定化载体的选择
氧化还原酶固定化方法主要有吸附法、包埋法、包埋和交联法共用等[12-14]。在这几种固定化方法中,吸附法因其对酶活力损失影响最小且不会对酶产生化学修饰广泛研究[6]。本研究主要选用4种载体SBA-15、MCM-41、改性二氧化硅、海藻酸钙包埋对融合蛋白进行固定化研究,考察吸附法和常用的海藻酸钙包埋法对融合蛋白固定化的影响。其中3种载体SBA-15、MCM-41、改性二氧化硅加入20mg,酶量为0.6mg。制备海藻酸钙1.05g,加入融合酶量34.6mg。
介孔分子筛材料作为酶固定化载体方面表现出优越性,源于孔径均一、孔道内富含弱酸性羟基。表1中蛋白固载量和酶活回收率表明不同的固定化材料对氧化还原酶固定化效果具有较大的影响,介孔分子筛材料SBA-15和MCM-41的固定化效果好于其他两种载体固定化,不仅蛋白固载量超过23mg/g,其最终酶活回收率分别达到49.5%和42.4%。SBA-15与MCM-41相比,孔径更大、孔壁更厚,而且具有机械强度高、无毒、耐酸碱、水热稳定性好、成本低等特性[15],因此选择SBA-15作为固定化材料进行研究。

表1 不同载体固定化融合蛋白
2.2 介孔分子筛材料SBA-15固定化融合蛋白
2.2.1 pH值对固定化酶量的影响
缓冲液pH值的变化可以改变处在缓冲液中的酶分子和固定化载体的离子化状态,影响酶和固定化载体的结合。因此缓冲液pH值是影响融合酶固定化关键因素之一。
由图1可以看出,在中性偏碱性条件下,固定化融合蛋白固载量受到较大影响,随着pH值的上升显著下降。在酸性条件下(pH值 5.0~6.0),固定化酶量最大,为25.5mg/g。在不同pH值条件下,固定化酶催化活力也随着pH值的变化而变化。用pH值为6.0的磷酸钾缓冲液制备的固定化酶活力最大,为9.3U/g(g为载体的质量),pH值为5.5缓冲液中制备的固定化酶活力9.1U/g。同时研究表明,固定化酶活力与固定化前所处水溶液的pH值有关。前期研究表明融合蛋白的最适作用pH值为5.5,因此确定固定化最佳条件为pH值为5.5。

图1 pH值对固定化酶量和酶活力的影响
2.2.2 酶浓度对固定化酶量的影响
融合蛋白浓度与固定化载体上的结合点具有饱和性。在一定范围内,载体固载量随着融合蛋白浓度的增加而增加;当融合蛋白浓度超过固定化载体上的结合点时,酶分子之间的活性位点相互作用,降低固载率和固定化酶活力。
从图2中得出,当酶浓度低于1.4mg/mL时,随着酶浓度的增加,材料的吸附量呈线性增加,固载率维持在96%以上;当酶浓度超过1.4mg/mL时,融合蛋白固定量饱和,固载率线性下降。综合考虑固载量和固载率,当酶浓度为1.4mg/mL时固定化效果较佳,此时酶的固定量为27.7mg/g。
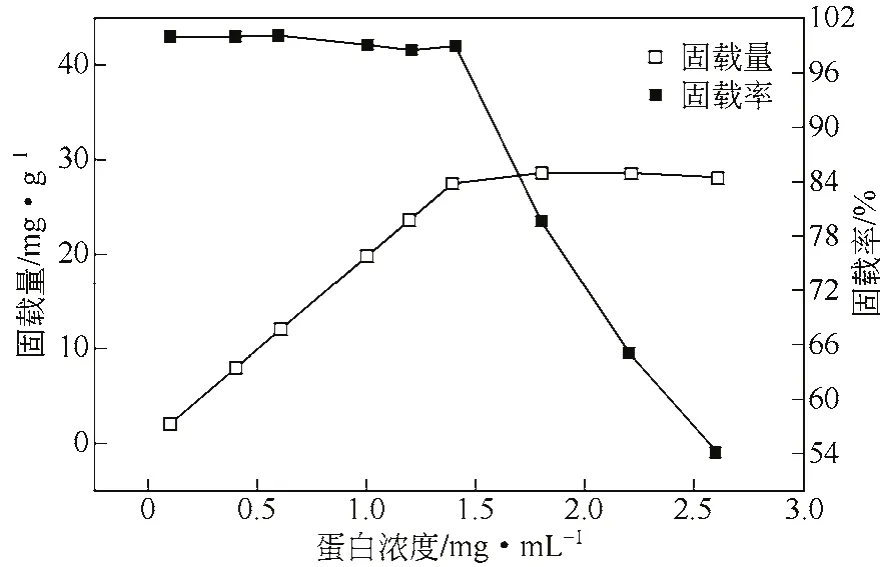
图2 酶浓度对固定化酶量的影响
2.2.3 时间对固定化酶量的影响
在吸附开始阶段,由于一部分融合酶分子与介孔分子筛材料孔口及靠近孔口孔道内的羟基作用,融合酶分子停留在载体的孔口处,另一部分酶分子需克服扩散阻力才能进入到介孔分子筛的孔道内部,所以研究时间对载体吸附酶量的影响至关重要。以SBA-15为载体,在酶浓度为1.4mg/mL时考察不同固定化时间载体对固定化酶的吸附量影响,结果见图3。
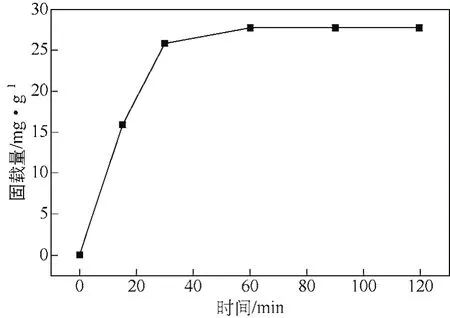
图3 固定化时间对固定化酶量的影响
由图3可知,介孔分子筛材料吸附的酶量随时间延长逐渐增加,当吸附时间为1h时,固定化酶量达到最大值27.7mg/g。再延长时间,载体吸附的酶量不变,载体已达到吸附饱和。
2.2.4 金属离子Ca2+对固定化融合蛋白活性的影响
在对影响固定化的条件优化后,其固定化酶量达到最大值。固定化酶表现的活性也是另一主要研究目标。在催化氧化还原反应时,许多氧化还原酶需要金属离子的参与,有些金属离子可以激活或抑制氧化还原酶的活性[16]。
25mmol/L的Ca2+可以提高游离融合酶的活性,所以在固定化酶水相催化反应中添加金属离子,研究其对固定化酶活性的影响。本研究以相同条件下,游离酶催化反应的活性为100%,结果如表2。从表2中得到,固定化后酶的活性为游离酶的58.6%,加入25mmol/L Ca2+后活性为游离酶的78.1%,提高近20%。金属离子对固定化酶存在一定的激活作用。

表2 Ca2+对固定化酶的酶活回收率影响
2.3 固定化酶的稳定性
2.3.1 热稳定性
许多研究表明,固定化操作能够有效提高酶蛋白的刚性结构,从而有效提高固定化酶的热稳定性。研究比较了30~60℃下固定化融合蛋白和游离蛋白的催化活力。
由表3可知,游离酶经热处理后,酶活性显著下降,30℃酶活只有89.3%,但是固定化酶保持97.3%的活性。在高温条件下(大于50℃)固定化酶和游离酶都几乎失去活性。整体看固定化酶的热稳定性有所提高。这可能是由于一方面介孔分子筛孔道结构提供给酶分子不易受外部环境影响的微环境,另一方面孔道表面的弱酸性羟基能够保护酶分子的构象不易被高温破坏[9]。

表3 固定化酶及游离酶热稳定性影响
2.3.2 水相中操作稳定性
固定化酶可从反应系统中分离,从而实现其重复利用,固定化酶的操作稳定性是评价固定化酶的重要参数。
由图4可知,固定化酶在使用5次后,依旧保持50%以上的相对活性,连续反应7批次后酶剩余活性仍保持在30% 以上,说明采用介孔分子筛材料为载体制备的固定化酶具有较好的操作稳定性。
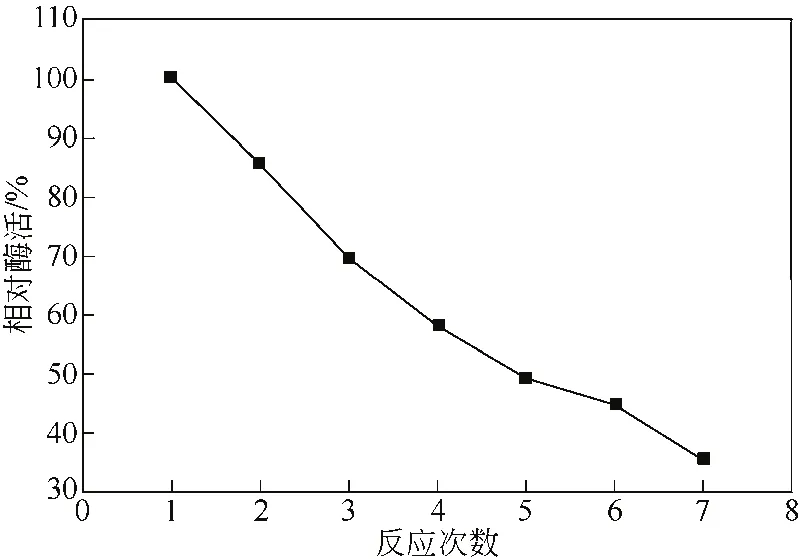
图4 固定化酶的操作稳定性
2.3.3 有机溶剂耐受性
采用融合蛋白CR2-GDH催化COBE为S-CHBE模式反应。高浓度的底物和产物对酶有毒害和抑制作用,且底、产物在单一水相中溶解度低,一般构建水/有机溶剂双相反应体系以克服上述问题。探讨固定化酶对有机溶剂的耐受性至关重要。
有机溶剂的lgP值(疏水常数)是溶剂在正丁醇/水体系中分配常数的对数值,是评价有机溶剂对酶催化剂影响的一个重要参数[10]。
实验中,将游离酶和固定化酶分别放在有机溶剂中,有机溶剂分为烷烃类、醇类、酯类、丙酮等。从表4中可以看出,固定化酶在有机溶剂耐受性方面较游离酶有一定优势,对于烷烃类有机溶剂,固定化酶在正己烷、正辛烷、壬烷中放置后,其相对活性仍然保持76.6%、70.4%、72.5%,游离酶则是维持29.7%、38.1%、36.5%的活性。在所选的醇类物质中固定化酶和游离酶活性受到抑制,但是在仲辛醇中游离酶和固定化酶表现出90%以上的活性,源于仲辛醇的lgP值大于其他几种醇。酯类有机溶剂中,对于高lgP的邻苯二甲酸二丁酯,固定化酶可以保持91.1%的活性,固定化酶和游离酶在其余两种较低lgP的酯类中完全失去活性。
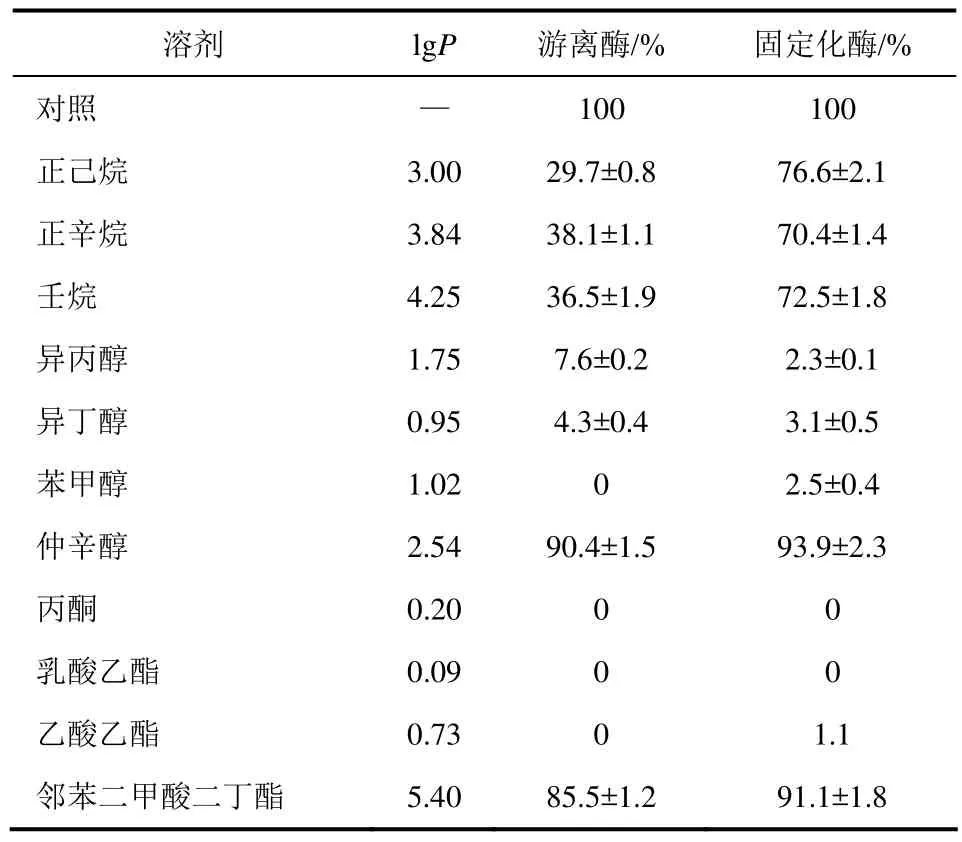
表4 固定化酶的有机溶剂耐受性
2.4 固定化酶双相反应和双相体系中重复使用性
2.4.1 固定化酶双相反应
由研究报道,采用吸附法固定的固定化酶适于在有机相中催化反应,可以解决水相中酶脱落导致下游产物分离的难题[6,17]。根据1.9节中固定化酶的有机溶剂耐受性实验,发现固定化酶在邻苯二甲酸二丁酯中的酶活性依旧保持91.1%。而且文献报道底物COBE、产物S-CHBE在邻苯二甲酸二丁酯中的分配系数为6.2、4.2[18]。所以本研究选择邻苯二甲酸二丁酯为有机相,进行后续研究。鉴于Ca2+在固定化酶水相中可以提高固定化酶的活力回收率,所以在有机相中也添加25mmol/L的Ca2+来研究其影响。结果见图5。

图5 双相中不同反应体系催化还原COBE的时间过程曲线
研究结果表明,在相同反应条件下,3种反应体系的产物得率有不同程度的提高(44.9%~68.7%)。图5 所示为3种反应体系催化还原COBE的时间过程曲线。可以看出,在反应前2h,3种反应体系反应都十分迅速,之后酶在反应体系中会失去部分活性,得率变化不明显。游离酶在4h 后产物得率逐渐趋于平缓,固定化酶的产率仍有一定的提高,可见固定化酶和游离酶相比,有机溶剂耐受性更强。对于添加25mmol/L的Ca2+的反应体系,在反应前2h内,得率远高于其他两种体系,最终的产物得率达到68.7%。反应产物的光学纯度都>99.9%。
2.4.2 固定化酶在双相体系重复使用性
结合2.3.2节中固定化酶在水相中操作稳定性和2.4.1节中固定化酶在水/有机双相中的催化研究,固定化酶在双相体系中的重复使用性研究至关重要。
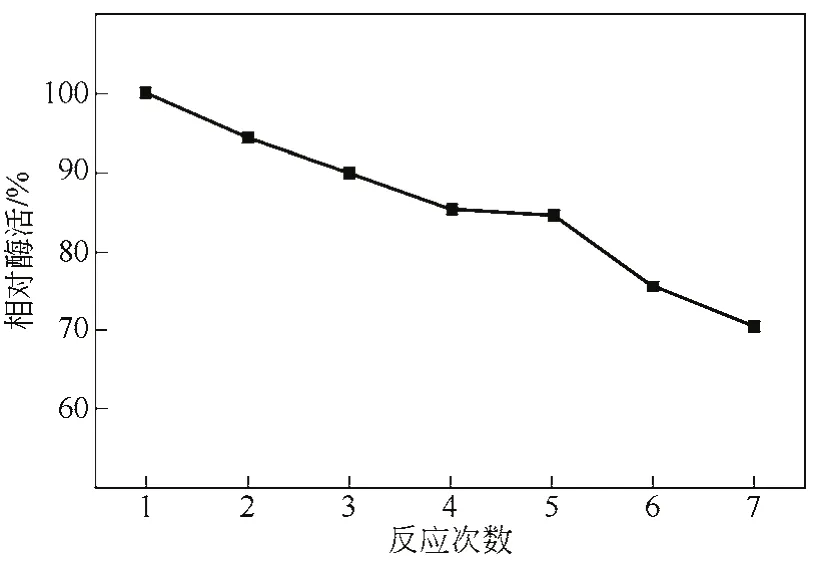
图6 双相中固定化酶重复使用性
由图6可知,固定化酶可以实现双相中重复使用。随着固定化酶使用次数的增加,相对剩余活力为下降趋势。固定化酶在双相体系中连续催化反应7次,相对酶活力依旧保持70.3%。相比于在水相中的稳定性,固定化酶在有有机介质中酶稳定性显著增加,源于底物在固定化酶和有机介质中分配,疏水性底物在载体周围浓度较低。
3 结 论
介孔分子筛材料SBA-15可作为固定化融合蛋白CR2-GDH的较佳载体。材料为10mg,控制酶蛋白浓度为1.4mg/mL,pH值为5.5,固定化时间为1h,此时固载量为27.7mg/g。加入25mmol/L的Ca2+,可以提高固定化酶的酶活回收。
和游离酶相比,固定化酶的热稳定性、有机溶剂耐受性有所提高。固定化酶连续反应7批次后酶剩余活性仍保持在30% 以上,而游离酶不能达到多批次利用的效果。
选择邻苯二甲酸二丁酯为有机相,进行固定化酶催化双相反应。添加25mmol/L的Ca2+的固定化酶反应体系,产物得率比游离酶体系提高23.8%。固定化酶在双相中可以实现多批次使用,重复使用7次后,相对活性依旧保持70.3%。
[1] Schoemaker H E,Mink D,Wubbolts M G. Dispelling the myths-biocatalysis in industrial synthesis[J].Science,2003,299:1694-1697.
[2] Xu Z,Liu Y,Fang L,et al. Construction of a two-strain system for asymmetric reduction of ethyl 4-chloro-3-oxobutanoate to (S)-4-chloro-3-hydroxybutanoate ethyl ester[J].Appl. Microbiol. Biotechnol.,2006,70:40-46.
[3] Qi Y,Ouyang P,Ying H. A review-biosynthesis of optically pure ethyl (S)-4-chloro-3-hydroxybutanoate ester:Recent advances and future perspectives[J].Appl. Microbiol. Biotechnol.,2011,89:513-522.
[4] Motejadded H,B Kranz,S Berensmeier,et al. Expression,one-step purification,and immobilization of HaloTag(TM) fusion proteins on chloroalkane-functionalized magnetic beads[J].Applied Biochemistry and Biotechnology,2010,162:2098-2110.
[5] Liu W ,Zhang S,Wang P. Nanoparticle-supported multi-enzyme biocatalysis within situcofactor regeneration[J].Journal of Biotechnology,2009,139:102-107.
[6] Brady D,Jordaan J. Advances in enzyme immobilisation[J].Biotechnology Letters,2009,31:1639-1650.
[7] 黄勇,谌伟庆,石秋杰,等. 介孔分子筛SBA-15在催化领域的应用进展[J]. 化工进展,2009,28(12):2140-2145.
[8] Yiu H H P,Wright P A,Botting Nigel P. Enzyme immobilisation using SBA-15 mesoporous molecular sieves with functionalised surfaces[J].Journal of Molecular Catalysis B:Enzymatic,2001,15:81-92.
[9] 董颖超,齐涛,秦玉昌. 介孔材料SBA-15固定化胰蛋白酶的研究[J]. 现代食品科技,2007,23(11):19-21.
[10] 陈星星. 酶偶联法不对称还原潜手性β-酮酯类化合物的研究[D].无锡:江南大学生物工程学院,2012.
[11] 乐庸堂,徐岩,穆晓清. 近平滑假丝酵母全细胞催化不对称还原反应:底(产)物抑制及其解除[J]. 过程工程学报,2011,11(6):1038-1043.
[12] Nicolau E,Mendez J,Fonseca J J,et al. Bioelectrochemistry of non-covalent immobilized alcohol dehydrogenase on oxidized diamond nanoparticles[J].Bioelectrochemistry,2012,85:1-6.
[13] Nagayama K,Spieß A C,Büchs J. Enhanced catalytic performance of immobilizedParvibaculum lavamentivoransalcohol dehydrogenase in a gas phase bioreactor using glycerol as an additive[J].Chemical Engineering Journal,2012,207-208:342-348.
[14] Betancor L,Berne C,Luckarift H R,et al. Coimmobilization of a redox enzyme and a cofactor regeneration system[J].Chem. Commun.(Camb.),2006(34):3640-3642.
[15] Zhao Dongyuan,Feng Jianglin,Huo Qisheng,et al. Triblock copolymer syntheses of mesoporous silica with periodic 50 to 300 angstrom pores[J].Science,1998,279:548-552.
[16] 羊明,徐岩,穆晓清,等. 一种新的高立体选择性羰基还原酶的性质及分离[J]. 化工进展,2006,25(9):1082-1088.
[17] Takaç S,Bakkal M. Impressive effect of immobilization conditions on the catalytic activity and enantioselectivity ofCandida rugosalipase towardS-Naproxen production[J].Process Biochemistry,2007,42(6):1021-1027.
[18] He Junyao,Sun Zhihao,Ruan Wenquan. Biocatalytic synthesis of ethyl (S)-4-chloro-3-hydroxy butanoate in an aqueous-organic solvent biphasic system using Aureobasidium pullulans CGMCC 1244[J].Process Biochemistry,2006,41:244-249.
·图书资讯·
化学工业出版社好书推荐

《表面活性剂应用原理》(第二版)
肖进新、赵振国 编著
本书主要介绍表面活性剂的结构、基本性质和应用功能。介绍了表面活性剂应用原则,针对表面活性剂科学的最新发展,介绍了表面活性剂在众多工业领域及高新技术领域的广泛应用,包括具有特殊结构和功能的新型表面活性剂、功能性表面活性剂和特种表面活性剂等。最后介绍了表面活性剂的绿色化学,包括表面活性剂的生物降解、安全性和温和性等。本次版本对表面活性剂最新理论进展和应用进行了必要的修订和补充。
书 号:978-7-122-24224-2 定价:98.0元
出版时间:2015年10月 开本:16

《耦合技术与萃取过程强化》(第二版)
戴猷元、秦炜、张瑾 编著
本书主要介绍了“场”、“流”分析的基本概念,有机物稀溶液络合萃取过程,外场强化萃取过程,萃取反萃取交替过程,膜萃取过程,同级萃取反萃膜过程,萃取与发酵耦合过程,酶膜反应过程及亲和膜过程及其他萃取强化过程。系统阐述了耦合技术及新型萃取过程的基本原理、过程特征、各类体系的分离工艺和应用实例。本次修订对近几年“耦合技术”、“过程强化”的新应用进行了补充。
本书可作为高等院校化工、生物化工、环境、制药等专业师生的参考书,也可供上述专业从事分离过程研究开发、设计和运行的工程技术人员使用。
书 号:978-7-122-24080-4 定价:88.0元
出版时间:2015年10月 开本:16
如需更多图书信息,请登录www.cip.com.cn 服务电话:010-64518888,64518899(销售中心)
也可登录当当网、京东商城、卓越网搜索书名下单购买
邮购地址:(100011)北京市东城区青年湖南街13号 化学工业出版社
如要出版新著,请与编辑联系。联系电话:010-64519457
Immobilization of fusion enzyme CR2-GDH and bioreduction of ethyl (S)-4-chloro-3-hydroxybutyrate
WANG Shuang,MU Xiaoqing,NIE Yao,ZHANG Rongzhen,XU Yan
(The Key Laboratory of Industrial Biotechnology,Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,Jiangsu,China)
Mesoporous molecular sieves SBA-15 was the best one among 4 kinds of carriers in terms of both carrier content and recovery of enzyme activity. The remaining carriers were MCM-41,modified silica,and calcium alginate. Immobilization of fusion enzyme CR2-GDH on SBA-15 was realized,and effect of immobilization conditions on immobilization content and activity,stabilization of immobilized enzyme,asymmetric reduction in biphasic system was investigated. The results showed that adsorption capacity was 27.7mg/g carrier under the condition of pH5.5,enzyme concentration 1.4mg/mL,reaction time of one hour. The recovery of immobilized enzyme activity was increased by near 20% adding metal ion Ca2+of 25mmol/L. It was also found that the thermal and operational stabilities of the immobilized enzyme were higher than those of free enzyme. The recovery was increased by 19.1% at the temperature of 40℃. Immobilized enzyme was not more sensitive to organic solvents especially alkanes than free enzyme. In biphasic system,the production yield obtained by Ca2+/SBA-15 immobilized enzyme was increased by 23.8%.
fusion enzyme ; SBA-15; immobilization; biphasic system; bioreduction
Q 814.2
:A
:1000-6613(2015)11-4047-07
10.16085/j.issn.1000-6613.2015.11.036
2015-03-06;修改稿日期:2015-04-08。
王爽(1989—),女,硕士研究生。联系人:聂尧,教授,主要研究方向为生物催化。E-mail nieybird@hotmail.com。
