二氧化钛纳米材料对氧化应激状态大鼠肾脏的毒性
2015-02-18沙保勇景晓红
沙保勇,刘 洁,冯 浩,景晓红,高 巍
(1.西安医学院基础医学部基础医学研究所,陕西西安 710021;2.西安交通大学医学部第一附属医院麻醉科,陕西西安 710061)
随着纳米技术的迅猛发展,纳米级二氧化钛(nano-TiO2)被广泛应用于化妆品、纺织、塑料、涂料、造纸、食品加工及其包装材料等领域,给人们生产、生活提供了便利,但是其生物安全性逐渐受到关注,近年来成为研究热点[1-3]。
因其用途广泛,纳米TiO2可通过呼吸系统、消化过程、皮肤接触等途径进入机体。已有研究表明,纳米TiO2可引发正常机体的炎症和氧化应激(oxidative stress,OS)反应,并造成肺、肝、肾等多个重要脏器的损伤[4-8]。但目前对纳米TiO2毒性研究多以正常培养细胞或健康动物为基础,而对疾病状态(尤其是氧化应激状态)下的纳米材料毒性研究鲜有报道。
糖尿病肾病是糖尿病最严重和最常见的慢性并发症之一。据统计,我国糖尿病肾病患者占肾病患者的比例超过40%。而OS在糖尿病肾病的发生、发展中起重要作用[9-10]。本研究通过四氧嘧啶构建SD大鼠OS模型,并对正常和OS大鼠进行纳米TiO2染毒,研究其对肾脏的不良影响,希望为纳米材料的安全使用提供实验依据。
1 材料与方法
1.1 材料 纳米TiO2、四氧嘧啶和尿素氮(BUN)检测试剂盒购自Sigma公司上海分公司。超氧阴离子自由基(O2-·)、谷胱甘肽(GSH)、超氧化物歧化酶(SOD)酶联免疫吸附试剂盒购自罗氏和南京建成公司。其他为国产市售分析纯试剂。
1.2 纳米TiO2表征及其悬液配制 纳米TiO2的形态、晶体结构和电位分别通过西安交通大学JEM-2100F高分辨率TEM显微镜、JSM-6700FSEM显微镜、XRD-7000sX射线衍射仪和Nano ZS90马尔文粒度仪检测获得。纳米TiO2比表面积由BET法测得。
纳米TiO2经140℃干热灭菌后,溶于生理盐水中,超声混匀,配制成0.5、5、50mg/mL 的悬液,4℃保存备用。为尽可能减少TiO2纳米材料的凝聚,每次使用前,纳米TiO2需超声振荡30min。
1.3 动物分组 所有动物实验获得了动物实验管理委员会的批准,并符合动物实验管理条例及保护指南。正常健康雄性SD大鼠36只,体质量为(210±15)g,购自西安交通大学动物实验中心。随机分为正常对照组、OS组(只用四氧嘧啶处理)、NM组(只用TiO2纳米材料处理)和OS-NM组(四氧嘧啶和纳米TiO2共同处理)。
1.4 OS模型的构建与纳米TiO2染毒及毒性检测OS组大鼠通过肌肉注射四氧嘧啶,构建OS模型。其剂量为70mg/kg体质量,分别于注射24、48、72h后取肾组织,检测与OS相关生化指标O2-·、GSH和SOD,并通过监测BUN水平变化及肾脏苏木精-伊红(HE)染色评估四氧嘧啶对肾脏的损伤情况,以获得四氧嘧啶的最佳作用时间。
NM组和进行造模的OS-NM组大鼠通过一次性腹腔注射纳米TiO2的方式进行染毒,剂量为0.5、5、50mg/kg体质量。正常对照组不作任何处理。
染毒48h后,处死各组动物并取血清分析BUN,取肾脏组织制备病理切片并检测O2-·、GSH和SOD等OS生化指标。
2 结 果
2.1 纳米TiO2的表征 本研究所用的纳米TiO2类似棒状,长45~60nm,直径12~18nm,形态如图1中A、B(TEM和SEM)所示。X射线衍射仪测定得到的衍射图谱(图1C),经与国际衍射数据库(JCPDS-ICDD)比较,确定其为金红石型纳米TiO2材料。经Nano ZS90马尔文粒度仪测得纳米材料带负电,电位为(-37.8±3.9)mV(图1D)。BET法测得纳米TiO2的比表面积为158~175m2/g。

图1 纳米TiO2材料的表征Fig.1 Characterizations of nano-TiO2material
2.2 大鼠OS模型的构建 四氧嘧啶注射24、48和72h后,O2-·、GSH和SOD变化结果如图2A所示。与正常对照组大鼠相比,四氧嘧啶注射24h就能导致O2-·水平升高(P<0.05),GSH和SOD的浓度降低(P<0.05);且四氧嘧啶注射72h后,以上3种OS指标变化仍具有统计学意义(P<0.05)。四氧嘧啶注射后,大鼠BUN水平变化差异无统计学意义(图2B)。与正常大鼠肾脏HE染色切片(图2C)相比,四氧嘧啶注射72h未诱发大鼠肾脏出现明显病理改变(图2D)。可见,四氧嘧啶注射24h便可诱发OS状态,该状态能持续至少48h且不损伤肾组织。

图2 大鼠OS模型的OS指标变化及肾脏BUN与病理改变Fig.2 Changes of OS indices,BUN and renal pathology in rat OS model
2.3 纳米材料对肾脏的毒性 基于大鼠OS模型,四氧嘧啶诱发OS状态持续48h且不损伤肾组织,所以本研究纳米TiO2的作用时间为48h。纳米材料染毒后,所有大鼠未出现死亡现象,活动、饮食等均正常。与正常对照组大鼠肾脏相比,NM组大鼠染毒48h,仅50mg/kg体质量纳米TiO2组出现肾小球肿胀、局灶性细胞数目增多等形态学改变;而OS-NM组大鼠,当纳米TiO2剂量超过5mg/kg体质量时,可见肾小球体积增大、细胞数目增多、肾小管上皮细胞水肿等病理性改变(图3)。纳米TiO2诱导NM组和OS-NM组大鼠BUN显著性增高的剂量分别是50mg/kg和5mg/kg体质量(P<0.05);当腹腔注射的纳米材料超过5mg/kg体质量时,经相同剂量的纳米TiO2染毒后,NM组与OS-NM组大鼠的BUN浓度差异有统计学意义(P<0.01,图4)。这表明,纳米TiO2能损伤正常及OS大鼠的肾脏,且OS状态加剧了纳米材料对肾脏的损伤。
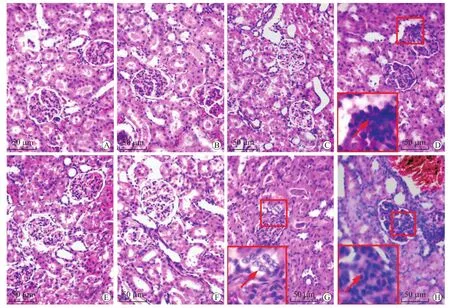
图3 大鼠肾脏HE染色结果Fig.3 HE staining of rat kidney(×400)

图4 纳米TiO2对大鼠BUN的影响Fig.4 Effects of nano-TiO2on BUN level in rats
2.4 肾脏OS指标变化 纳米TiO2染毒48h,检测肾组织O2-·、GSH和SOD生化指标变化,当注射5mg/kg体质量纳米材料时,OS-NM组大鼠O2-·和SOD的较OS组和NM组分别增高,差异均有统计学意义(P<0.05,图5A);当注射50mg/kg体质量纳米材料时(图5B),OS-NM组大鼠的O2-·、GSH和SOD水平与OS组及NM组分别比较,差异极显著(P<0.01);且 OS组与 NM 组相比较,O2-·和GSH的变化差异有统计学意义(P<0.05)。但注射0.5mg/kg体质量纳米材料时,OS组、NM组和OSNM组大鼠的OS指标相比较差异均无统计学意义。
以四氧嘧啶和纳米TiO2为两因素,对O2-·、GSH和SOD进行单因变量多因素方差分析后发现,四氧嘧啶与纳米TiO2在导致O2-·水平升高的过程中存在协同作用(F(3,16)=17.65,P=0.024)。也就是说,与单一因素相比,四氧嘧啶与纳米TiO2通过协同效应能诱发更为严重的OS状态,加重对肾脏的损伤。
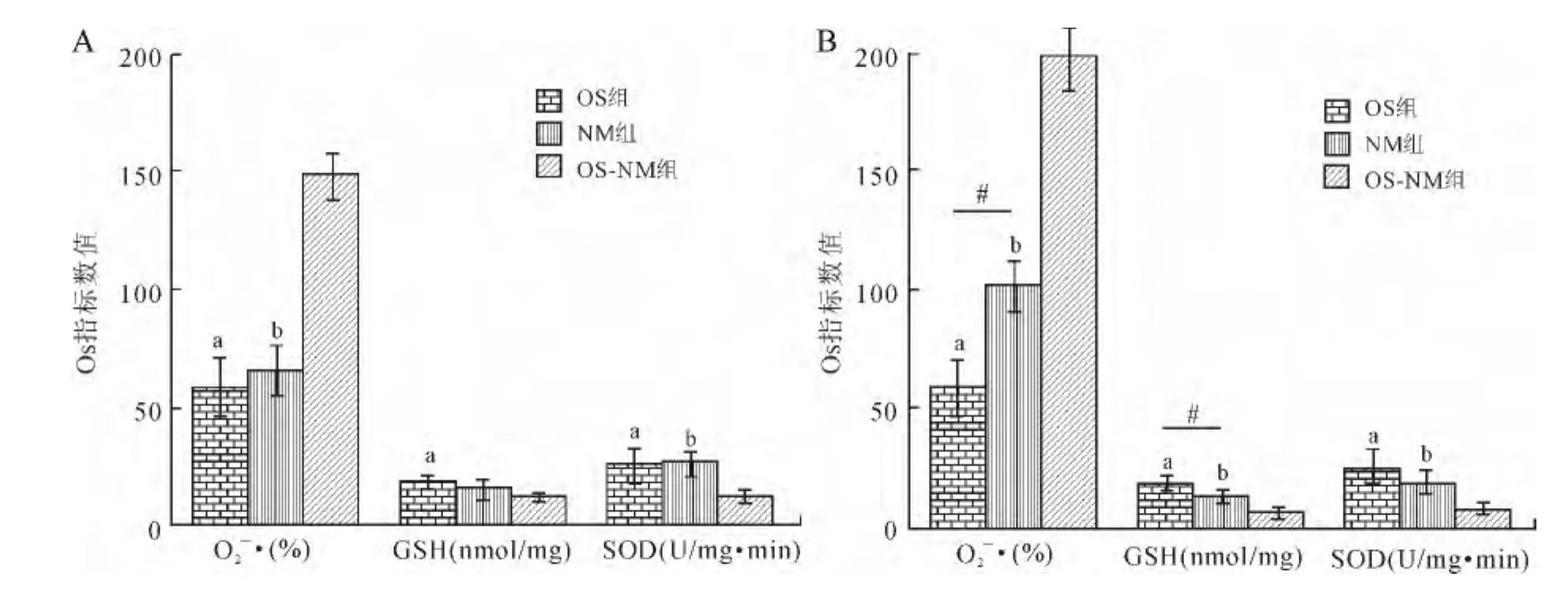
图5 四氧嘧啶与纳米TiO2对肾脏OS指标的影响Fig.5 Effects of alloxan and nano-TiO2on oxidative stress indices of rat kidney
3 讨 论
基于纳米TiO2在日常生活中的广泛应用以及糖尿病肾病的高发生率,本实验以四氧嘧啶制备大鼠OS模型,观察纳米TiO2对正常及OS大鼠肾脏的影响。结果表明,纳米TiO2对正常及OS大鼠肾组织均有损伤,且四氧嘧啶与纳米TiO2间的协同效应能加剧肾脏的损伤。
本研究以注射四氧嘧啶的方式制备大鼠OS模型,四氧嘧啶对啮齿目动物的胰岛β细胞具有特殊的破坏作用,能抑制胰岛素分泌,通过产生自由基引起糖尿病[11]。已有研究证明,四氧嘧啶注射超过72h能损伤SD大鼠重要脏器肝脏[12]。因此,本实验中四氧嘧啶的最长作用时间为72h,且结果显示四氧嘧啶注射24h便可诱发OS状态,该状态能持续至少48h且无肾脏损伤。
BUN是反映肾功能的主要指标,其可通过血液循环经肾小球滤过后随尿液排出体外[13]。若肾功能受损,肾小球的滤过功能损伤,其排除尿素的能力自然下降,最终导致血中BUN水平升高。本研究发现注射四氧嘧啶制备OS大鼠模型及纳米TiO2组的血清中BUN的水平明显上升,并引起组织学上的肾小球肿胀和毛细血管充血,以及肾小管上皮细胞空泡变性,可能是因为纳米TiO2颗粒小,进入体内后很难清除,所以在肾脏中导致大量滞留并引起肾小球滤过功能的变化[14]。
纳米TiO2产生毒性的重要机制之一是诱导机体内自由基水平升高,而自由基的异常积累和GSH的过度损耗会破坏氧化-抗氧化平衡,并产生OS[15-16]。本研究中,纳米TiO2能加剧OS状态下肾脏的损伤,可能与四氧嘧啶与纳米TiO2能协同导致O2-·水平的升高,诱发更为严重的OS状态有关。近年的研究表明,OS在糖尿病肾病的发生和发展中发挥了至关重要的作用,增多的自由基会导致肾小球基底膜磷脂发生过氧化,损伤基底膜并使其增厚,增多糖基化终末产物并导致肾脏细胞的凋亡[17-19]。因此,糖尿病肾病患者应科学对待纳米TiO2产品,避免因误用诱发严重的OS状态。
综上所述,与正常健康大鼠相比,纳米材料TiO2能加重OS大鼠肾脏的损伤,潜在机制为四氧嘧啶与纳米TiO2能协同诱发更为严重的OS状态。本研究为疾病患者科学、安全接触纳米TiO2提供了一定的参考和实验依据。
[1]KOCBEK P,TESKAC K,KREFT ME,et al.Toxicological aspects of long-term treatment of keratinocytes with ZnO and TiO2 nanoparticles[J].Small,2010,6(17):1908-1917.
[2]CHEN X,MAO SS.Titanium dioxide nanomaterials:synthesis,properties,modifications,and applications[J].Chem Rev,2007,107(7):2891-2959.
[3]SONG Z,HRBEK J,OSGOOD R.Formation of TiO2nanoparticles by reactive-layer-assisted deposition and characterization by XPS and STM[J].Nano Lett,2005,5(7):1327-1332.
[4]WANG J,ZHOU G,CHEN C,et al.Acute toxicity and biodistribution of different sized titanium dioxide particles in mice after oral administration[J].Toxicol Lett,2007,168(2):176-185.
[5]NURKIEWICZ TR,PORTER DW,BARGER M,et al.Systemic microvascular dysfunction and inflammation after pulmonary particulate matter exposure[J].Environ Health Perspect,2006,114(3):412-419.
[6]SEMETE B,BOOYSEN L,LEMMER Y,et al.In vivo evalua-tion of the biodistribution and safety of PLGA nanoparticles as drug delivery systems[J].Nanomedicine,2010,6(5):662-671.
[7]ZHANG Q,KUSAKA Y,SATO K,et al.Differences in the extent of inflammation caused by intratracheal exposure to three ultrafine metals:role of free radicals[J].J Toxicol Environ Health A,1998,5 3(6):423-438.
[8]AFAQ F,ABIDI P,MATIN R,et al.Cytotoxicity,pro-oxidant effects and antioxidant depletion in rat lung alveolar macrophages exposed to ultrafine titanium dioxide[J].J Appl Toxicol,1998,18(5):307-312.
[9]KITADA M,KUME S,IMAIZUMI N,et al.Resveratrol improves oxidative stress and protects against diabetic nephropathy through normalization of Mn-SOD dysfunction in AMPK/SIRT1-independent pathway[J].Diabetes,2011,60(2):634-643.
[10]PIWKOWSKA A,ROGACKA D,AUDZEYENKA I,et al.High glucose concentration affects the oxidant-antioxidant balance in cultured mouse podocytes[J].J Cell Biochem,2011,112(6):1661-1672.
[11]SZKUDELSKI T.The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas[J].Physiol Res,2001,50(6):537-546.
[12]SHA B,GAO W,WANG S,et al.Oxidative stress increased hepatotoxicity induced by nano-titanium dioxide in BRL-3A cells and Sprague-Dawley rats[J].J Appl Toxicol,2014,34(4):345-356.
[13]MAZZE RI,CALLAN CM,GALVEZ ST,et al.The effects of sevoflurane on serum creatinine and blood urea nitrogen concentrations:a retrospective,twenty-two-center,comparative evaluation of renal function in adult surgical patients [J].Anesth Analg,2000,90(3):683-688.
[14]CHEN J,DONG X,ZHAO J,et al.In vivo acute toxicity of titanium dioxide nanoparticles to mice after intraperitioneal injection[J].J Appl Toxicol,2009,29(4):330-337.
[15]FOSTER KA,GALEFFI F,GERICH FJ,et al.Optical and pharmacological tools to investigate the role of mitochondria during oxidative stress and neurodegeneration[J].Prog Neurobiol,2006,79(3):136-171.
[16]FINKEL T,HOLBROOK NJ.Oxidants,oxidative stress and the biology of ageing[J].Nature,2000,408(6809):239-247.
[17]SUSZTAK K,RAFF AC,SCHIFFER M,et al.Glucose-induced reactive oxygen species cause apoptosis of podocytes and podocyte depletion at the onset of diabetic nephropathy[J].Diabetes,2006,55(1):225-233.
[18]魏海峰,李才,方艳秋,等.单宁酸对高糖和糖化终末产物培养条件下肾小球系膜细胞氧化应激及微炎症状态的改善作用[J].吉林大学学报:医学版,2014,40(5):1007-1012.
[19]WU J,MEI C,VLASSARA H,et al.Oxidative stress-induced JNK activation contributes to proinflammatory phenotype of aging diabetic mesangial cells[J].Am J Physiol Renal Physiol,2009,297(6):F1622-1631.
