运动和肥胖诱导下大鼠植物神经对安静心率调节作用的机制研究
2015-02-15杨月琴谢敏豪
杨月琴,赵 岩,谢敏豪,夏 志
运动和肥胖诱导下大鼠植物神经对安静心率调节作用的机制研究
杨月琴1,2,赵 岩2,谢敏豪2,夏 志3,4
目的:本研究通过高脂高糖饮食和运动能力测试,建立肥胖大鼠跑台运动模型,探讨运动及肥胖干预下,大鼠植物神经对心率调节作用的影响及机制,为运动风险评估提供敏感的心血管监测指标。方法:4周龄雄性Sprague-Dawley大鼠,随机分为2组:普食组(C组)和高脂高糖饮食组;8周后,从高脂高糖饮食组中挑选出肥胖大鼠(F组),再随机分为3组:肥胖对照组(FC组),肥胖中等强度运动组(FM组)和肥胖大强度运动组(FH组)。肥胖大鼠适应性运动2周后,进行8周运动训练。测试大鼠在安静状态、交感神经及迷走神经阻断下的心率及变化。Elisa及RT-PCR测试迷走神经心内调节关键因子M2受体、Kir3.4以及RGS6含量。结果:1)8周后,F组大鼠HR显著低于C组(P<0.05);2)C组18周时,HR显著小于8周时HR(P<0.05),但18周时,C组HR与FC组间,以及FC组HR与其8周时HR间无显著差异;3)C组与FC组间以及各肥胖组组间神经传导阻断后,心率变化值无显著差异;4)FC组大鼠Kir3.4显著大于C组(P<0.05);5)C组M2受体mRNA显著小于FC组(P<0.05),RGS6 mRNA显著大于FC组(P<0.05);6)FC组M2受体mRNA显著大于FM组(P<0.05)和FH组(P<0.05)。结论:肥胖发生时,植物神经心率调节平衡以迷走神经占主导作用,肥胖进一步发展后,植物神经心率调节以交感神经占主导作用。8周运动训练未能改变肥胖大鼠植物神经的心率调节功能。
运动;植物神经;安静心率;肥胖;动物实验;鼠
1 研究背景
安静心率(Heart Rate,HR)是一项简单常用的机能评定指标,受植物神经调控,反映了安静状态下植物神经的功能状态,能够有效评估机体的机能水平、健康水平及运动风险。随着人们生活水平的提高及现代化生活方式的形成,肥胖的发生日趋严重,它是心血管疾病的高发因素之一,其伴随的植物神经功能紊乱是心血管疾病的先兆。肥胖患者常伴有安静HR增加,并且,安静HR的增加可能参与了肥胖患者隐性高血压的发病过程[1]。超重者主要表现为迷走神经功能受损,活性降低,肥胖表现为交感神经功能受损,活性增加[3]。为了增强体质,提高生活质量,人们常选择有效的规律运动来达到减脂、健身的目的。
目前,关于肥胖发生发展过程中,植物神经对HR的调节及机制尚不明确,同时,运动在降低体重过程中,是否会对HR产生影响,也未见报道。因此,本研究通过建立肥胖及运动模型,尝试揭示在运动及肥胖干预下,大鼠植物神经对安静HR调节功能的影响及机制,为运动风险评估提供敏感的心血管监控指标。
2 研究对象与方法
2.1 研究对象
4周龄雄性SD大鼠90只,体重42.5±3.82 g,购自武汉大学动物中心。随机分为2组:普食组(C组)12只,体重42.67±5.85 g,标准干燥底料喂养;高脂高糖饮食组78只,体重42.48±3.61 g,所有大鼠均为自然光照,自由饮食,动物房温度18℃~23℃,湿度40%~60%。饲养8周后,按照肥胖组大鼠体重≥普食组大鼠1.4个标准差(SD)为标准,挑选出肥胖组大鼠(F组,n=36,326.17±19.48 g),随机分为3组:肥胖对照组(FC组)、肥胖中等强度运动组(FM组)和肥胖大强度运动组(FH组),肥胖组继续高脂高糖饮食,FM与FH组分别进行中等强度和大强度运动训练,运动干预前,FC组、FM组和FH组之间体重没有显著差异。

表1 本研究8周高脂高糖饮食饲养后分组体重一览表Table 1 Weight of Rats after 8 weeks
注:* 表示F组与C组间显著性差异,P<0.05。
2.2 运动方案
2.2.1 最大运动速度测试
肥胖大鼠适应性运动1周后,进行最大运动速度测试。首先以15 m/min速度进行5 min热身运动,随后每2 min跑速增加3 m/min,当速度增至36 m/min时,跑台速度改为每1 min增加1 m/min。当大鼠跟不上跑台速度且步态变化[8],即认为已达最大运动速度。最大运动速度测试3次,每次间隔24 h,取最大值。由最大速度确定每只大鼠30%~40%、50%~60%、65%~70%、85%~90%运动强度。
2.2.2 训练方案
大强度和中等强度运动组大鼠运动1次/天,5 d/wk,每周运动时间相同,第1周时间为32 min,以8 min/wk逐渐增至64 min后,以64 min/d运动4周,大强度运动组大鼠运动时间仅计算85%~90%最大运动速度强度的时间[19,34],确保两组运动时间一致(表2)。FC组大鼠仅进行适度的运动习服,保证运动能力。
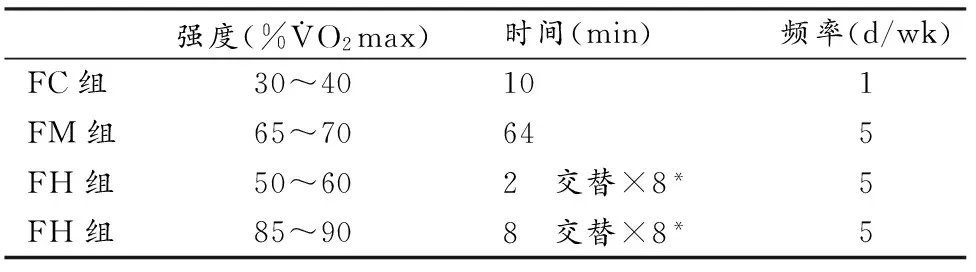
表2 本研究大鼠训练方案一览表Table 2 Arragement of Training(n=12)
注:*以2 min和8 min不同强度运动交替进行。
2.3 主要仪器与试剂
主要仪器:智能无创血压计(日本Softron BP-2010A型鼠仪)、酶标仪(美国DIOTEK ELx808型)、PCR仪(德国Eppendorf Mastercycler○Rgradient);蛋白核酸测定仪(德国Eppendorf Biophotometer);荧光定量PCR系统(德国EppendorfMastercyclerep realplex2)。
主要试剂:硫酸阿托品(湖北制药有限公司)、盐酸普萘洛尔(湖北华中药业有限公司)、M2受体试剂盒(中国武汉USCNL-IFEE1213Ra)、RGS6试剂盒(中国武汉USCNLIFEE93706Ra)、Kir3.4试剂盒(中国武汉USC NLIFEE84277Ra)、RevertAidTMFirst Strand cDNA Synthesis试剂盒(美国Thermo)、iQSYBR Green Supermix绿色荧光定量PCR试剂盒(美国伯乐)。
2.4 大鼠安静HR检测
于高脂饲养第8周末进行各组大鼠安静HR、血压测试,并在高脂饲养第18周,最后一次运动后24 h,进行各组大鼠安静HR、血压及神经功能阻断后安静HR测试。安静状态下,测试连续5 min HR,其平均值即为HR;腹腔注射迷走神经阻断剂硫酸阿托品3 mg/kg后15 min开始测试连续5 min大鼠HR,其平均值即为HR阿;次日晨,腹腔注射交感神经阻断剂盐酸普萘洛尔4 mg/kg后15 min开始测试连续5 min大鼠HR,其平均值即为HR普[22]。ΔHR阿=HR阿-HR,用于评价安静状态下迷走神经功能;ΔHR普=HR-HR普,用于评价安静状态下交感神经功能。
2.5 心脏、血液、脂肪组织取材
第18周心率测试后,对大鼠进行禁食不禁水饲养,次日晨,以0.5 ml/100g剂量腹腔注射7%水合氯醛进行麻醉。称量大鼠体重后心脏采血,测试血液甘油三酯(TG)和低密度脂蛋白胆固醇(LDL-C)含量,游离心脏并置冰盘上以生理盐水清洗后用滤纸吸干,称量心脏重量,取大鼠右侧心房心室,-80℃冰箱冻存,用于蛋白及核酸检测。去单侧肾周和睾周脂肪,称重。
2.6 M2受体、RGS6及Kir3.4蛋白测试
取冻存右心室心房,提取总蛋白。ELISA检测右心室心房M2受体、RGS6与Kir3.4蛋白含量,严格按照试剂盒说明书进行操作。
2.7 M2受体、RGS6、Kir3.4 mRNA检测
取冻存右心室心房,液氮研磨,提取总RNA,严格按照RT-PCR试剂盒说明进行实验。引物由上海生工生物工程有限公司合成。CHRM2:上游GCAATGCCTCCGTTATGAAT,下游TCCACAGTCCTCACCCCTAC;KCNJ5:上游GTCAGCTCCTCCAGTCCTTG,下游GGACTCCACAAAGC-TTGCTC; RGS6:上游ATGTCGGCGTTTGAAGAATC,下游AAGCTTTCAGCCACTTTGGA;Actin:上游ACGGTCAGGTCATCACTATCG,下游GGCATAGAGGTCTTTACGGATG。
数据采用2-△△ CT法进行分析,通过2-△△ CT法计算目的基因在实验组组织中表达水平与在正常对照组组织中表达水平的比值。Ct值为PCR反应实时荧光强度达到预设的阈值所需要的循环数。ΔCt=(目的基因)Ct-(内参)Ct;ΔΔCt=ΔCt(实验组)-ΔCt(对照组),每一样本重复3次。
2.8 数据分析
3 实验结果
3.1 饲养8周后的HR与血压
表3显示,C组大鼠HR显著高于F组(P=0<0.05),提示在植物神经调节HR平衡过程中F组大鼠以迷走神经调节为主,两组间血压无显著差异。

表3 本研究普食及高脂高糖组大鼠安静HR和血压测量一览表Table 3 HR and Blood Pressure at 8 Weeks
注:*表示C组与F组间的显著性差异,P<0.05。
3.2 不同运动强度训练后体重、体脂及HR测试结果
如图1、图2所示,继续高脂高糖饲养10周后(含适应性运动2周和运动训练干预8周),FC组大鼠体重和脂肪含量显著大于C组2个SD和3.57个SD,且血液TG和LDL-C浓度也显著高于C组(P=0.009<0.05,P=0<0.05),说明18周的高脂高糖饮食导致大鼠肥胖的进一步发展。经过8周运动干预后,FM组和FH组大鼠不仅体重显著降低(P=0.041<0.05,P=0.001<0.05),体脂含量也显著降低(P=0.006<0.05,P=0<0.05)。
继续高脂饲养10周后,C组大鼠HR显著下降(P=0.017<0.05),而FC组大鼠HR较实验干预8周时有所上升(P=0.057>0.05),说明在肥胖的发展过程中,植物神经对安静状态下HR的调节作用逐渐由副交感神经占主导地位过渡到交感神经占主导地位。尽管C组与FC组之间的ΔHR阿和ΔHR普没有显著差异,但是存在着C组ΔHR阿大于FC组,而ΔHR普却小于FC组的现象,提示肥胖的进一步发展,导致调节HR的迷走神经及交感神经功能均发生了改变。
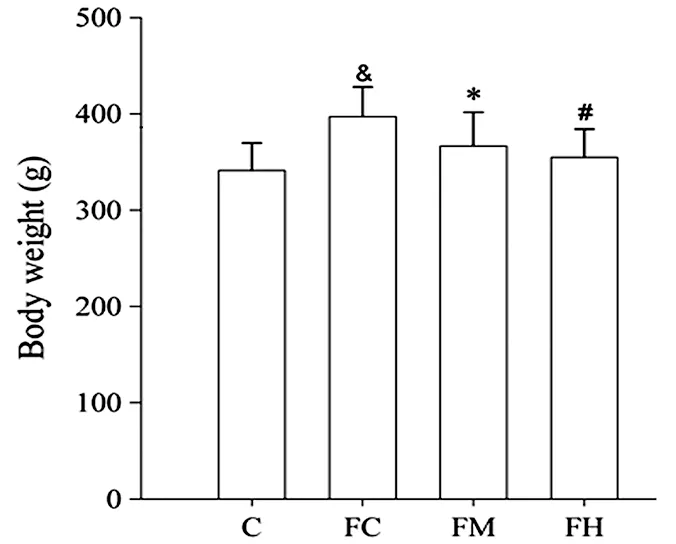
图1 本研究18周后大鼠体重(g)示意图Figure 1. Weight of Rats after 18 Weeks Experiment
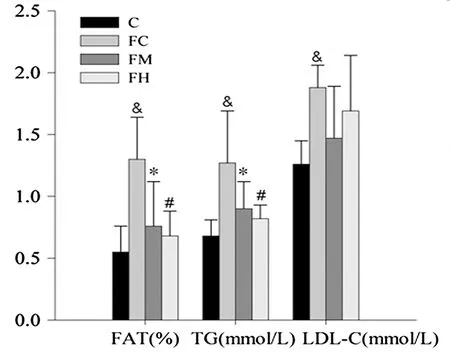
图2 本研究18周后大鼠体脂、TG和LDL-C含量示意图Figure 2. Percent of Fat by Weight and TG、LDL-C in the Blood
注:“&”表示FC 组与C 组间的显著性差异。“*”表示 FM 组与 FC 组间的显著性差异。“#”表示 FH 组与 FC 组间的显著性差异,P<0.05 为显著性差异,图2同。
表4 本研究18周后大鼠HR以及注射阻断剂后HR变化值一览表
Table 4 HR and the Change of HR after being Injected Medicine(次/min)
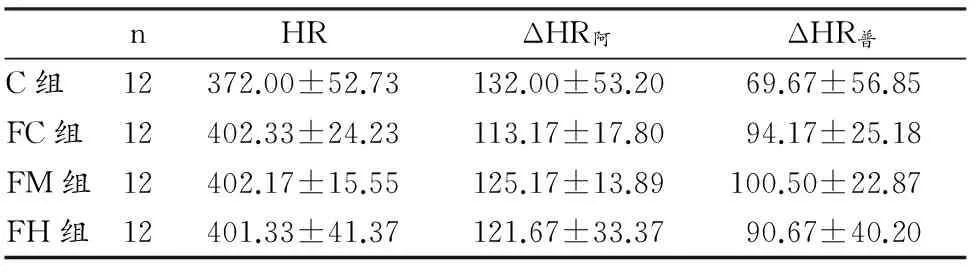
nHRΔHR阿ΔHR普C组12372.00±52.73132.00±53.2069.67±56.85FC组12402.33±24.23113.17±17.8094.17±25.18FM组12402.17±15.55125.17±13.89100.50±22.87FH组12401.33±41.37121.67±33.3790.67±40.20
运动训练后FC、FM及FH组大鼠安静HR以及ΔHR阿和ΔHR普结果之间,均没有显著差异,说明运动对肥胖大鼠安静HR以及对迷走神经和交感神经的安静HR调节作用均没有显著影响。
3.3 大鼠右心室心房M2受体、RGS6和Kir3.4含量
表5显示,18周后高脂高糖饲养的FC组大鼠和C组相比,Kir3.4的含量显著增加(P=0.011<0.05),说明高脂高糖饮食可改变Kir3.4的含量,使之上调;而对M2受体和RGS6含量均无显著影响。就肥胖大鼠而言,3组大鼠的M2受体、RGS6和Kir3.4表达均未出现显著差异,说明中等和大强度运动训练未影响M2受体、RGS6和Kir 3.4含量,即运动对肥胖大鼠迷走神经心内调节通路蛋白表达无影响。
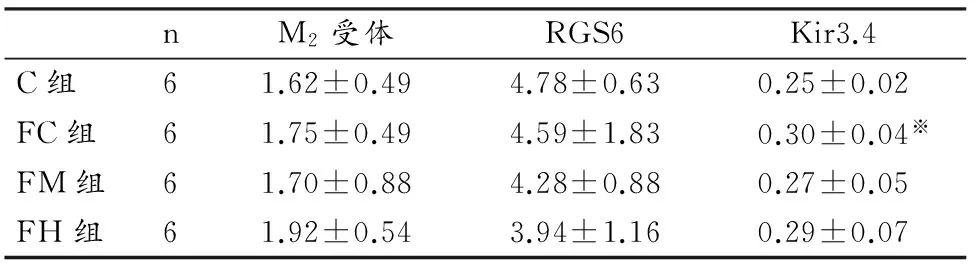
表5 本研究大鼠18周后M2受体、RGS6和Kir3.4含量一览表Table 5 Contents of M2 Receptor,RGS6 and Kir3.4(mg/ml·g)
注:※表示C组与FC组间的显著性差异,P<0.05为显著性差异。
3.4 各组大鼠右心室心房M2受体、RGS6和Kir3.4 mRNA含量
对各组大鼠右心室心房M2受体、RGS6和Kir3.4的mRNA含量检测发现(表6),FC组大鼠M2受体显著上调(P=0.04<0.05),RGS6 mRNA含量显著下降(P=0<0.05),但C组和FC组之间Kir3.4的mRNA含量没有显著性影响,说明肥胖能够通过作用于M2受体和RGS6转录水平,上调迷走神经心内调控通路。
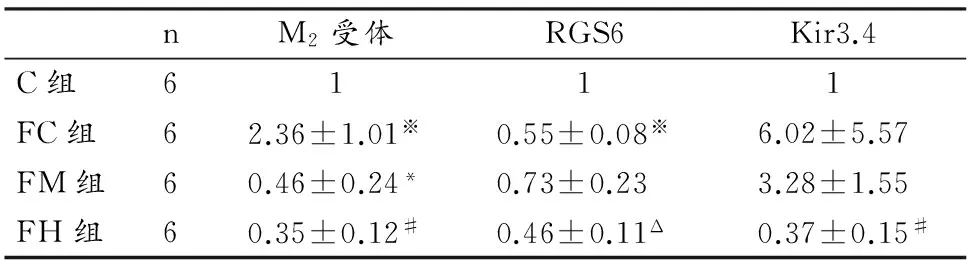
表6 本研究大鼠18周后M2受体、RGS6和Kir3.4 mRNA的相对表达量一览表Table 6 Relative Expression Quantity of M2 Receptor,RGS6 and Kir3.4 mRNA
注:※表示C组与FC组间的显著性差异,P<0.05为显著性差异;*表示FC组与FM组间的显著性差异;#表示FC组与FH组间的显著性差异;△表示FM组与FH组之间的显著性差异,P<0.05为显著性差异。
经不同运动强度训练之后,FM组(P=0<0.05)和FH组(P=0<0.05)M2受体的mRNA含量均显著降低,但组间比较并无显著性差异(P=0.729>0.05),说明运动能够抑制M2受体的转录水平,且没有强度敏感性。大强度运动训练与中等强度运动训练对RGS6的mRNA的含量作用不一致,虽然没有显著性差异,但大强度运动训练相对中等强度下调RGS6 mRNA水平(P=0.017<0.05),说明肥胖大鼠RGS6的转录效果对运动很敏感,不同的运动方式导致了不同的转录效果。FM组(P=0.219>0.05)和FH组(P=0.02<0.05)大鼠右心室心房Kir3.4的mRNA含量相对于FC组出现下降现象,说明运动训练能够降低大鼠右心室心房Kir3.4的mRNA含量,且大强度运动训练的作用更为明显。
4 讨论
4.1 肥胖对大鼠安静心率的影响
高脂饮食能够导致自主神经功能失衡,这是肥胖导致心源性疾病的一个重要方面。无论是动物还是人类,肥胖的发生,都伴随着自主神经系统功能的紊乱,但关于其损伤程度的研究结果各不相同,损伤机理尚不明确,然而,较低水平的副交感神经系统功能提示较低水平的心率变异性,是心源性猝死的风险因子[4],是心梗后死亡率的有效评价指标[20]。Levin认为,高脂高糖饮食诱导肥胖的大鼠比肥胖抵抗大鼠的大脑交感神经系统对糖代谢活性高[21]。Barella等分别对断乳大鼠以及8周大鼠进行60天高脂饮食饲养[5],并第一次记录了高脂饮食饲养的大鼠迷走神经张力,发现虽然迷走神经张力测试的电子信号存在着一些传入和传出的干扰,但仍旧显示出高脂饮食大鼠具有较高的迷走神经张力。Scomparin等研究也认为,MSG肥胖小鼠迷走神经具有较高的电活性[28]。Kaufman分析肥胖儿童心率变异性结果显示的副交感神经系统功能降低[18],而交感神经功能增强。Zahorska等也认为,肥胖伴随着交感神经功能的增强和副交感神经功能的降低[38]。Yakinci等研究显示,肥胖儿童虽然交感神经系统功能正常[35],但其副交感神经系统功能存在减弱的可能。本研究对肥胖发生到发展两个阶段研究了植物神经对大鼠安静HR的调节情况,高脂高糖饮食饲养8周后,大鼠肥胖建模完成,肥胖大鼠安静状态下心率显著低于对照组,提示高脂高糖饲养导致大鼠迷走神经功能增强和/或交感神经功能减弱,即相对于对照组大鼠而言,肥胖大鼠植物神经HR调节平衡,主要以迷走神经功能为主;继续高脂高糖饲养大鼠至18周,虽然两组大鼠心率没有显著差异,但是肥胖组大鼠心率呈现大于对照组的现象,逆转了8周时对照组大鼠安静心率显著高于肥胖组的情况,说明相对于对照组大鼠而言,随后继续的10周高糖高脂饮食,导致肥胖大鼠植物神经HR调节功能以交感神经调节作用为主,并且,对大鼠分别注射阿托品及普萘洛尔阻断迷走神经和交感神经后,虽然两组间HR的变化没有显著差异,但却有迷走神经HR调节功能降低和交感神经HR调节功能增强的现象,提示肥胖导致的植物神经HR调节平衡的改变可能是迷走神经和交感神经共同改变的结果。此外,对照组8周时的HR显著大于18周,而肥胖组相反,进一步说明肥胖发展过程中,存在着植物神经HR调节功能的变化,并且肥胖发生时为迷走神经HR调节功能占优势,之后,转变为交感神经HR调节功能占优势。本研究与其他研究结论间存在的不一致情况,可能是由于选取肥胖大鼠的肥胖程度不同导致的。
4.2 运动对肥胖大鼠安静心率的影响

4.3 肥胖及运动对肥胖大鼠心内迷走神经传导通路的影响
心脏功能受交感神经和迷走神经共同调节,迷走神经通过神经末梢释放的神经递质乙酰胆碱(acetyl choline,Ach),与心肌细胞表面的M2受体结合,使心率减慢,产生负性肌力;此外,迷走神经还能通过交感神经纤维上的乙酰胆碱受体进一步发挥降低心室收缩的能力[17],在β-肾上腺素作用下,乙酰胆碱对心室及蒲肯叶氏纤维的抑制作用表现的尤为突出[10]。M2受体广泛分布于心脏各腔室,心房M2受体表达约为心室M2受体表达的3倍,但是左右心房以及左右心室相差无几[16]。DNA序列在CHRM2转录区的不同[15],决定了运动后早期恢复阶段的心脏植物神经功能以及急性心梗的死亡风险。研究不同运动强度与心肌细胞M2受体表达的关系,对运动与心脏的理论和实践研究具有重要意义[2]。本研究表明,长期高脂高糖饮食以及不同运动方式并未导致大鼠心脏M2受体含量的改变,这可能是肥胖大鼠未对外表现迷走神经心率调节功能差异的原因之一。测试大鼠心脏M2受体mRNA含量情况,发现高糖高脂饮食使大鼠M2受体mRNA含量显著增加,而运动能够显著性降低高糖高脂饮食大鼠M2受体mRNA的含量,运动导致的mRNA表达的不同,跟运动强度无关,说明M2受体mRNA对高脂高糖饮食和运动较为敏感,在两者干预作用下,mRNA比蛋白变化显著,而M2受体蛋白是功能单位,因此,心脏内调节M2受体蛋白翻译过程中可能存在一种反馈机制,即当M2受体mRNA含量在遭受外在刺激而发生变化时,M2受体蛋白翻译反馈机制发挥作用,抑制M2受体蛋白随M2受体mRNA含量变化而变化,如:改变M2受体蛋白的翻译效率或者改变M2受体蛋白的降解速度等。
心脏K+通道决定了细胞膜的静息电位、心率,动作电位的形状及时间,并且是神经递质、激素、药物以及毒素作用于心脏,影响心脏功能的靶位点。IK,ACh为配体门控类K+通道[32],是迷走神经作用于M2受体后的下级通路。目前研究表明,M2受体调节的G蛋白偶联钾离子通道(IK,ACh)是预测房颤风险的关键因素[30]。Ach依赖的钾离子通道是Kir3.1和Kir3.4构成的异四聚体[9]。Ach与M2受体结合之后,PYX敏感的G蛋白Gβγ亚单位结合IK,ACh通道细胞质的N-及C-末端,激活乙酰胆碱依赖的IK,Ach[36]。激活的IK,ACh通道使细胞膜发生超极化,从而降低窦房结和房室结节律细胞激活频率,延迟房室传导速度,这也是迷走神经或静脉腺苷能够终止房室反折引起的心动过速性的原因[32]。虽然高脂高糖饮食组大鼠Kir3.4相对于普食组发生了显著增高(P=0.011<0.05),理论上高脂高糖饮食将增强迷走神经的心率调节作用,但是心率测试结果迷走神经心率调节功能相对下降,因此,说明高脂高糖饮食上调Kir3.4的作用,在迷走神经心率调节作用中,并不发挥主导作用。各组肥胖大鼠Kir3.4的含量没有显著差异,说明运动干预未能够影响Kir3.4,而大强度运动组Kir3.4 mRNA含量显著降低(P=0.02<0.05),提示大强度运动训练能够显著降低于Kir3.4的转录水平。
RGS是一类多功能信号调节因子,能够通过蛋白磷酸化、蛋白质棕榈化作用以及蛋白质与肽链间相互作用,调节心血管系统生理功能,改变RGS蛋白水平,将会影响心血管功能表型[27]。RGS蛋白在M2受体激活引起的心动过缓中发挥着重要作用,能够抵消G蛋白引起的M2受体调节的IK,ACh加强的作用,从而降低迷走神经抑制心率的效果。通过对RGS6-/-小鼠研究IK,ACh表明,RGS6/Gβ5调节着M2受体-IK,Ach信号[26]。RGS6是GIRK调节的IK,ACh失活和脱敏的必须蛋白,RGS6的缺失能够导致GIRK通道严重活性亢奋,从而说明其他RGS蛋白不能够代偿RGS6的功能或者具有与RGS6类似的功能[37]。事实上,RGS6缺陷的心房细胞G蛋白偶联钾离子内向整流缺乏脱敏及失活功能,对胆碱类刺激表现出严重的心动过缓。RGS6在心脏的迷走神经调节过程中发挥着重要作用,其表达随着运动后心率的恢复而出现表达赤字[33]。运动过程中,交感神经系统被激活伴随着副交感神经系统功能抑制,当运动终止,快速再次激活,降低心率[6];乙酰胆碱受体阻断功能在运动后心率恢复阶段降低[7]。RGS6作为迷走神经张力调节因子,在运动后心率恢复过程中缺失能够有效的增强心率的恢复。也有研究认为RGS6是肥胖候选基因,其表达能够增加高脂及高糖饮食的摄入[29]。本研究发现,高脂高糖饮食不影响RGS6蛋白表达,但能够抑制其转录水平;而不同的运动训练能够导致RGS6的mRNA含量发生不同的变化,从而导致中等强度运动训练组RGS6mRNA显著高于大强度运动训练组,但是,与对照组间没有显著性差异,说明运动能够导致高脂高糖饲养大鼠RGS6 mRNA的变化,RGS6转录具有运动强度敏感性,中等运动强度训练相较于大强度运动训练,具有上调其转录水平的作用。
尽管高脂高糖饮食以及运动对大鼠的迷走神经心率调节心内通路的各种蛋白及mRNA含量有着或多或少的影响,但是,未导致植物神经功能发生变化,因此,无论是高脂高糖饮食还是运动,对肥胖大鼠迷走神经心率调节的心内通路影响不明显;且主要发生在心内迷走神经传导通路及调节蛋白的转录水平。
5 结论
1.高脂高糖饮食诱导的肥胖发生发展过程中,大鼠植物神经心率调节功能由迷走神经功能占主导地位,逐渐转变为交感神经功能占主导地位;
2.8周运动训练对肥胖大鼠植物神经心率调节功能没有影响,但能够影响迷走神经心内调节关键因子的转录水平。
[1]曹悦鞍,彭朝胜,王玮,等.肥胖患者静息心率增加与隐性高血压的关系[J].海军总医院学报,2009,22(4):206-208.
[2]田振军,杜蕾.M2受体的细胞表征及运动与心脏、血管M2受体研究进展[J].体育科学,2009,29(11):65-71.
[3]杨秋萍,张溪,韩睿,等.肥胖程度对心率变异性的影响[J].中国临床康复,2006,48(10):25-27.
[4]AMANO M,KANDA T,UE H,etal.Exercise training and autonomic nervous system activity in obese individuals[J].Med Sci Sports Exe,2001,33(8):1287-1291.
[5]BARELLA L F,DE OLIVEIRA J C,BRANCO R C,etal.Early exposure to a high-fat diet has more drastic consequences on metabolism compared with exposure during adulthood in rats[J].Horm Metab Res,2012,44(6):458-464.
[6]CHAPLEAU M W,SABHARWAL R.Methods of assessing vagus nerve activity and reflexes[J].Heart Fail Rev,2011,16(2):109-127.
[7]COOTE J H,BOTHAMS V F.Cardiac vagal control before,during and after exercise[J].Exp Phys,2001,86(6):811-815.
[8]COPP S W,DAVIS RT,POOLE D C,etal.Reproducibility of endurance capacity and VO2peak in male Sprague-Dawleyrats[J].J Appl Phys,2009,106(4):1072-1078.
[9]DOBRZYNSKI H,MARPLES D D,MUSA H,etal.Distribution of the muscarinic K+channel proteins Kir3.1 and Kir3.4 in the ventricle,atrium,and sinoatrial node of heart[J].J HistochemCytochem,2001,49(10):1221-1234.
[10]DONG L W,TANG C,LIU M S.Biphasic redistribution of muscarinic receptor and the altered receptor phosphorylation and gene transcription are underlying mechanisms in the rat heart during sepsis[J].Cardiovasc Res,2000,45(4):925-933.
[11]FIGUEROA A,BAYNARD T,FERNHALL B,etal.Endurance training improves post-exercise cardiac autonomic modulation in obese women with and without type 2 diabetes[J].Eur J Appl Phys,2007,100(4):437-444.
[12]GAMELIN F X,BAQUET G,BERTHOIN S,etal.Effect of high intensity intermittent training on heart rate variability in prepubescent children[J].Eur J Appl Phys,2009,105(5):731-738.
[13]GUTIN B,BARBEAU P,LITAKER M S,etal.Heart rate variability in obese children:Relations to total body and visceral adiposity,and changes with physical training and detraining[J].Obes Res,2000,8(1):12-19.
[14]GUTIN B,OWENS S,SLAVENS G,etal.Effect of physical training on heart-period variability in obese children[J].J Pediatr,1997,130(6):938-943.
[15]HAUTALA A J,TULPPO M P,KIVINIEMI A M,etal.Acetylcholine receptor M2gene variants,heart rate recovery,and risk of cardiac death after an acute myocardial infarction[J].Ann Med,2009,41(3):197-207.
[16]HOOVER D B,BAISDEN R H,XI-MOY S X.Localization of muscarinic receptor mRNAs in rat heart and intrinsic cardiac ganglia by in situ hybridization[J].Circ Res,1994,75(5):813-820.
[17]HOOVER D B,NEELY D A.Differentiation of muscarinic receptors mediating negative chronotropic and vasoconstrictor responses to acetylcholine in isolated rat hearts[J].J Pharmacol Exp Ther,1997,282(3):1337-1344.
[18]KAUFMAN C L,KAISER D R,SREINBERGER J,etal.Relationships of cardiac autonomic function with metabolic abnormalities in childhood obesity[J].Obesity (Silver Spring),2007,15(5):1164-1171.
[19]KEMI O J,HARAM P M,LOENNECHEN J P,etal.Moderate vs.high exercise intensity:Differential effects on aerobic fitness,cardiomyocyte contractility,and endothelial function[J].Cardiovasc Res,2005,67(1):161-172.
[20]KIM J A,PARK Y G,CHO K H,etal.Heart rate variability and obesity indices:Emphasis on the response to noise and standing[J].J Am Board Fam Pract,2005,18(2):97-103.
[21]LEVINBE.Sympathetic activity,age,sucrose preference,and diet-induced obesity[J].Obes Res,1993,1(4):281-287.
[22]MIZUNO M,KAWAD A T,KAMIYA A,etal.Exercise training augments the dynamic heart rate response to vagal but not sympathetic stimulation in rats[J].Am J Physiol Regul Integr Comp Phys,2011,300(4):969-977.
[23]NAGAI N,HAMADA T,KIMURA T,etal.Moderate physical exercise increases cardiac autonomic nervous system activity in children with low heart rate variability[J].Childs Nerv Syst,2004,20(4):209-214.
[24]NAGAI N,MORITANI T.Effect of physical activity on autonomic nervous system function in lean and obese children[J].Int J Obes Relat Metab Disord,2004,28(1):27-33.
[25]NAGAI N,MATSUMOTO T,KITA H,etal.Automomic nervous system activity and the state and development of obesity in Japanese school children[J].Obes Res,2003,11(1):25-32.
[26]POSOKHOVA E,WYDEVEN N,ALLEN K L,etal.RGS6/Gβ5 complex accelerates IKACh gating kinetics in atrial myocytes and modulates parasympathetic regulation of heart rate[J].Circ Res,2010,107(11):1350-1354.
[27]RIDDLE E L,SCHWARTZMAN R A,BOND M,etal.Multi-tasking RGS proteins in the heart:The next therapeutic target?[J].Circ Res,2005,96(4):401-411.
[28]SCOMPARIN D X,GOMES R M,GRASSIOLLI S,etal.Autonomic activity and glycemic homeostasis are maintained by precocious and low intensity training exercises in MSG-programmed obese mice[J].Endocrine,2009,36(3):510-517.
[29]SIBBEL S P,TALBERT M E,BOWDEN D W,etal.RGS6 variants are associated with dietary fat intake in Hispanics:the IRAS Family Study[J].Obesity (Silver Spring),2011,19(7):1433-1438.
[30]STEWART A,HUANG J,FISHER R A.RGS proteins in heart:Brakes on the vagus[J].Front Physiol,2012,3:95.
[31]STUTZMAN S S,BROWN C A,HAINS S M,etal.The effects of exercise conditioning in normal and overweight pregnant women on blood pressure and heart rate variability[J].Biol Res Nurs,2010,12(2):137-148.
[32]TAMARGO J,CABALLERO R,GOMEZ R,etal.Pharmacology of cardiac potassium channels[J].Cardiovasc Res,2004,62(1):9-33.
[33]VASAN R S,LARSON M G,ARAGAM J,etal.Genome-wide association of echocardiographic dimensions,brachial artery endothelial function and treadmill exercise responses in the Framingham Heart Study[J].BMC Med Genet,2007,8 Suppl 1:S2.
[34]WISLOFF U,HELGERUD J,KEMI O J,etal.Intensity-controlled treadmill running in rats:VO2max and cardiac hypertrophy[J].Am J Phys Heart Circ Phys,2001,280(3):1301-1310.
[35]YAKINCI C,MUNGEN B,KARABIBER H,etal.Autonomic nervous system functions in obese children[J].Brain Dev,2000,22(3):151-153.
[36]YAMANUSHI T T,SHUI Z,LEACH R N,etal.Role of internalization of M2muscarinic receptor via clathrin-coated vesicles in desensitization of the muscarinic K+current in heart[J].Am J Phys Heart Circ Phys,2007,292(4):1737-1746.
[37]YANG J,HUANG J,MAITY B,etal.RGS6,a modulator of parasympathetic activation in heart[J].Circ Res,2010,107(11):1345-1349.
[38]ZAHORSKA-MARIEWICZ B,KUAGOWSKA E,KUCIO C,etal.Heart rate variability in obesity[J].Int J Obes Relat Metab Disord,1993,17(1):21-23.
Study on the Regulatory Mechanism of Automatic Nerve on the Rest Heart Rate in Treadmill Exercise and Obese Rats
YANG Yue-qin1,2,ZHAO Yan2,XIE Min-hao2,XIA Zhi3,4
Objective:This study seted up a treadmill exercise obese rats modal by being fed with high fat and sugar food and following the fitness test.The aim was going to find the effects of exercise and obesity on the rest heart rate (HR) regulation of the automatic nerve in rats.It is going to find a sensitive index for evaluating the risk of cardiovascular disease.Methods:Four weeks old male rats were divided into two groups randomly:Control group (C Group) was fed with control food;the left rats were fed with high fat and sugar food.After 8 weeks,the obese rats were separated from the rats with high fat and sugar food as F Group and subdivided into three groups:FC Group rats did no exercise;FM Group rats did Mid-intensity exercise;and FH Groups did High-intensity exercise.The obese rats did 2 weeks adaptive running and then were trained for other 8 weeks.HR and the change of HR after blocking the automatic nerve were tested respectively.Elisa and RT-PCR were used to test the concentration of M2receptor,RGS6 and Kir3.4.Results:1)After 8 weeks,HR of F group was significantly lower than the rats in C Group(P<0.05).2)HR of C Group at 18 weeks was significantly lower than at 8 weeks (P<0.05),but it did not happen in FC Group.And there was no significant difference in HR at 18 weeks between C Group and FC Group.3)The change of HR was not significant different between C group and FC Group and among the obese groups.4)Kir3.4 in FC Group was significant more than in C Group(P<0.05).5)M2receptor mRNA in FC Group was less than in C Group,but RGS6 mRNA in FC Group was more than in C Group.6)M2receptor mRNA in both FM Group and FH Group was less than in FC Group.Conclusion:During the development of the obese,the main effect of automatic nerve on the rest heart rate regulation changed from vagal nerve to sympathetic nerve.8 weeks exercise had no effect on the rest heart rate regulation of automatic nerve.
exercise;automaticnerve;restheartrate;obesity;rat
1000-677X(2015)03-0044-07
2014-05-22;
2015-02-11
教育部科学技术研究重大项目(311038)。
杨月琴(1982-),女,湖北当阳人,实验员,博士,主要研究方向为运动生物化学,E-mail:yangyueqin226@163.com。
1.武汉体育学院 运动干预与健康促进湖北省协同创新中心,湖北 武汉 430079;2.北京体育大学 运动人体科学学院,北京 10084;3.井冈山大学 体育学院,江西 吉安 343009;4.三峡大学 体育学院,湖北 宜昌 443002 1.Wuhan Sports University,Wuhan 430079,China;2.Beijing Sport University,Beijing 100084,China;3.Jinggangshan Universtiy,Ji’an 343009,China;4.China Three Gorges University,Yichang 443002,China.
G804.2
A
