南药植物高良姜内生细菌多样性及其促生潜力
2015-02-08李淑彬周仁超李泽恩徐诗如庞启华
李淑彬, 黄 娟, 周仁超, 李泽恩, 徐诗如, 阮 婷, 庞启华
华南师范大学生命科学学院, 广州 510631
南药植物高良姜内生细菌多样性及其促生潜力
李淑彬*, 黄 娟, 周仁超, 李泽恩, 徐诗如, 阮 婷, 庞启华
华南师范大学生命科学学院, 广州 510631
以道地产地高良姜为材料,对该药用植物内生细菌种群组成、组织分布及其促生潜力进行了研究。采用组织块分离法,从高良姜根、根茎、茎和叶4个组织共计分离得到细菌136株,分属于16个16S rDNA基因型、12个细菌属、15个细菌种,其中,芽孢杆菌、甲基杆菌分别为其最、次优势种群。各种群分离比随组织不同而异;采用HhaI 消化的末端限制性片段多态性(T-RFLP) 免培养方法,从高良姜4个组织共计检测到36个不同的末端限制性酶切片段(T-RFs)。种群对应分析表明其免培养内生细菌群体主要包括芽孢杆菌、甲基杆菌等高抗性细菌,海洋螺菌、红杆菌、交替假单胞菌等海洋细菌及热带根瘤菌、沼泽考克氏菌等热带相关细菌,说明高良姜内生细菌群体与其宿主植物生长环境密切相关。不同组织其总T-RFs数目、优势T-RFs及其对应细菌种群明显不同;在所分离的细菌菌株中,36.36%、51.52%、54.55%和27.27%的菌株分别显示了胞外几丁质酶、β-葡聚糖酶,生长素及其1-氨基环丙烷- 1-羧酸(ACC)脱氨酶产生能力。其中,泛菌L- 2、芽孢杆菌S- 16所测4个指标均为阳性,热带根瘤菌菌株R- 1和 R- 3显示了较高的ACC脱氨酶及生长素产生能力,这些菌株是促生菌剂的良好候选。
道地高良姜; 内生细菌; 分离培养; T-RFLP; 植物促生作用
植物内生细菌(Endophytic bacteria)存在于植物内部,其种群组成与其宿主植物种及其基因型、组织类型、发育阶段、及植株生长环境密切相关[1- 6]。大量研究显示内生细菌可通过固氮作用、分泌生长素、产生1-氨基环丙烷- 1-羧酸脱氨酶、铁载体、抗生素等多种方式促进植物生长、提高其对生物及非生物境胁迫的抗性[1- 8]。研究植物内生细菌多样性及功能活性,对阐明植物-内生细菌相互作用、有效利用内生细菌资源具有重要意义。
高良姜(AlpiniaofficinarumHance),别名小良姜,又名徐闻良姜,是著名南药植物之一[9]。高良姜提取物具有抗菌、抗氧化、抗病毒、抗癌、保护心脑血管等活性[9- 13],已广泛用于食品和药品添加剂的制备。高良姜在热带、亚热带均有分布,其中,以广东省湛江市徐闻县龙塘镇所产高良姜质量最优,为道地高良姜[9]。高良姜含有多种活性组分,其道地产地位于我国最南端高温高湿、强辐射、低pH值的海岸环境,在这样的环境其内生菌多样性特征可能不同于内陆植物。然而,有关高良姜内生菌的研究国内外尚未报道。本论文以道地产地高良姜为材料,采用分离培养方法、及基于末端限制性片段长度多态性分析(terminal-restriction fragment length polymorphism, T-RFLP)的免培养方法对其内生细菌多样性、组织分布及其抗逆促生潜力进行了研究,以期了解该药用植物内生细菌种群结构和生态分布特点,为分析内生菌群体在其道地性形成中的作用、及内生细菌资源的开发利用提供参考。
1 材料与方法
1.1 植物材料
实验所用高良姜均采自道地高良姜产地广东省徐闻县龙塘镇。整株挖取健壮、无病虫害、约4年生植株,用灭菌物品袋包裹带回实验室后立即进行内生菌分离及组织DNA提取。
1.2 主要试剂和培养基
1-氨基环丙烷- 1-羧酸(1-aminocyclopropane- 1-carboxylic acid, ACC)、β-葡聚糖、几丁质购自Sigma公司;限制性内切酶HhaI、MspI, Premix Taq、pMD18-T购于Takara公司;Dzup(植物)基因组DNA提取试剂盒、细菌基因组DNA提取试剂盒、DNA纯化试剂盒购于上海生工生物科技有限公司;营养琼脂(nutrient agar, NA)、Luria-Bertani 培养基(LB)、胰蛋白胨培养基购自广东环凯微生物科技有限公司;胶态几丁质培养基参照文献[14]、刚果红-葡聚糖培养基参照文献[15]、无氮培养基和补充培养基(supplemental medium, SM)参照文献[16]配制。SMA 培养基: 向SM 培养基中添加过滤除菌的ACC,使其终浓度为3 mmol /L[7]。
1.3 内生细菌的分离纯化
用流水冲洗高良姜根、根茎、茎和叶样品,吸干水分。根茎、根用无菌小刀刮去表皮,切成长、宽、厚各约2 mm小块。剥去表层的茎、及叶切成长、宽各约2 mm小段。按照以下步骤对上述样品进行表面消毒:75%酒精浸泡30 s—无菌水冲洗3次—0.1%升汞浸泡4 min—无菌水冲洗5次。取表面消毒的组织小块(60块/组织)贴于预先制备的NA平板上,30 ℃培养48 h,对出现的所有菌落进行划线纯化,经镜检后, 纯菌落转接于NA斜面保存。最后1次消毒无菌水涂布于同样的平板以检测消毒效果。
1.4 菌株16S rDNA扩增及限制性片段长度多态性(restriction fragment length polymorphism, RFLP)分析
菌株接入LB培养液中30 ℃、150 r/min 振荡培养24 h,离心 (4000 r/min) 收集菌体,用TE 洗涤3次, 用细菌基因组提取试剂盒提取基因组DNA, 方法参见试剂盒说明书。以提取的各DNA为模板,用细菌通用引物27F /1492R扩增菌株16S rDNA 序列。每25 μL PCR 反应混合物含Premix Taq 12.5 μL,正、反引物各1 μL、模板DNA 2 μL,ddH2O 8.5 μL。PCR程序为:95 ℃预变性5 min;95 ℃变性30 s,52 ℃退火45 s,72 ℃延伸90 s,30个循环;72 ℃终延伸7 min。切胶回收目标产物(—1500 bp),用DNA纯化试剂盒纯化。纯化产物分别用HhaI、MspI 于37 ℃消化3 h (酶切体系含PCR 产物2 μL, 酶1 μL, 10 × M buffer 2 μL, ddH2O 15 μL),75 ℃下水浴10 min终止消化。2%琼脂糖凝胶电泳检测消化产物,根据其电泳条带数目及相对大小进行RFLP图谱分型。对两种酶RFLP图谱进行组合,在两种图谱中DNA条带数目及其相对大小均相同的菌株定义为同一16S rDNA基因型 (rDNA type)。
1.5 菌株系统发育分析
选取各基因型中代表菌株16S rDNA 扩增产物转化到E.coliDH5-α感受态细胞,挑选阳性克隆委托深圳华大基因有限公司测序。所有有效序列用核糖体数据库的分类程序进行属级或以上种群归类;在NCBI进行Blast 同源性搜索,获得相近序列,Clustal X 多重比对后,运用MEGA 5.05 软件构建Neighbor-joining系统树,boostrap 1000次检测各分支的置信值。
1.6 免培养内生细菌群体的T-RFLP分析
取各组织表面消毒后的组织小块(10块/组织),用Dzup(植物)基因组DNA提取试剂盒提取各组织总DNA,方法参见试剂盒说明书。以组织总DNA为模板,采用正向引物5′端用6-羧基二乙酸荧光素(FAM)标记的27F/1492R引物对扩增组织16S rDNA序列,PCR反应体系和程序同1.4。回收预期产物 (—1500 bp),试剂盒纯化后用HhaI消化。酶切条件及体系同1.4。消化终止后,将管壁用锡箔纸包裹,送深圳华大基因有限公司进行T-RFLP分析。T-RFLP图谱中末端限制性片段(Terminal-Restriction Fragment, T-RF)范围在50—550 bp、荧光强度高于100 U、在平行实验图谱中重复再现的峰纳入统计分析。合并片段大小±1 bp的T-RFs。计算每一T-RF在其对应样品中的相对丰度[17],相对丰度 > 5%的T-RFs定义为该样品的优势T-RFs。按照同样方法检测分离菌株对应的T-RFs。通过网站(http://trflp.limnology.wisc.edu/index.jsp) 检索未对应的T-RFs可能代表的细菌类群。每一组织3个平行分析。
1.7 内生细菌抗逆促生潜力的测定
几丁质酶测定参照文献[14]方法。1个几丁质酶活力单位定义为: 在测定的反应条件下, 每min生成1 μmol N-乙酰葡萄糖所需要的酶量;β-葡聚糖酶测定参照文献[15]方法。1个β-葡聚糖酶活力单位定义为: 在测定的反应条件下, 每min生成1 μmol葡萄糖所需要的酶量;生长素产生潜力的测参照文献[5]方法通过与Salkowski 显色液的显色反应测定;ACC 脱氨酶测定参照文献[16]方法。1个ACC 脱氨酶酶活单位定义为:在测定的反应条件下, 每h生成1 μmol α-丁酮酸所需的酶量;上述每一样品每一测定3个重复。
1.8 免培养细菌群体多样性指数与差异分析
以T-RFLP图谱中各T-RFs相对丰度计算免培养内生细菌群体Shannon-Wiener多样性指数(H):
H=-∑(PilnPi)
式中,Pi为第i个T-RF在该组织丰度;使用SPSS 17.0软件中的邓肯氏新复极差法(Duncan′s Multiple Ranger Test) 进行差异显著性分析(P< 0.05,n=3)。
2 结果
2.1 可培养内生细菌 RFLP 分型与种群分析

图1 可培养内生细菌16S rDNA RFLP 分型检测
本研究从高良姜根、根茎、茎和叶4个组织共计240个组织块中分离获得136株能稳定传代的细菌菌株,其编号见表1。其中, 根38株, 根茎24株、茎32株, 叶42株。扩增所有菌株16S rDNA基因序列,PCR 产物 (— 1500 bp) 经HhaI、MspI 分别消化得到的酶切图谱 (图1) 组合后共获得16种不同基因型(表1)。其中,根所分离菌株分布于基因型1—7、10—12及15—16中,根茎所分离菌株分布于基因型1—7中,茎所分离菌株分布于基因型1—7、及基因型10、12、13、14、和16中,叶分离菌株其基因型最多,共计14种,除基因型15、16外其他各基因型均有分布。这些结果说明高良姜可培养内生细菌种群组成在不同组织中存在明显差异。
从各基因型中随机选取1—3个代表菌株进行16S rDNA 全序列测定,获得的正反向序列经拼接比对后大小为1345—1497 bp。序列提交至Genbank 获得的检索号显示在图2。基于核糖体数据库归类,这些序列归于芽孢杆菌属(Bacillus)、考克氏菌属(Kocuria)、类芽孢杆菌属(Paenibacillus)、短芽孢杆菌属(Brevibacillus)、根瘤菌属(Rhizobium)、假单胞菌属(Pseudomonas)、甲基杆菌属(Methylobacterium)、伯霍尔德菌属(Burkholderia)、沙雷菌属(Serratia)、柠檬酸杆菌属(Citrobacter)、泛菌属(Pantoea)、及鞘氨醇单胞菌属(Sphingomonas)等12个不同的细菌属(表1)。

表1 高良姜可培养内生细菌16S rDNA 基因型及其系统发育地位Table 1 16S rDNA types of endophytic bacteria isolated from A. officinarum Hance and their phylogenetic position
*表示测序的代表菌株; RDP: Ribosomal database project
用Neighbor-joining 法构建系统进化树,对这些序列进行进一步的属、种归类。结果显示芽孢杆菌属中的菌株分别与枯草芽孢杆菌(Bacillussubtilis)、巨大芽孢杆菌(Bacillusmegaterium)和坚硬芽孢杆菌(Bacillusfirmus)构成同一分支;其他各属菌株与沼泽考克氏菌(Kocuriapalustris)、热带根瘤菌(Rhizobiumtropici)、嗜有机甲基杆菌(Methylobacteriumorganophilum)等12个不同种的细菌显示了最近的进化距离(图2)。属级或以上水平,核糖体聚类及进化树分析结果完全一致。
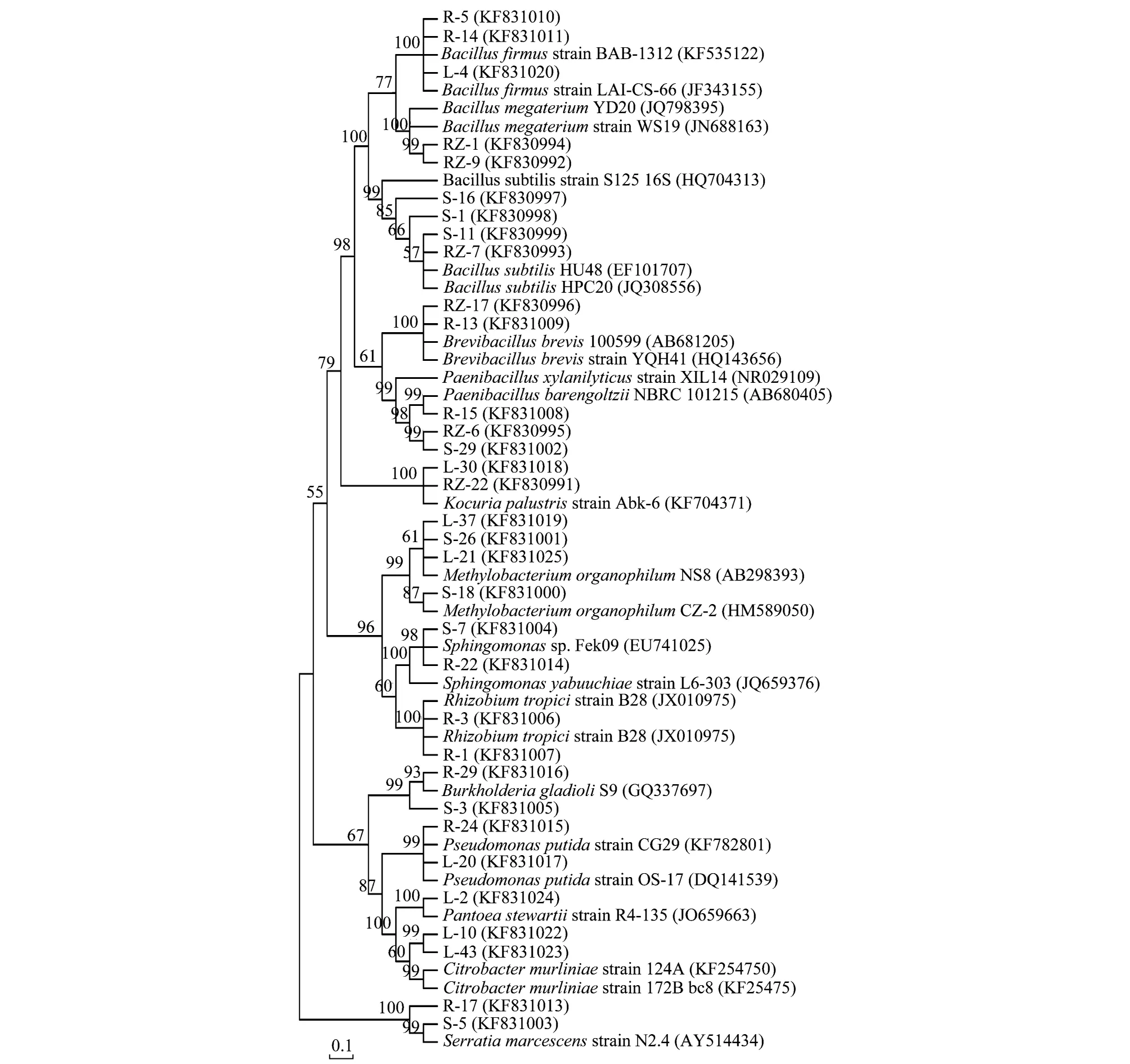
图2 高良姜内生细菌代表性菌株16s rDNA系统进化树
2.2 可培养内生细菌群体的组织差异

图3 高良姜不同组织可培养内生细菌种群组成
根据各基因型菌株分离比及对应的细菌种群,计算高良姜不同组织可培养内生细菌种群组成(属水平),结果如图3。从图3可知,从其根茎得到的菌株仅分布在芽孢杆菌属、类芽孢杆菌属、短芽孢杆菌属和考克氏菌属等4个属,以芽孢杆菌属最为优势(分离比达75%);根中分离的菌株分属于9个不同的细菌属,芽孢杆菌同样为其最优势种群(分离比23.68%),鞘氨醇单胞菌、及沙雷氏菌并列为该组织次优势种群;茎、叶中分离的菌株均以甲基杆菌最高,芽孢杆菌次之。尽管茎、叶两个组织最优势、及次优势种群相同,其他种群存在大的差异。此外,几个种群显示了一定程度的组织喜好性,如根瘤菌仅从单一组织根中分离,泛菌仅从叶中分离,假单胞菌仅从根和叶中分离,而甲基杆菌仅从两个地上组织茎和叶中分离。
2.3 免培养内生细菌群体T-RFLP分析
采用HhaI 单酶消化的T-RFLP方法分析高良姜免培养内生细菌群体,得到的T-RFLP图谱显示在图4。从其根、根茎、茎和叶四个不同组织总共检测到36个相对丰度大于1%的末端限制性酶切片段(T-RFs)。按照1个T-RFs至少代表1种细菌,高良姜免培养内生细菌群体至少组成36个不同的细菌种,说明高良姜免培养内生细菌具有丰富的多样性。
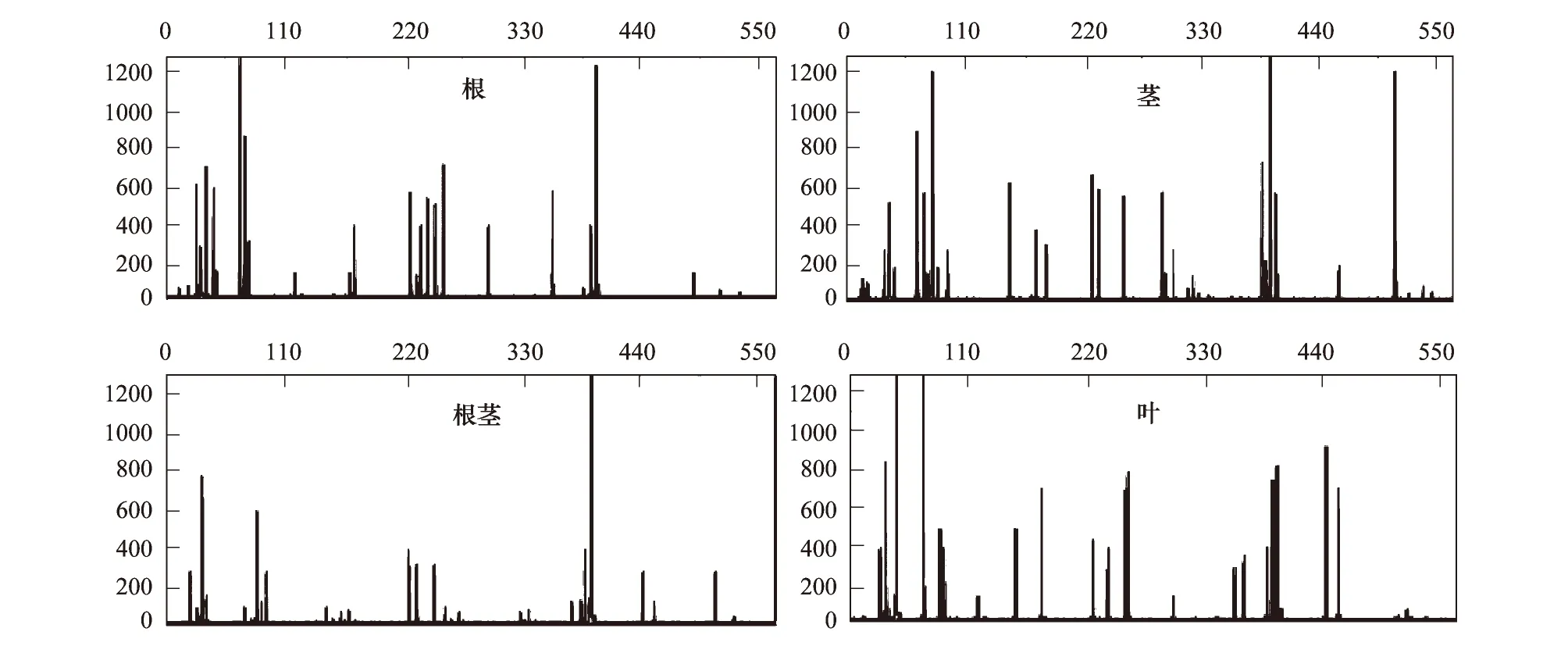
图4 高良姜不同组织内生细菌群体T-RFLP指纹图谱
对所有分离菌株的16S rDNA序列进行了T-RFLP分析,总共检测到17个HhaI消化的T-RFs,为直接组织检测到T-RFs总数的47.22%,说明高良姜内生细菌群体中有相当多的种群难以用普通的培养方法培养。通过相关数据库检索分析,19个未从分离菌株检测到的T-RFs中,14个分别对应于海洋螺菌目(Oceanospirillales)、交替假单胞菌目(Pseudomonadales)、弧菌目(Vibrionales)、红杆菌目(Rhodobacterales)及肠杆菌目(Enterobacteriales)。而另外5个T-RFs没有在相应的数据库中检索到,为未分类的T-RFs。
分析不同组织T-RFLP图谱,可知其总T-RFs数目、优势T-RFs及其对应种群随组织而异(图4, 表2)。基于各组织所检测的T-RFs及其相对丰度,计算不同组织免培养内生细菌群体Shannon-Wiener多样性指数,结果如表2,不同组织该多样性指数存在显著差异(P< 0.05),以根茎最低,叶最高,根和茎次之。
表2 高良姜不同组织免培养内生细菌群体Shannon-Wiener多样性指数和优势T-RFs及其对应种群
Table 2 Shannon-Wiener diversity index,as well as dominat T-RFs and responding taxa of culture-independence bacterial endophyte commimniuties detected from various tissues ofA.officinarumHance
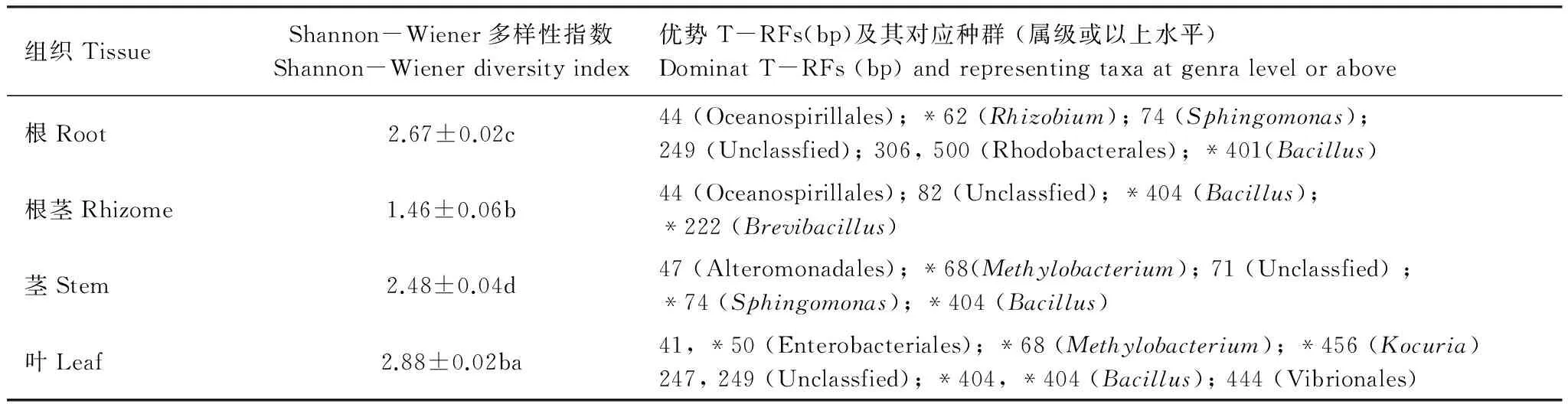
组织TissueShannon-Wiener多样性指数Shannon-Wienerdiversityindex优势T-RFs(bp)及其对应种群(属级或以上水平)DominatT-RFs(bp)andrepresentingtaxaatgenralevelorabove根Root2.67±0.02c44(Oceanospirillales);*62(Rhizobium);74(Sphingomonas);249(Unclassfied);306,500(Rhodobacterales);*401(Bacillus)根茎Rhizome1.46±0.06b44(Oceanospirillales);82(Unclassfied);*404(Bacillus);*222(Brevibacillus)茎Stem2.48±0.04d47(Alteromonadales);*68(Methylobacterium);71(Unclassfied);*74(Sphingomonas);*404(Bacillus)叶Leaf2.88±0.02ba41,*50(Enterobacteriales);*68(Methylobacterium);*456(Kocuria)247,249(Unclassfied);*404,*404(Bacillus);444(Vibrionales)
* 代表从所分离菌株中检测; 不同小写字母表示在0.05水平上差异显著(P< 0.05,n=3)
2.4 可培养内生细菌抗逆促生潜力菌株的筛选
对部分所分离的细菌菌株进行了几丁质酶、葡聚糖酶、ACC脱氨酶和生长素产生能力的测定,其结果综合如表3。在所测试的4个抗逆促生活性指标中,绝大多数菌株(29/33)至少显示了1种阳性结果。其中,12个(36.36%)菌株显示几丁质酶产生潜力,其酶产率变化在0.58—3.32 U/mL之间,以芽孢杆菌RZ- 6产率最高;17个(51.52%)菌株显示了葡聚糖酶产生能力,以芽孢杆菌S- 16产率最高,达31.3±1.22 U/mL。其他葡聚糖酶产生能力较强的菌株包括:泛菌L- 2、考克氏菌RZ- 22、甲基杆菌L- 21及芽孢杆菌RZ- 9等;分泌生长素产生筛选中,18个(54.55%)菌株显示了阳性结果,包括:甲基杆菌3株,芽孢杆菌3株,沙雷氏菌、根瘤菌、假单胞菌和泛菌各2株,伯霍尔德菌、类芽孢杆菌和柠檬酸杆菌各1株。其中假单胞菌菌株L- 20其生长素产率高达(31.58±2.35) μg/mL;33个菌株中,9个(27. 27%)菌株能在以ACC为唯一氮源培养基中生长,包括:根瘤菌2株、芽孢杆菌2株、鞘氨醇单胞菌1株、甲基杆菌2株、泛菌1株,以根瘤菌RZ- 1 ACC脱氨酶产率最高((2.67±0.27) U/mg菌体)。
表3 高良姜内生细菌几丁质酶、葡聚糖酶、ACC脱氨酶、生长素产生菌的筛选
Table 3 Screening for production of chitinase,β-glucanase, ACC deaminase, and IAA by bacterial endophytes fromA.officinarumHance
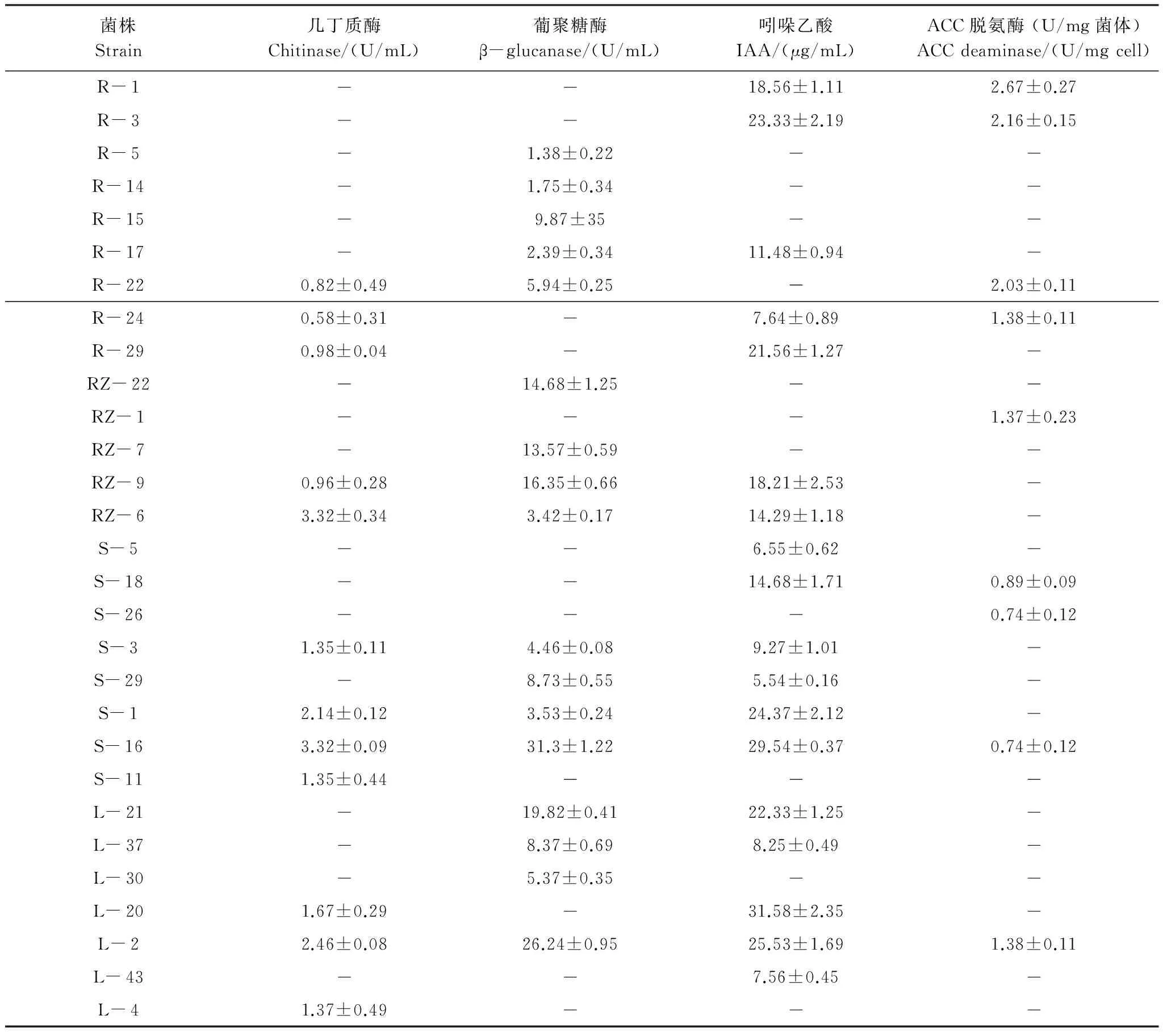
菌株Strain几丁质酶Chitinase/(U/mL)葡聚糖酶β-glucanase/(U/mL)吲哚乙酸IAA/(μg/mL)ACC脱氨酶(U/mg菌体)ACCdeaminase/(U/mgcell)R-118.56±1.112.67±0.27R-323.33±2.192.16±0.15R-51.38±0.22R-141.75±0.34R-159.87±35R-172.39±0.3411.48±0.94R-220.82±0.495.94±0.252.03±0.11R-240.58±0.317.64±0.891.38±0.11R-290.98±0.0421.56±1.27RZ-2214.68±1.25RZ-11.37±0.23RZ-713.57±0.59RZ-90.96±0.2816.35±0.6618.21±2.53RZ-63.32±0.343.42±0.1714.29±1.18S-56.55±0.62S-1814.68±1.710.89±0.09S-260.74±0.12S-31.35±0.114.46±0.089.27±1.01S-298.73±0.555.54±0.16S-12.14±0.123.53±0.2424.37±2.12S-163.32±0.0931.3±1.2229.54±0.370.74±0.12S-111.35±0.44L-2119.82±0.4122.33±1.25L-378.37±0.698.25±0.49L-305.37±0.35L-201.67±0.2931.58±2.35L-22.46±0.0826.24±0.9525.53±1.691.38±0.11L-437.56±0.45L-41.37±0.49
-: 测定为阴性结果;数据为每一测定3个重复的平均值; IAA: Indoleacetic acid; ACC: 1-aminocyclopropane- 1-carboxylic acid
3 讨论
采用分离培养方法,本研究从道地高良姜分离得到的内生细菌归于16个不同的基因型、12个不同的细菌属(表1,图1, 图2),表明高良姜可培养内生细菌群体具有丰富的种群多样性和遗传多样性。在本研究中,芽孢杆菌从所有组织中得到且具有很高的分离比, 属于该植物可培养内生细菌最优势类群,而甲基杆菌为其第二大优势类群(图3)。此外,热带根瘤菌和沼泽考克氏菌也具有较高的分离比,而一些土壤中常见的类群如假单胞菌等其分离比相对较低(图3)。高良姜可培养内生细菌群体这种种群组成特征可能与该植物含有多种具有抗菌活性的代谢产物、且该植物生长于高温高湿、低pH值、高辐射的近海岸地区有关。芽孢杆菌能形成高抗逆性芽孢,甲基杆菌能在寡营养环境中生长,且大多具有较强的抗辐射和抗渗透压力[18],该2类细菌高的抗逆能力使之能在高良姜组织定植和生存繁殖中更具竞争力。而现有文献报导的热带根瘤菌、沼泽考克氏菌主要分离自热带植物、热带土壤及海底沉积物中,该两个种群具有良好的低pH、高温抗性,及多种化学污染物抗性[19,20]。
分离培养是获得生物活性菌株的基础。然而,由于大量细菌具有不可培养性及分离培养具有强烈的选择性,使培养得到的内生菌不能完全反应自然状态下内生菌群落的真实情况。T-RFLP技术综合运用PCR技术、限制性酶切技术、荧光标记技术和DNA序列自动分析技术,不仅可定性评估群体中微生物种群数量,而且可定量反映样品中的各类群丰度,在国内外已广泛应用于研究多种生境包括土壤、水域及其沉积物,动、植物体表及内部组织微生物群体多样性及其动态变化[17,21- 24]。本研究采用T-RFLP技术进一步分析了高良姜免培养内生细菌群体的多样性及其组织分布,结果显示与海洋螺菌、红杆菌、交替假单胞菌等海洋细菌及热带根瘤菌、沼泽考克氏菌等相关的的T-RFs在高良姜多个组织中检出,且具高的相对丰度(表2,图4),这个结果进一步说明该宿主植物生长环境是影响其内生菌种群组成的重要因素。比较培养方法与免培养方法所得结果,发现较之可培养细菌群体,其免培养群体种群多样性更为丰富(表2),且免培养检测到的细菌群体中有近50%的种群没有被分离到。为了更全面了解可培养内生细菌的种群多样性,有必要对培养基及培养条件进行更为细致的研究。此外,本研究也发现5个T-RFs既没有在所分离菌株中检测到,也没有在相关数据库中检索到,这5个T-RFs所对应的序列有如下两个可能: 1)未培养的内生细菌16S rDNA序列。由于目前已登录T-RFLP数据库的细菌T-RFs非常有限,所以未能查到其对应的细菌种群;2)植物叶绿体或线粒体的rDNA序列。植物叶绿体16S rDNA 和线粒体18S rDNA序列同细菌16S rDNA 高度同源,用细菌16S rDNA通用引物也可能导致植物组织中叶绿体或线粒体rDNA序列的扩增。由于目前尚无对应于植物叶绿体或线粒体rDNA序列的T-RFLP数据,目前所检测到的5个未分类T-RFs是否来源于植物细胞器,有待进一步研究。
分离培养方法及T-RFLP方法结果均显示高良姜内生细菌群体具有明显的组织差异(图3,表2),这可能与该药用植物活性代谢产物在不同组织中的累积差异有关。在相关研究中,测定了道地高良姜4个不同组织3种指标性成分总挥发油、1,8-桉油精以及高良姜素的含量,结果显示, 4个不同组织中3种指标性成分含量存在较大差异(详情另见文报道)。研究已经显示这些成分均具有广谱的抗菌活性[9- 12]。群体中不同细菌种群对这些物质的耐(抗)性可能不同,因而在该植物不同组织的生存和生长能力不同。对植物内生菌的研究发现一些细菌种群在某些植物中具有一定的组织专一性或喜好性。如具有重要促生作用的内生性泛菌在水稻中主要在叶和种子中分离[6],内生性的甲基杆菌主要从植物茎和叶分离[6,8]。这些特定种群对植物组织偏好型机理目前尚未有深入的研究和认识。本研究中同样发现某些种群在高良姜植株内具有一定程度的偏好性,如泛菌仅在其叶片中分离,而甲基杆菌也仅在两个地上组织中分离。未培养群体中,对应于红杆菌的T-RFs在根中具有较高的丰度,而在其他组织丰度很低甚至没有检出,这个结果提示植物内化学环境的组织差异可能是内生细菌组织偏好型的一个可能因素。从另一角度,内生细菌生长于植物内部组织,由于基因转移及对内化学环境适应,内生菌可获得直接合成这些代谢产物、或促进其生物转化的能力,因而,内生细菌种群在高良姜组织间的差异可能也是导致该植物不同组织间活性代谢产物含量差异的原因之一。
几丁质酶和葡聚糖酶是与植物抗病防卫密切相关的水解酶,生长素可直接促进植物生长。产ACC脱氨酶的内生细菌能平衡植物因胁迫诱导产生的乙烯,从而间接促进植物根系延长和植株发育,在提高植物抗旱、涝、盐、病和重金属等压力胁迫中具有重要作用[1,6- 8,25]。在本研究所测试的菌株中,36.36%、51.52%、54.56%和27.27%的菌株分别具有胞外几丁质酶、β-葡聚糖酶,生长素及其ACC脱氨酶产生能力。特别是泛菌L- 2和芽孢杆菌 S- 16所测4个指标均为阳性(表3),是生防菌剂及生物肥料的良好候选;此外,热带根瘤菌菌株R- 1、R- 3 显示了最高的ACC脱氨酶产生及相对高的生长素产生能力(表3)。热带根瘤菌是已报道的极具应用价值的固氮菌,其与多种热带豆科植物具有高的结瘤能力,且对低pH、高温,及多种杀虫剂具有强的抗性[20],菌株R- 1、R- 3是促生菌剂的良好候选。
[1] Reinhold-Hurek B, Hurek T. Living inside plants: bacterial endophytes. Current Opinion in Plant Biology, 2011, 14(4): 435- 443.
[2] 代金霞, 王玉炯. 宁夏荒漠草原小叶锦鸡儿可培养内生细菌多样性及其分布特征. 生态学报, 2012, 32(20): 6300- 6307.
[3] Ikeda S, Okubo T, Anda M, Nakashita H, Yasuda M, Sato S, Kaneko T, Tabata S, Eda S, Momiyama A, Terasawa K, Mitsui H, Minamisawa K. Community and Genome-Based Views of Plant-Associated Bacteria: plant-bacterial interactions in soybean and rice. Plant and Cell Physiology, 2010, 51(9): 1398- 1410.
[4] 周佳宇, 贾永, 王宏伟, 戴传超. 茅苍术叶片可培养内生细菌多样性及其促生潜力. 生态学报, 2013, 33(4): 1106- 1117.
[5] 姜晓宇, 高菊生, 徐凤花, 曹艳花, 唐雪, 张晓霞. 水稻种子内生细菌多样性及其分泌植物生长素能力的测定. 微生物学报, 2013, 53(3): 269- 275.
[6] Redman R S, Kim Y O, Woodward C J D A, Greer C, Espino L, Doty S L, Rodriguez R J. Increased fitness of rice plants to abiotic stress via habitat adapted symbiosis: a strategy for mitigating impacts of climate change. PLOS ONE, 2011, 6(7): e14823.
[7] 卞光凯, 张越己, 秦盛, 邢珂, 谢焕松, 蒋继宏. 南通沿海滩涂耐盐植物重金属抗性内生细菌的筛选及生物多样性. 微生物学报, 2011, 51(11): 1538- 1547.
[8] Mano H, Morisaki H. Endophytic bacteria in the rice plant. Microbes and Environments, 2008, 23(2): 109- 117.
[9] 吕玮, 蒋伶活. 高良姜的化学成分及药理作用. 中国药业, 2006, 15(3): 19- 21.
[10] Lee J, Kim K A, Jeong S, Lee S G, Park H J, Kim N J, Lim S. Anti-inflammatory, anti-nociceptive, and anti-psychiatric effects by the rhizomes ofAlpiniaofficinarumon complete Freund′s adjuvant-induced arthritis in rats. Journal of Ethnopharmacology, 2009, 126(2): 258- 264.
[11] Pepeljnjak S, Kosalec I. Galangin expresses bactericidal activity against multiple-resistant bacteria: MRSA, Enterococcus spp. and Pseudomonas aeruginosa. FEMS Microbiology Letters, 240(1): 111- 116.
[12] Rao K, Ch B, Narasu L M, Giri A. Antibacterial activity ofAlpiniagalanga(L) Willd crude extracts. Applied Biochemistry and Biotechnology, 2010, 162(3): 871- 884.
[13] 赵燕燕, 刘新霞, 陈春生, 白洁. 高良姜提取物对小鼠学习记忆能力及胆碱能神经系统功能的影响. 中药药理与临床, 2010, 26(2): 49- 52.
[14] 张敏, 胡晓, 万津瑜, 雷欣雨, 赵丹萍. 高产几丁质酶的枯草芽孢杆菌诱变育种及发酵条件研究. 中国农学通报, 2010, 26(11): 279- 283.
[15] 汤兴俊, 何国庆. 热稳定性β-葡聚糖酶菌种选育及产酶特性. 农业生物技术学报, 2002, 10(4): 385- 389.
[16] 夏娟娟. 植物促生内生细菌的筛选及其强化油菜富集土壤铅镉重金属的研究[D]. 南京: 南京农业大学, 2006.
[17] Ding T, Palmer M W, Melcher U. Community terminal restriction fragment length polymorphisms reveal insights into the diversity and dynamics of leaf endophytic bacteria. BMC Microbiology, 2013, 13(1): 1- 12.
[18] Giri D D, Shukla P N, Ritu S, Kumar A, Pandey K D. Substrate utilization of stress tolerant methylotrophs isolated from revegetated heavy metal polluted coalmine spoil. World Journal of Microbiology and Biotechnology, 2013, 29(4): 635- 643.
[19] Harshvardhan K, Jha B. Biodegradation of low-density polyethylene by marine bacteria from pelagic waters, Arabian Sea, India. Marine Pollution Bulletin, 2013, 77(1/2): 100- 106.
[21] Qiu Q F, Zhang D M, Ye X S, Zheng Z Z. The bacterial community of coastal sediments influenced by cage culture in Xiangshan Bay, Zhejiang, China. Acta Ecologica Sinica, 2013, 33(2): 483- 491.
[22] 裘琼芬, 张德民, 叶仙森, 郑珍珍. 象山港网箱养殖对近海沉积物细菌群落的影响. 生态学报, 2013, 33(2): 483- 491.
[23] Camarinha-Silva A, Wos-Oxley M L, Jáuregui R, Becker K, Pieper D H. Validating T- RFLP as a sensitive and high- throughput approach to assess bacterial diversity patterns in human anterior nares. FEMS Microbiology Ecology, 2012, 79(1): 98- 108.
[24] 李献梅, 王小芬, 崔宗均. 末端限制性片段长度多态性技术(T-RFLP)在微生物群体分析上的应用与技术优化. 中国农业大学学报, 2009, 14(4): 1- 9.
[25] Glick B R. Bacteria with ACC deaminase can promote plant growth and help to feed the world. Microbiological Research, 2014, 169(1): 30- 39.
Diversity and plant growth-promoting potential of bacterial endophytes ofAlpiniaOfficinarumHance, a famous south-China medicinal plant
LI Shubin*, HUANG Juan, ZHOU Renchao, LI Ze′en, XU Shiru, RUAN Ting, PANG Qihua
CollegeofLifeScience,SouthChinaNormalUniversity,Guangzhou510631,China
AlpiniaofficinarumHance, which is a species of the familyZingiberaceae, is a perennial medicinal plant that is mainly distributed in the tropical and subtropical regions of Southeast Asia. Although the endophytic communities of various crop plants and several medicinal plants have been investigated, no publications have reported research related to the endophytes ofA.officinarumHance. In the present study, a culture-dependent method combined with a terminal-restriction fragment length polymorphism (T-RFLP) technique-based culture-independent method were applied to assess the diversity of the culturable bacterial endophyte communities and total bacterial endophyte communities ofA.officinarumHance. Using the culture-dependent isolation method, 136 bacterial isolates were obtained from the internal tissues of root, rhizome, stem, and leaf of healthy, 4-year-oldA.officinarumHance plants collected from Longtang Town in Xuwen County, Guangdong Province, China. We selected theA.officinarumHance plants growing in this area because the quality and pharmacological effects of these medicinal plants growing in this area are traditionally considered to be significantly higher than those of any other areas of China. Based on 16S rDNA sequence analysis, the bacterial isolates represented 16 distinct 16S rDNA gene types, 12 distinct bacterial genera, and 15 distinct bacterial species. The most dominant bacterial population was the genusBacillus, followed byMethylobacterium. The culturable bacterial communities that were obtained from the different tissues of the medicinal plant were significantly different, and several bacterial populations displayed some level of tissue preference in the host plant. Using the T-RFLP-based culture-independent method, 36 distinct Terminal-Restriction Fragments (T-RFs) were detected from the amplified,HhaI mono-digestion-targeted 16S rDNA gene sequences from internal tissues of the root, rhizome, stem, and leaf ofA.officinarumHance plants collected from the same sites. The corresponding taxons of the dominant T-RFs were linked to highly resistantBacillusandMethylobacterium, as well as several marine bacterial orders, such as Oceanospirillales, Pseudomonadales, Vibrionales, and Rhodobacterales, which indicated that the population composition of the total bacterial endophyte community inA.officinarumHance was significantly correlated with the environment of the host. The numbers of total T-RFs, the dominant T-RFs, and their corresponding taxons were significantly different between tissues ofA.officinarumHance. These observations indicated that the tissue types ofA.OfficinarumHance could contribute to the variation in the bacterial endophyte communities of the plant. Furthermore, the isolated bacterial endophytes were screened for a panel of beneficial effects that included the production of extracellular chitinase and β-glucanase, indoleacetic acid (IAA), as well as 1-aminocyclopropane- 1-carboxylic acid (ACC) deaminase. Many of the strains displayed positive results in these assays (chitinases: 36.36%, β-glucanase: 51.52%, IAA: 54.55%, ACC deaminase: 27.27%). In particular, the isolates L- 2, which was assigned to thePantonesp., and S- 16, which was assigned to theBacillussp., were capable of co-producing chitinases, β-glucanase, IAA, and ACC deaminase, and are potential candidates for use as biocontrol agents and in biofertilizers. In addition, two isolates (R- 1, R- 3) that were assigned toRhizobiumtropicicould produce IAA and ACC deaminase; therefore, they are good candidates for use as plant growth-promoting bacteria.
AlpiniaofficinarumHance; bacterial endophytes; culture-dependent method; T-RFLP technique; plant growth-promoting potential
国家自然科学基金资助项目(31070003); 广州市科技计划项目(2013J4100050)
2013- 12- 11;
2014- 08- 13
10.5846/stxb201312112929
*通讯作者Corresponding author.E-mail: shuli_1990@126.com
李淑彬, 黄娟, 周仁超, 李泽恩, 徐诗如, 阮婷, 庞启华.南药植物高良姜内生细菌多样性及其促生潜力.生态学报,2015,35(10):3204- 3213.
Li S B, Huang J, Zhou R C, Li Z E, Xu S R, Ruan T, Pang Q H.Diversity and plant growth-promoting potential of bacterial endophytes ofAlpiniaOfficinarumHance, a famous south-China medicinal plant.Acta Ecologica Sinica,2015,35(10):3204- 3213.
