花荵叶片愈伤组织的诱导1)
2015-02-08刘紫微赵鑫焦孟月张彦妮
刘紫微 赵鑫 焦孟月 张彦妮
(东北林业大学,哈尔滨,150040)
花荵叶片愈伤组织的诱导1)
刘紫微 赵鑫 焦孟月 张彦妮
(东北林业大学,哈尔滨,150040)
以花荵(Polemoniumcoeruleum)叶片为外植体,研究了不同消毒方法对叶片白化率的影响、不同激素种类及激素组合对叶片愈伤组织诱导的影响。结果表明:较适合花荵叶片消毒的方法是质量分数为75%的酒精消毒30 s后、质量分数为1%的NaClO消毒6 min,叶片白化率低,存活率较高。叶片愈伤组织诱导最佳培养基:MS+1.0 mg·L-16-BA(6-苄氨基腺嘌呤),诱导率为88.9%。
花荵;叶片愈伤组织;诱导培养基;叶片白化率
花荵(Polemoniumcoeruleum)为花荵科花荵属多年生草本植物,一般生长在海拔1 500 m以上的亚高山草甸中,分布于东北、华北等省区。株高30~80 cm,奇数羽状复叶,互生,叶轴具狭翅,具小叶11至21片,圆锥状聚伞花序顶生,花萼宽钟形,先端5裂,花冠蓝紫色,具有很高的观赏价值,抗寒性强,是有待开发和应用的野生花卉。在中国植物志第64卷中记载:花荵科有15属约300种,主产北美洲西部,欧洲、亚洲只有很少的种类;我国有3属6种,其中4种系栽培。国内外对花荵的研究多集中于其药理作用,研究实验证明,花荵科植物对一些动物的胆固醇性动脉硬化有治疗的作用,使皮肤、动脉、肝脏、角膜及其他内脏类脂质的黏着减少。花荵科植物能够使积累在细胞内的胆固醇及时排出,起到了降低血脂的作用[1]。对同属的宿根福禄考和丛生福禄考研究的很多,且在组织培养快速繁殖方面也有很多研究,已经建立了完善的组织培养再生体系[2-9];但对花荵的繁殖栽培研究很少。鉴于花荵在园林美化及医学上的应用前景,有必要通过组织培养对其进行扩繁,为其种质资源保存和园林推广应用提供参考。本文以花荵叶片为外植体,对其进行愈伤组织诱导,以期为下一步完善花荵组织培养体系建立奠定基础。
1 材料与方法
试验材料:以东北林业大学园林学院温室里盆栽的花荵植株为母株,选用生长良好的幼嫩叶片作为外植体。
外植体的消毒:选取花荵的幼嫩叶片,用加有洗涤剂的水洗2~3 min,自来水冲洗30 min。在超净工作台上,用75%的酒精消毒30 s,倒去酒精,无菌水冲洗1次;再分别用不同质量分数(1%、2%、3%)的次氯酸钠(NaClO)消毒6 min,无菌水冲洗3次,用无菌滤纸吸干表面的水分,将叶片剪成约1 cm2的块,接种到MS基本培养基上。两周后,统计污染率、白化率、存活率,筛选出适宜消毒的NaClO质量分数。
消毒时间的选择:用筛选出的最适宜质量分数的NaClO消毒6、8、10 min,消毒方法同上,之后放在培养室培养。两周后,观察并统计外植体的污染率、白化率,选出最适的消毒时间。
愈伤组织的诱导:将花荵叶片清洗消毒后,切成1 cm2左右的块,接种到不同的诱导培养基上。诱导培养基为:MS基本培养基+6-苄氨基腺嘌呤(缩写6-BA)(0.5、1.0、1.5 mg·L-1);MS基本培养基+玉米素(缩写ZT)(0.1、0.5、1.0 mg·L-1);MS基本培养基+2,4-二氯苯氧乙酸(缩写2,4-D)(0.05、0.10、0.20 mg·L-1);MS附加不同浓度6-BA、2,4-D或ZT分别与不同浓度萘乙酸(缩写NAA)混合成的培养基。20 d后,观察并统计愈伤组织诱导率及叶片的变化。每种处理接种20个叶片,3次重复。白化率=(白化的外植体数/接种外植体数)×100%;污染率=(污染的外植体数/接种外植体数)×100%;诱导率=(产生愈伤组织的外植体数/接种的外植体数)×100%。
2 结果与分析
2.1 消毒剂质量分数和消毒时间的确定
由表1可见:NaClO的质量分数对叶片白化率影响较大,随着消毒剂质量分数的增加,污染率降低,但白化率大幅度增加。质量分数为3%的NaClO处理的叶片,白化率为100%。白化率较高,主要是因为叶片脱毒时消毒剂质量分数较高或消毒时间过长,对叶片组织破坏[10]。综合考虑,NaClO质量分数为1%,最适宜消毒。
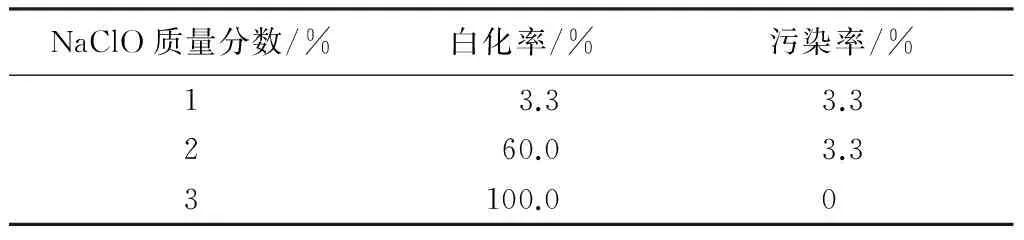
表1 不同质量分数NaClO对叶片的消毒效果
由表2可见:消毒时间延长,增加了叶片的白化率。消毒6 min时白化率最低,污染率也相对较低。综合考虑,NaClO的消毒时间,6 min为适宜。
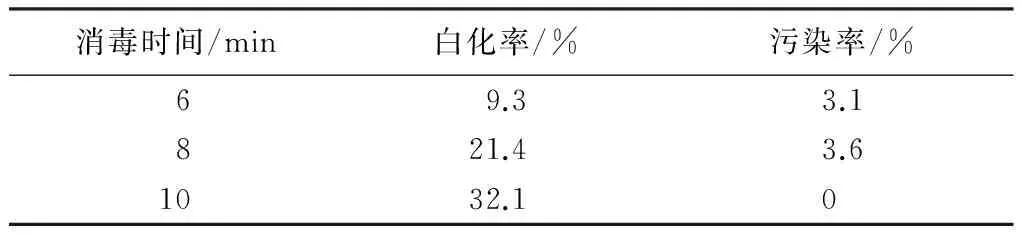
表2 不同消毒时间对叶片的影响
2.2 愈伤组织的诱导
2.2.1 不同浓度6-BA、2,4-D、ZT对花荵叶片愈伤诱导的影响
在培养基上添加不同浓度的6-BA、2,4-D、ZT诱导叶片愈伤组织,结果表明(见表3):激素种类不同,诱导效果不同。随着6-BA浓度的增加,愈伤组织诱导率先增加后降低,愈伤组织的颜色、紧密度、长势不同。6-BA浓度为0.5 mg·L-1时,叶片在培养17 d后,产生淡绿色愈伤组织,结构紧实,长势一般;6-BA浓度为1.0 mg·L-1时,在接种15 d时,出现淡绿色愈伤组织,结构疏松,长势良好,诱导率最高(88.9%);当6-BA浓度为1.5 mg·L-1时,叶片在培养15 d时,出现绿色愈伤组织,结构紧实,长势一般。2,4-D浓度为0.05 mg·L-1时,叶片在培养16 d时,出现淡绿色疏松状愈伤组织,长势良好,诱导率为72.2%;当2,4-D浓度为0.10 mg·L-1时,诱导出的愈伤组织呈绿色紧实状,愈伤组织出现时间为15 d,诱导率为66.7%;当2,4-D浓度为0.20 mg·L-1时,在14 d出现绿色愈伤组织,诱导率为44.4%。随着2,4-D浓度的增加,产生的愈伤组织颜色加深,结构更紧实。由此可见,低浓度(0.05 mg·L-1)的2,4-D诱导愈伤组织效果较好,增加浓度反而抑制了愈伤组织的形成。随着ZT浓度的增加,愈伤组织颜色由淡绿色疏松状、绿色疏松状、绿色紧实状变化。愈伤组织出现的时间大致相同,均在15 d左右;愈伤组织的诱导率先增后降,在ZT为0.5 mg·L-1时,诱导率最高(77.8%)。综合考虑,1.0 mg·L-16-BA诱导花荵叶片形成愈伤组织效果最好。
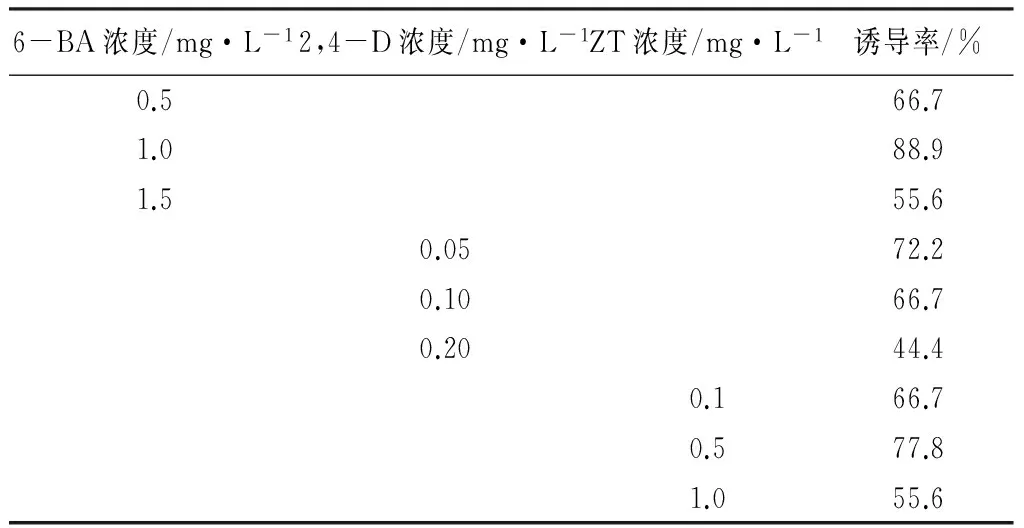
表3 6-BA、2,4-D、ZT单一激素对叶片愈伤组织诱导的影响
2.2.2 不同浓度ZT和NAA对花荵叶片诱导愈伤的影响
将花荵叶片接入不同浓度ZT和NAA组合的培养基上,结果发现(见表4):ZT浓度为0.5 mg·L-1的3种培养基中,叶片愈伤组织诱导率相对较高;NAA为0.05、0.10 mg·L-1时,诱导率均为66.7%。但愈伤组织在NAA浓度为0.10 mg·L-1时,长势较好。因此,在ZT和NAA的组合中,诱导叶片愈伤组织的最佳激素配比为:0.5 mg·L-1ZT+0.1 mg·L-1NAA。
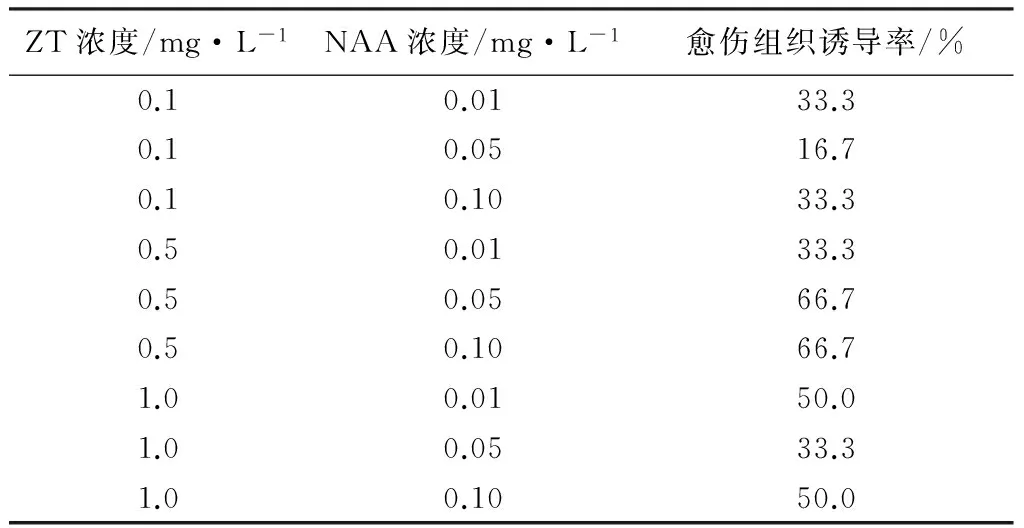
表4 不同浓度ZT和NAA对愈伤组织的影响
2.2.3 不同浓度6-BA和NAA对花荵叶片诱导愈伤的影响
将花荵叶片接种到不同浓度的6-BA和NAA的混合培养基上,结果发现(见表5):当6-BA浓度为1.0 mg·L-1时,随着NAA浓度的增加,诱导率呈下降的趋势。6-BA浓度为1.0 mg·L-1、NAA浓度为0.01 mg·L-1时,诱导率最高(83.3%),且愈伤组织为淡绿色,结构疏松,长势好。所以,诱导叶片愈伤组织的最佳6-BA和NAA的组合为:1.0 mg·L-16-BA+0.01 mg·L-1NAA。
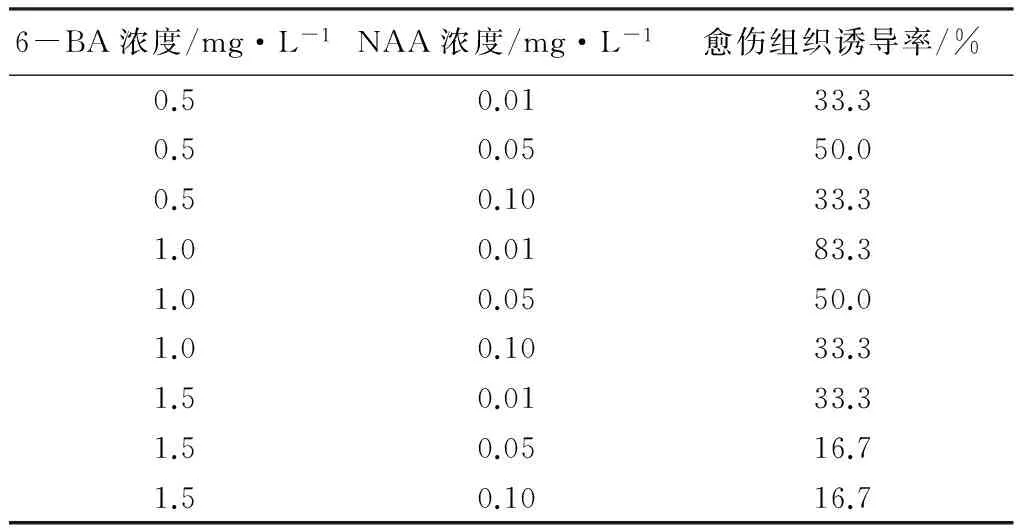
表5 不同浓度6-BA和NAA对愈伤组织的影响
2.2.4 不同浓度2,4-D和NAA对花荵叶片诱导愈伤的影响
将叶片接种到加有不同浓度2,4-D和NAA培养基上,结果发现(见表6):在加有2,4-D的培养基上,叶片均产生愈伤组织。在2,4-D为0.05 mg·L-1、NAA为0.01 mg·L-1和0.05 mg·L-1时,诱导率最高(均为66.7%),愈伤组织颜色为淡绿色,长势良好。随着NAA浓度的增加,愈伤组织颜色变深,且结构变得更紧实。而2,4-D浓度为0.2 mg·L-1时,愈伤组织诱导率相对较低,对于花荵叶片,0.2 mg·L-1属于高浓度,高浓度的2,4-D会抑制愈伤组织的形成。
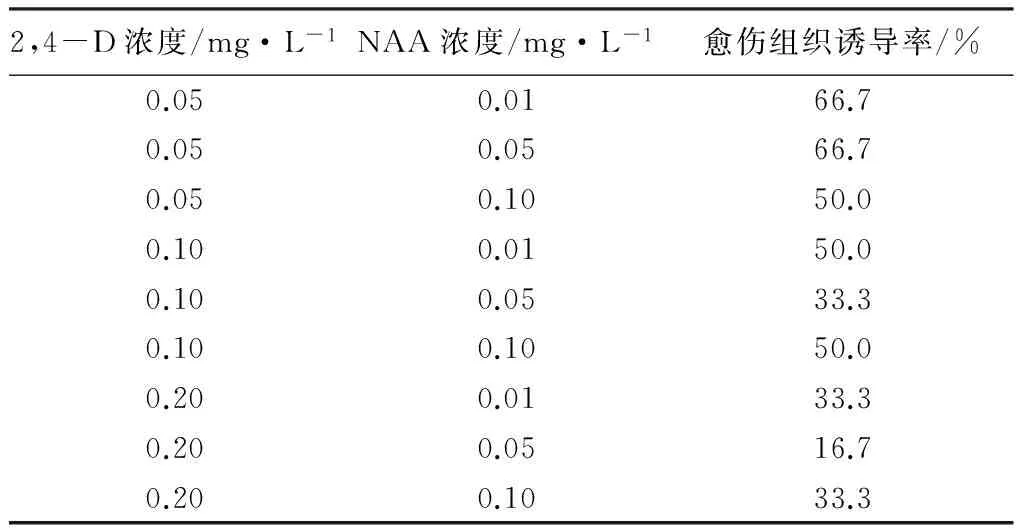
表6 不同浓度2,4-D和NAA对愈伤组织的影响
3 结论与讨论
外植体的选择,对于植物的组织培养十分重要。不同年龄、不同基因型、不同部位的外植体,对培养的反应和繁殖效果有差异[11]。因花荵分枝少、叶片多,对植物观赏性影响不大,所以本实验选用花荵叶片作为外植体进行愈伤组织诱导。在组织培养中,常用的消毒剂有升汞(HgCl2)、NaClO、高锰酸钾(KMnO4)等,由于NaClO容易清洗、对环境没有污染,实验选择NaClO作为消毒剂。消毒剂质量分数的大小、消毒时间的长短,对外植体的消毒起着重要影响,而两者之间的影响又存在着线性关系。使用3% NaClO时,白化率达到100%。消毒时间过长,会造成白化率升高(消毒10 min,白化率为32.1%);随着消毒时间的减少,在白化率和污染率较低时,选为适宜的消毒时间。本实验得到的适宜消毒方法:用装有75%酒精的无菌三角瓶中迅速冲洗30 s后,再用1%的NaClO消毒6 min,再用无菌水冲洗3次,污染率为3.1%、白化率为9.3%。
植物激素种类和浓度,对外植体愈伤组织诱导影响较大。本实验分别用不同浓度的ZT、6-BA、2,4-D以及它们分别与不同浓度NAA混合进行试验,其中:6-BA的诱导效果最好,当加入NAA后三种激素的诱导效果都有所下降,但相对而言,低浓度(0.01 mg·L-1)有利于愈伤组织的诱导。这一结果与宋利伟等[12]的研究结果不同。多数研究认为,2,4-D是影响愈伤组织质量及愈伤组织分化能力的重要因子,在一定的浓度范围内,随着2,4-D浓度的增加诱导率增高[13]。但对花荵叶片,低浓度(0.05 mg·L-1)的诱导效果好,且在本实验中其诱导效果不如6-BA和ZT。再次说明,基因型不同,激素的诱导效果不同。每种植物都要进行激素种类和浓度的探究。对于目前得到的愈伤组织进一步分化,还有待进一步试验研究。
[1] 秦瑀.花荵水煎液对实验性高脂血症动物作用的研究[J].吉林农业大学学报,2005,27(3):296-298,305.
[2] 殷丽青,黄卫昌,胡永红,等.宿根福禄考组织培养快速繁殖技术[J].上海交通大学学报:农业科学版,2008,26(2):161-164.
[3] 高丽霞,孔旭晖.锥花福禄考的组织培养及快速繁殖[J].中国农学通报,2005,21(12):314-315.
[4] 郭旭欣.宿根福禄考组织培养及快繁技术[J].北方园艺,2009(3):117-118.
[5] 弭晓菊,李玉芬.宿根福禄考组织培养技术与快繁研究[J].哈尔滨师范大学自然科学学报,1997,13(3):85-88.
[6] 文言,李玥莹.锥花福禄考组织培养的研究[J].沈阳农业大学学报,1999,30(2):125-127.
[7] 建德锋,于延申,辛丽红.丛生福禄考的组织培养试验[J].吉林蔬菜,2004(1):33.
[8] 周强.多效唑对宿根福禄考的矮化效应研究[D].长春:吉林农业大学,2013.
[9] 张伟.两种福禄考组织培养再生及受体再生体系建立[D].哈尔滨:东北林业大学,2008.
[10] 任敏,吴羽晨,张家洋,等.金银花愈伤组织的诱导[J].江苏农业科学,2015,43(3):38-40.
[11] 于传.美国红枫(Acerrubrum)的组织培养技术体系研究[D].重庆:西南大学,2013.
[12] 宋利伟,张存旭,康永翔,等.太白米离体愈伤组织诱导及植株再生[J].东北林业大学学报,2014,42(9):107-110,115.
[13] 陈季琴,韩烈保.正交设计在多年生黑麦草组织培养中的应用[J].中国草地,2004,26(6):57-62,72.
Callus Induction from Leaves ofPolemoniumcoeruleum//
Liu Ziwei, Zhao Xin, Jiao Mengyue, Zhang Yanni
(Northeast Forestry University, Harbin 150040, P. R. China)//Journal of Northeast Forestry University,2015,43(9):45-47.
We used the leaves ofPolemoniumcoeruleumto study the effects of different disinfection method, different hormone type and hormone combination on callus induction from leaves. The best disinfection method was with 75% ethanol for 30 s and 0.1% NaClO for 6 min, the leaf bleaching rate was low, and the survival rate was high. Optimal callus induction medium was MS medium with 1.0 mg·L-16-BA with the induction rate of 88.9%.
Polemoniumcoeruleum; Callus induction from leaf; Induction medium; Leaf bleaching rate
1)黑龙江省留学归国基金项目(LC201410)。
刘紫薇,女,1992年2月生,东北林业大学园林学院,学士本科生。E-mail:1696275141@qq.com。
张彦妮,东北林业大学园林学院,副教授。E-mail:ynzhang808@126.com。
2015年6月30日。
Q943.1
责任编辑:张 玉。
