重症脑梗死患者血清免疫炎性细胞因子水平变化研究
2015-02-08杨晓军邢瑞斌田晓玲杨国锋高艳华
杨晓军,邢瑞斌,田晓玲,杨国锋,高艳华
(1. 河北省青龙满族自治县中医院,河北 青龙 066500;2. 河北省青龙满族自治县医院,河北 青龙 066500)
重症脑梗死患者血清免疫炎性细胞因子水平变化研究
杨晓军1,邢瑞斌1,田晓玲1,杨国锋1,高艳华2
(1. 河北省青龙满族自治县中医院,河北 青龙 066500;2. 河北省青龙满族自治县医院,河北 青龙 066500)
目的分析重度脑梗死患者血清超敏C反应蛋白(hs-CRP)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)水平与Treg/CD4+细胞、Th17/CD4+T细胞比例变化,比较Treg/CD4+细胞、Th17/CD4+T细胞比例与患者病情严重程度GCS评分相关性。方法选择重度急性脑梗死患者80例, 依据入院后24 h病情严重程度评分(格拉斯哥昏迷评分,Glasgow Coma Scale,GCS)将患者分为重度组(30例)与特重组(50例)。酶联免疫吸附法检测发病后24 h患者外周血清中hs-CRP、IL-6、TNF-α水平。流式细胞术检测外周血清中Treg/CD4+细胞、Th17/CD4+T细胞比例变化,采用Pearson直线相关分析Treg/CD4+细胞、Th17/CD4+T细胞比例与GCS评分之间相关性。结果发病后,重度组与特重组患者hs-CRP、IL-6、TNF-α水平比较差异有统计学意义。外周血Treg/CD4+细胞百分比、Th17/CD4+T细胞比例2组比较差异有统计学意义(P<0.05)。血清Th17/CD4+T细胞百分比与GCS评分呈正相关(r=5.981,P<0.05),血清Treg/CD4+细胞百分比与GCS呈直线正相关(r=-4.872,P<0.05)。结论急性重症脑梗死患者发病后体内存在严重的免疫抑制炎症反应。主要表现为炎性细胞因子hs-CRP、IL-6、TNF-α水平上升以及Treg/CD4+细胞比例升高、Th17/CD4+T细胞比例下降。免疫调节性T细胞、抑制性T细胞比例变化与临床病情严重程度存在相关性。
重度脑梗死;CD4+;T细胞;Th17;炎性因子;Treg
急性脑梗死发生后机体可发生多种病理反应变化,其中氧化应激学说、炎症反应学说、交感兴奋学说以及免疫调节机制学说等均从不同角度解释梗死后缺血反应的病理生理过程[1]。近年来,免疫炎症反应机制学说在急性脑梗死病理生理过程中占有重要地位[2]。重症脑梗死患者发病后易患各种并发症,如卒中后相关性感染的发生率增加等。对于不同程度重度脑梗死患者,机体免疫炎性反应程度是否存在不同,免疫指标高低与反应病情程度评分之间是否存在相关性,目前尚缺乏研究。本研究分析了不同程度重度脑梗死患者血清超敏C反应蛋白(hs-CRP)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)水平与Treg/CD4+细胞、Th17/CD4+T细胞比例的变化,并进一步比较Treg/CD4+细胞、Th17/CD4+T细胞比例与患者病情严重程度评分关系。
1 临床资料
1.1研究对象 选择重度急性脑梗死患者80例,均符合重度脑梗死诊断标准:①脑梗死诊断符合2010年中国缺血性脑卒中和短暂性脑缺血发作二级预防指南[3];②入组患者均经过头颅影像学检查证实;③入院时格拉斯哥昏迷评分(Glasgow coma scale,GCS)<12分。病例排除标准:①急性脑梗死GCS评分≥12分者;②合并急性感染性疾病、恶性肿瘤、慢性疾病终末期、3个月内使用免疫调节剂患者。依据入院后24 h病情严重程度评分(GCS)将患者分为重度组(GCS评分8~11分)与特重组(GCS评分3~7分)。 重度组30例,男18例,女12例;年龄(68.65±6.39)岁;体质量指数(27.45±3.18)kg/m2;脑梗死危险因素:高血压22例,糖尿病13例,高血脂症21例,房颤6例。特重组50例,男28例,女22例;年龄(69.01±5.41)岁;体质量指数(27.45±3.18)kg/m2;脑梗死危险因素:高血压38例,糖尿病20例,高血脂症28例,房颤9例。2组患者一般资料差异无统计学意义(P均>0.05)。本研究得到医院科学研究伦理委员会批准,所有治疗获得患者或者家属的知情同意,签署知情同意书。
1.2检测方法 所有患者均在发病后24 h内抽取肘静脉血5 mL,3 000 r/min离心沉淀,-20 ℃冰箱保存备检。酶联免疫吸附法检测患者外周血清中hs-CRP、IL-6、TNF-α水平,流式细胞术检测外周血清中Treg/CD4+细胞、Th17/CD4+T细胞比例变化。
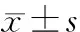
2 结 果
2.12组患者hs-CRP、IL-6、TNF-α水平变化 发病后,重度组与特重组患者hs-CRP、IL-6、TNF-α水平差异有统计学意义(P均<0.05),见表1。
2.22组患者Treg、Th17水平变化比较 重度组外周血清中Treg/CD4+细胞百分比与特重组比较明显降低,Th17/CD4+T细胞比例明显升高,2组比较差异有统计学意义(P<0.05),见表2。血清Th17/CD4+T细胞百分比与GCS评分呈负相关(r=5.981,P<0.05),血清Treg/CD4+细胞百分比与GCS呈直线负相关(r=-4.872,P<0.05)。见图1及图2。
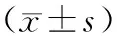
表1 2组患者hs-CRP、IL-6、TNF-α水平比较
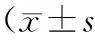
表2 2组患者Treg、Th17水平变化比较,%)
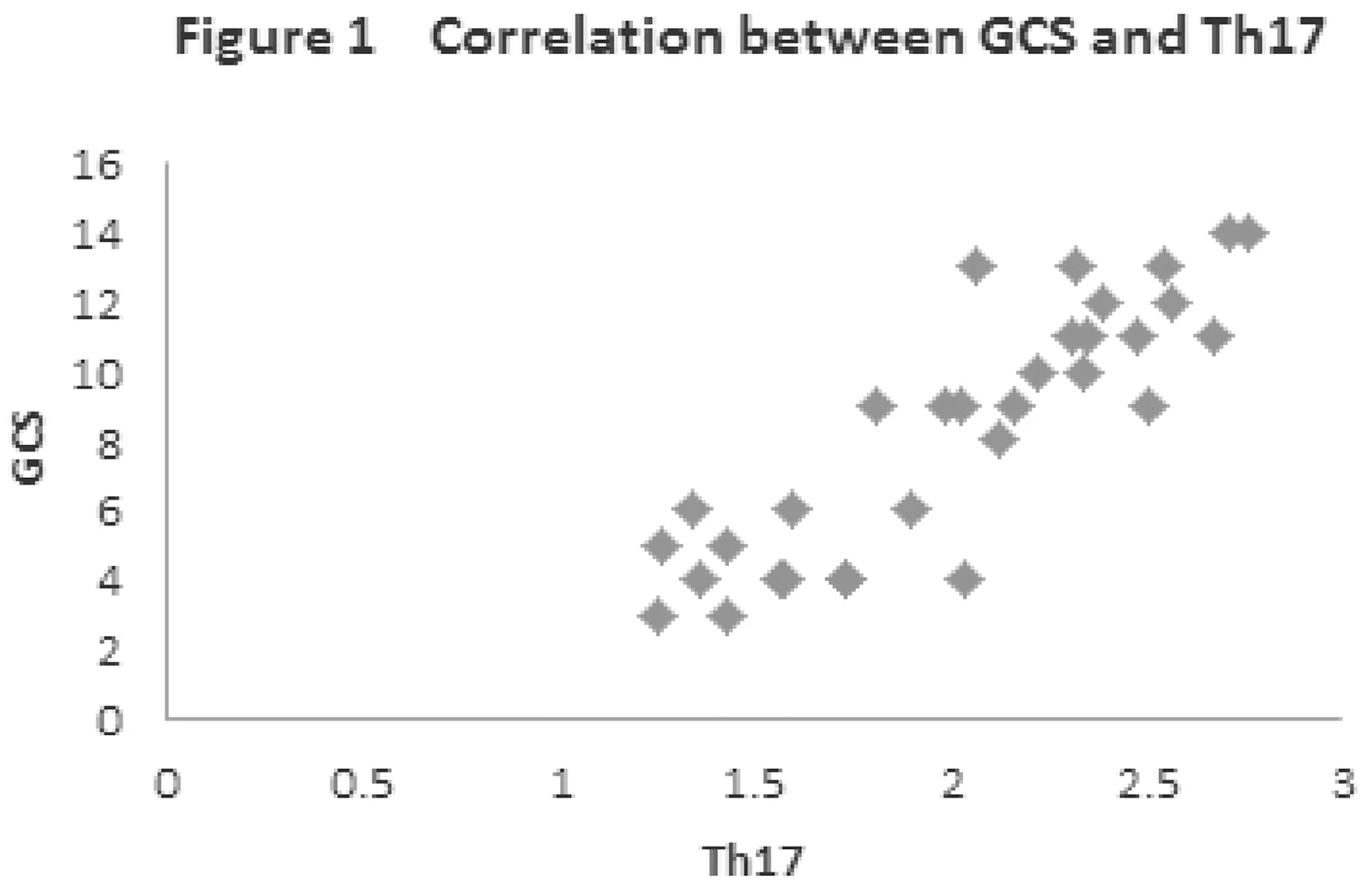
图1 Th17和GCS评分的相关性
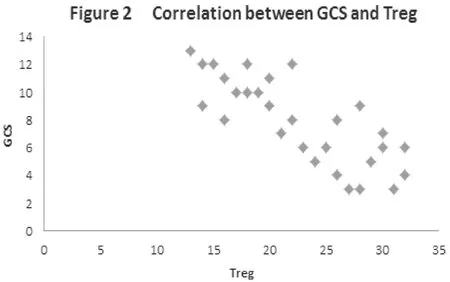
图2 Treg和GCS评分的相关性
3 讨 论
急性缺血性脑损伤后血管内皮功能紊乱,血管通透性改变,造成血脑屏障功能障碍。中心粒细胞黏附内皮细胞通过毛细血管间隙迁移、转移至坏死脑组织周围,聚集的白细胞能够释放氧自由基,蛋白水解酶增加,同时聚集的炎性细胞可释放C反应蛋白、IL-6、肿瘤坏死因子等炎性介质与细胞因子,循环往复,加重局部脑组织损伤。有研究证实[4-5]脑缺血发生后,缺血坏死的脑组织可触发一系列免疫炎性反应。近年来研究表明[6-7]免疫介导的炎性损伤在缺血性脑卒中发病中占有重要地位。迁移聚集的单核细胞不仅吞噬脂质,而且将低密度脂蛋白颗粒的抗原决定簇等抗原信息通过主要组织相容性复合体递呈T淋巴细胞,继而激活细胞免疫系统,诱发CD4+T细胞增殖。CD4+T细胞分为两个亚群:Th1与Th2细胞。Th1细胞主要分泌IL-6、TNF-α等促炎因子。Th2细胞分泌IL-10、IL-5等抑炎因子。细胞免疫炎性反应实验证实CD4+T细胞在动脉粥样硬化过程中发挥重要作用。CD4+CD25+调节性T细胞(Treg细胞)是一种表达Fxop3的抑制性T细胞(Th2)亚群,可能通过介导抑制性炎性信号IL-10和TGF-β1来调节CD4+T细胞在动脉粥样硬化中的表达。
Th17是近年来研究较多的一种CD4+T细胞亚群。由于该亚群可以产生IL-17,因此又称为Th17细胞,其主要效应分子为IL-17。Th17、Th1、Treg细胞间相互影响。Th17、Th1是主要的促炎细胞,Treg细胞具有广泛的抑制功能,可以同时抑制Th17、Th1细胞的产生。效应性T细胞亚群和调节性T细胞亚群之间的动态平衡对于维持机体自身免疫平衡稳定具有重要作用。任何炎性反应的产生及恢复均伴随着免疫平衡系统关系的破坏。近年来研究[8-9]发现在Th17与Th1之间存在一种漂移关系。即Th17、Th1与Treg细胞间的比例平衡关系破坏可能在急性缺血性脑卒中发病中占有重要地位,而炎性介质的变化有可能与上述因素有关。
本研究结果显示,发病后,重度组与特重组患者hs-CRP,IL-6,TNF-α水平差异有统计学意义(P均<0.05)。重度组外周血清中Treg/CD4+细胞百分比与特重组比较明显降低,Th17/CD4+T细胞比例明显升高,2组比较差异有统计学意义(P均<0.05)。血清Th17/CD4+T细胞百分比与GCS评分呈负相关(r=5.981,P<0.05),血清Treg/CD4+细胞百分比与GCS呈直线负相关(r=-4.872,P<0.05)。表明急性重症脑梗死患者发病后体内存在严重的免疫炎症反应。免疫调节与抑制性T细胞比例变化与临床病情严重程度存在相关性。急性脑缺血后炎性反应是一个自限性动态变化过程。炎症反应的消退并不是促炎因子自然消退的过程,而可能是抑制炎症反应调节过度失衡的过程,促炎因子与抑炎因子的适度调节有助于免疫调节平衡,在脑缺血反应中起到保护作用。
[1] 张梅,田英,刘翠萍. 脑梗死与炎症反应关系研究进展[J]. 现代中西医结合杂志,2011,20(15):1946-1949
[2] 元小冬,侯秋霞,吴寿岭,等. 炎症细胞因子改变与脑梗死的相关性研究[J]. 中国神经免疫学和神经病学杂志,2004,11(3):185-186
[3] 中华医学会神经病学分会脑血管病学组缺血性脑卒中二级预防指南撰写组. 中国缺血性脑卒中和短暂性脑缺血发作二级预防指南2010[J]. 中华神经科杂志,2010,43(2):154-160
[4] Jie Pan,Julie Palmteer,Tim Schallert,et al. Nocvel humanized recombinant T cell receptor Ligand protects brain in females after experimental stroke[J]. Stroke,2014,45(2):A13
[5] Polyxeni T,Mantani,Irena Ljungcrant,et al. Circulating CD40+and CD86+B cell subsets demonstrate opposing associations with risk of stroke[J]. Arterioscler Thromb Vasc Biol,2014,34(1):211-218
[6] 冯娟,王宪. 调节性T细胞在动脉粥样硬化发病中的作用[J]. 生理科学进展,2007,38(1):58-61
[7] 刘涛,李浪. 辅助性T细胞17及调节性T细胞与动脉粥样硬化关系研究进展[J]. 中华老年心脑血管病杂志,2014,16(10):1103-1105
[8] 李茜,陈兴东,段满林. 急性脑缺血对机体免疫系统的影响[J]. 医学研究生学报,2013,26(6):654-657
[9] Gokhan,Yilmaz,Thiruma V,et al. Role of T lymphocytes and interferon in ischemic stroke[J]. Circulation,2006,113(5):2105-2112
10.3969/j.issn.1008-8849.2015.31.035
R743.33
B
1008-8849(2015)31-3511-03
2015-05-10
