维药肉豆蔻提取物对人结肠癌HCT-116细胞的抑制作用
2015-02-07邓皖利张洪平吕书勤
范 磊,邓皖利,,张洪平,吕书勤,
(1. 新疆医科大学,新疆 乌鲁木齐 830000;2. 新疆医科大学第四附属医院,新疆 乌鲁木齐 830000)
维药肉豆蔻提取物对人结肠癌HCT-116细胞的抑制作用
范 磊1,邓皖利1,2,张洪平2,吕书勤1,2
(1. 新疆医科大学,新疆 乌鲁木齐 830000;2. 新疆医科大学第四附属医院,新疆 乌鲁木齐 830000)

目的 探讨维吾尔药材肉豆蔻乙酸乙酯提取物对人结肠癌HCT-116细胞的生长及侵袭转移的影响。方法 取对数生长期人结肠癌HCT-116细胞,实验分为6组,除对照组外,A、B、C、D、E组分别给予31.25,62.5,125,250,500g/L肉豆蔻乙酸乙酯提取物干预。MTT法检测HCT-116细胞增殖情况,流式细胞仪分析HCT-116细胞凋亡情况和细胞周期变化,酶联免疫吸附法检测HCT-116细胞分泌上皮性钙黏附蛋白(E-cadherin)、基质金属蛋白酶-2(MMP-2)、MMP-9情况。结果 与对照组比较,肉豆蔻乙酸乙酯提取物对人结肠癌HCT116细胞的生长具有显著抑制作用,且随肉豆蔻乙酸乙酯提取物浓度的增加,细胞凋亡率逐渐升高;与对照组比较,肉豆蔻乙酸乙酯提取物各组G0/G1期的细胞比例明显增加,G2/M期的细胞比例明显减少,E-cadherin表达水平明显上调,MMP-2及MMP-2表达水平明显降低。结论肉豆蔻乙酸乙酯提取物能显著抑制人结肠癌HCT-116细胞的增殖,促进细胞凋亡,且呈剂量依赖性。该药通过上调E-cadherin、下调MMP-2及MMP-9的表达起到抗侵袭转移作用。
肉豆蔻;HCT-116细胞;细胞凋亡;E-cadherin;MMP-2;MMP-9
结肠癌是常见的严重威胁人类健康的肿瘤之一,其发病率和病死率呈逐年上升趋势,在我国位于恶性肿瘤和致死因素的第4位[1],且发达地区的肠癌发病率呈上升态势[2]。尽管近年来以手术治疗为主的综合治疗使肠癌患者的预后有所改善,但术后5 年生存率仍在50%~60%。恶性肿瘤的浸润和转移是患者术后死亡的主要原因。因此,阐明肠癌浸润和转移相关的机制,从而指导临床治疗方案的选择,可减少术后复发和转移,提高术后生存率。长期的临床实践发现,中药对于结肠癌的治疗,尤其是抗复发转移方面具有显著疗效[3]。本研究探讨了维药肉豆蔻乙酸乙酯提取物对人结肠癌HCT-116细胞的抑制作用以及对上皮性钙黏附蛋白(E-cadherin)、基质金属蛋白酶-2(MMP-2)、MMP-9的调控作用,旨在明确维药肉豆蔻抗肿瘤的作用靶点,为其在临床应用提供实验依据。
1 实验资料
1.1细胞及药材 人结肠癌HCT-116细胞(上海中科院细胞研究所),肉豆蔻(新疆维吾尔自治区中医院,经李永和主任药师鉴定为肉豆蔻科植物肉豆蔻的干燥成熟种仁)。
1.2 实验仪器 超净工作台(中国上海智诚zHJH-C1112B),5804R高速冷冻离心机(德国Eppendorf公司),酶标仪(美国Thermo公司),流式细胞仪(美国MILLPORE公司GUAVAEASYCYTE 8HT),二氧化碳培养箱(美国Thermo公司),5 mL移液管、10mL移液管、100mm细胞培养皿、6孔板、96孔细胞培养板(美国cosTAR公司),移液器(德国eppendorf公司)。
1.3 实验试剂 RPMIl640培养基(美国Gibco公司),PBS(美国Hyclone公司),胎牛血清(美国Hyclone公司),青链霉素混合液(美国Hyclone公司),0.25%胰蛋白酶-EDTA消化液(北京solarbio公司),75%乙醇(分析级,天津市富宇精细化工有限公司),四甲基偶氮唑盐MTT(Sigma公司),PE Annexin V/7-ADD(美国BD Biosciences公司),PI/RNase(美国BD Biosciences公司),ELISA试剂盒(日本IBL公司)。
1.4 方法 实验分为6组:HCT-116细胞+等量空白培养基组为对照组,HCT-116细胞+31.25 g/L肉豆蔻乙酸乙酯提取物组为A组,HCT-116细胞+62.5 g/L肉豆蔻乙酸乙酯提取物组组为B组,HCT-116细胞+125 g/L肉豆蔻乙酸乙酯提取物组为C组,HCT-116细胞+250g/L肉豆蔻乙酸乙酯提取物组为D组,HCT-116细胞+500g/L肉豆蔻乙酸乙酯提取物组为E组。
1.4.1 细胞培养 采用RPMI 1640培养基(含10%胎牛血清、青霉素、链霉素各100IU/mL)于5% CO2、37 ℃饱和湿度培养箱中培养人结肠癌HCT-116细胞。
1.4.2 肉豆蔻乙酸乙酯提取物的制备 取肉豆蔻饮片,粉碎后加8倍体积的乙酸乙酯,回流提取2 h,重复2次,过滤后真空旋转蒸发干燥即得肉豆蔻乙酸乙酯提取物。实验前称取适量乙酸乙酯提物干粉,经超声使其充分溶解于RPMI1640培养基后,使用0.22 μm滤器过滤并配制成所需浓度的溶液,-20℃保存备用。
1.4.3 MTT法检测HCT-116细胞增殖情况 取对数生长期人结肠癌HCT-116细胞,调整细胞浓度至1×108L-1,每孔100μL接种至96孔细胞培养板中,在5% CO2、37 ℃饱和湿度培养箱中培养,培养24 h后,弃去培养液,将配制好的不同浓度的沙棘肉豆蔻乙酸乙酯提取物培养液分别加入96孔板,每种浓度设5个复孔。培养24 h后,每孔加入MTT 20μL(5 g/L),培养4 h后弃上清液,加入150μL DMSO,震荡混匀充分溶解后,于490nm波长酶标仪检测吸光度OD值。计算细胞的存活率、抑制率。计算公式:细胞生长增殖率=实验组OD平均值/对照组OD平均值×100%;抑制率=(1-实验组OD平均值/对照组OD平均值)×100%。根据各浓度抑制率,采用Graphpad Prism 5软件提供IC50计算模型计算IC50。以上实验重复3次,求出3次实验的各浓度的抑制率与IC50,取平均值作为最终结果。
1.4.4 流式细胞术检测HCT-116细胞凋亡情况 取对数生长期的HCT-116细胞,调整细胞浓度为1×108L-1,加药后置于5% CO2、37 ℃培养箱培养24 h,收集细胞,预冷的PBS洗2次,每管用1×binding buffer将细胞调整成1×109L-1浓度,每管取100μL,加入5 μL的PE Annexin V溶液进行染色,混匀后,再加入5 μL的7-AAD溶液染色,双染后在室温避光静止15 min后,每管再加入1×binding buffer 400μL,流式细胞仪进行检测。
1.4.5 流式细胞术检测HCT-116细胞周期变化 取对数生长期的HCT-116细胞,加药后置于5% CO2、37 ℃饱和湿度培养箱中培养24 h,收集细胞,预冷后70%乙醇固定细胞,4 ℃过夜后PBS清洗2次,加入PI/RNase 0.5 mL置室温暗处孵育15 min。流式细胞仪进行细胞周期检测。
1.4.6 酶联免疫吸附法(ELISA)检测HCT-116细胞分泌E-cadherin、MMP-2及MMP-9情况 根据ELISA试剂盒说明书检测HCT-116细胞培养液中E-cadherin、MMP-2及MMP-9水平。显色后用酶标仪读OD值,建立标准曲线,根据标准曲线换算出检测指标的真实含量。
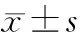
2 结 果
2.1HCT-116细胞增殖情况 经肉豆蔻乙酸乙酯提取物处理24 h后,HCT-116细胞的生长明显受到抑制:A组抑制率为(38.7±0.2)%,B组抑制率为(49.7±4.3)%,C组抑制率为(78.6±9.6)%,D组抑制率为(92.4±9.3)%,E组抑制率为(95.5±2.4)%,随着药物浓度的增加,抑制率逐渐升高。由公式计算可得肉豆蔻乙酸乙酯提取物对HCT-116细胞作用24 h的IC50为37.36 g/L。
2.2 HCT-116细胞凋亡情况 处理HCT-116细胞24 h后,A组、B组、C组、D组、E组HCT-116细胞凋亡数目的百分比逐渐增高,且呈剂量依赖性。经方差分析,各浓度组间比较差异有统计学意义(P<0.05)。见表1及图1~6。
2.3 HCT-116细胞周期变化 与对照组相比,A组、B组、C组、D组、E组G0/G1期的细胞比例明显增加(P均<0.01),S、G2/M期的细胞比例明显减少(P均<0.01),且呈剂量依赖性。经方差分析,各浓度组间比较差异有统计学意义(P<0.05)。见表2。
2.4 HCT-116细胞分泌E-cadherin、MMP-2及MMP-9情况 与对照组相比,A组、B组、C组、D组、E组E-cadherin水平明显升高,MMP-2及MMP-9水平均明显降低,且呈剂量依赖性。经方差分析,各浓度组间比较差异有统计学意义(P<0.05)。见表3。
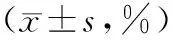
表1 各组HCT-116细胞凋亡情况
注:①与对照组比较,P<0.01。

图1 对照组HCT-116细胞凋亡情况

图2 A组HCT-116细胞凋亡情况

图3 B组HCT-116细胞凋亡情况

图4 C组HCT-116细胞凋亡情况

图5 D组HCT-116细胞凋亡情况

图6 E组HCT-116细胞凋亡情况
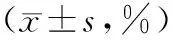
表2 各组HCT-116细胞周期比较
注:①与对照组比较,P<0.01。
3 讨 论
E-cadherin是与大肠癌侵袭转移较为密切的黏附分子,有抑制肿瘤浸润转移的功能,其通过加强细胞间黏附抑制细胞增殖而发挥抑癌功能,被认为是肿瘤浸润、转移的抑制基因[4],在维持组织器官正常形态结构方面起重要作用[5],其缺失使细胞间黏附受到破坏,肿瘤细胞因此易于脱离瘤体,导致肿瘤侵袭与转移[6-7]。E-cadherin在多种癌组织中呈现出表达不稳定或低表达性,并与肿瘤细胞的低分化相关[8-9]。

表3 各组HCT-116细胞分泌E-cadherin、MMP-2及MMP-9情况
注:①与对照组比较,P<0.01。
肿瘤的浸润和转移是一个复杂的过程:肿瘤细胞脱离原发灶后,肿瘤细胞分泌并释放各种蛋白水解酶,降解细胞外基质,使得基底膜被降解,肿瘤细胞向邻近的纤维结缔组织浸润进而向远处转移。基质金属蛋白酶(MMPs)是一类锌离子依赖的细胞外蛋白水解酶,可降解基底膜,促进恶性肿瘤细胞的侵袭和转移[10]。MMP-2是所有MMPs中分布最广的,当细胞恶变时,常有MMP-2的升高[11]。MMP-9是MMPs中分子量最大的酶,它以酶原形式分泌,激活后形成Ⅳ型胶原酶,一方面降解、破坏靠近肿瘤表面的细胞外基质和基底膜,使瘤细胞可沿着缺失的基底膜向周围组织浸润,促进肿瘤侵袭和转移;另一方面可通过毛细血管内生、肿瘤新生血管生成等促进肿瘤生长和扩散[12]。
本实验结果表明,肉豆蔻乙酸乙酯提取物可明显抑制人结肠癌HCT-116细胞增殖,且呈剂量依赖性。流式细胞检测显示药物干预各组凋亡细胞数显著增多,提示肉豆蔻乙酸乙酯提取物可能是通过凋亡途径抑制肠癌细胞的增殖。流式细胞检测也显示不同浓度的肉豆蔻乙酸乙酯提取物作用HCT-116细胞24 h后,细胞周期发生明显变化,随着肉豆蔻乙酸乙酯提取物浓度的提高,G0/G1期肿瘤细胞增加,G2/M期、S期肿瘤细胞减少,且呈剂量依赖性。提示肉豆蔻乙酸乙酯提取物能使细胞周期阻滞于G0/G1期。本实验进一步研究发现,肉豆蔻乙酸乙酯提取物可以上调人结肠癌HCT-116细胞E-cadherin的分泌,且同时能下调MMP-2、MMP-9的表达,且呈剂量依赖性,提示肉豆蔻乙酸乙酯提取物可能是通过上调E-cadherin的表达,下调MMP-2、MMP-9的表达而抑制HCT-116细胞侵袭转移。
综上所述,维药肉豆蔻乙酸乙酯提取物可以抑制人肠癌HCT-116细胞的生长,诱导凋亡,其可能是通过上调E-cadherin表达,下调MMP-2、MMP-9的表达抑制肿瘤转移,明确了维药肉豆蔻在人肠癌中的作用及具体机制,这有助于更深入认识维药肉豆蔻的功效,也为临床寻找有效的治疗靶点提供了依据。
[1] Tang XL,Yang XY,Kim YC,et al.Protective effects of the ethanolic extract of Melia toosendan fruit against colon cancer[J].Indian J Biochem Biophys,2012,49(3):173-181
[2] 陈竺.全国第三次死因回顾抽样调查报告[M].北京:中国协和医科大学出版社,2008:10
[3] 隋华,李琦.中药复方治疗大肠癌的临床研究进展[J].辽宁中医杂志,2009,36(7):1241-1242
[4] Aoki R,Yasuda M,Torisu R,et al.Relationship between lymph n-ode metastasis and E-cadherin expression in submucosal invasive gastric carcinomas with gastric-phenotype[J].Cancer Res,2009,69(5):159-167
[5] Wendt MK,Taylor MA,Schiemann BJ,et al.Down-regulation of epithelial cadherin is required to initiate metastatic outgrowth of breast cancer[J].Mol Biol Ce11,2011,22(14):2423-2435
[6] Tang B,Peng ZH,Yu PW,et al.Expression and significance of Cx43 and E-cadherin in gastric cancer and metastatic lymph node[J].Med Oncol,2011,28(2):502-508
[7] Corso G,Carvalho J,Marrelli D,et al.Somatic mutations and deletions of the E-cadherin gene predict poor survival of patients with gastric cancer[J].J Clinical Oncology,2013,31(7):868-875
[8] Uchikado Y,Okumura H,Ishigami S,et al.Increased Slug and decreased E-cadherin expression is related to poor prognosis in patients with gastric cance[J].Gastric Cancer,2011,14(1):41-49
[9] Pinheiro H,Carvalho J,Oliveira P,et al.Transcription initiation arising from E-cadherin/ CDHI intron2:a novel protein isoform that increases gastric cancer cell invasion and angiogenesis[J].Human Molecular Genetics,2012,21(19):4253-4269
[10] Nair SA,Jagadeeshan S,Indu R,et al.How intact is the basement membrane? Role of MMPs[J].Adv Exp Med Biol,2012,749:215-232
[11] Howard EW,Crider BJ,Updike DL,et al.MMP-2 expression by fibroblasts is suppressed by the myofibroblast phenotype[J].Exp Cell Res,2012,318(13):1542-1553
[12] Yeh CB,Hsieh MJ,Hsieh YH,et al.Antimetastatic effects of norcantharidin on hepatocellular carcinoma by transcriptional inhibition of MMP-9 through modulation of NF-kB activity[J].PLoS One,2012,7(2):e31055
Inhibition of Uighur medicine Nutmeg's extraction on human colon cancer cell HCT-116
FAN Lei1, DENG Wanli1,2, ZHANG Hongping2, LYU Shuqin1,2
(1.Xinjiang Medical University, Urumchi 830000, Xinjiang, China; 2.The Fourth Affiliated Hospital of Xinjiang Medical University, Urumchi 830000, Xinjiang, China)
Objective It is to investigate the effects of Uighur medicine Nutmeg’s acetic ether extraction (NAEE) on the cell proliferation and metastasis of human colon cancer HCT-116 cells.Methods The human colon HCT-116 cells in logarithmic phase were selected and divided into 6 groups, the cells in group A, group B, group C, group D and group E were intervened with NAEE at the dose of 31.25, 62.5, 125, 250, 500g/L respectively.Cell proliferation of HCT-116 cells was evaluated by MMT assay, apoptosis and cell stage were evaluated by flow cytometry (FCM), and the expression of E-Cadherin, MMP-2 and MMP-9 were evaluated by Gelatin Zymography.Results Compared with that in control group, NAEE inhabited cell proliferation and induced cell apoptosis significantly in HCT-116 cells, and the apoptosis rate of HCT-116 increased with the increase of concentration of NAEE; Compared with that in control group,the proportion of cells in G0/G1phase obviously increased while that of the cells in G2/M phase decreased significantly, the expression level of E-cadherin was higher and the levels of MMP-2 were lower in every groups intervened with NAEE.Conclusion NAEE could inhibit cell proliferation significantly in HCT-116 cells, accelerate the HCT-116 cell apoptosis in dose-dependent manner.Action of anti-metastasis are taken based on up-regulation of E-cadherin and down-regulation of MMP-2 and MMP-9.
Nutmeg; HCT-116; cell apoptosis; E-cadherin; MMP-2; MMP-9
范磊,女,硕士研究生在读,研究方向为中医药防治肿瘤。
吕书勤,E-mail:lvshuqin@126.com
自治区科技支疆项目(2013911125)
10.3969/j.issn.1008-8849.2015.10.002
R-332
A
1008-8849(2015)10-1031-04
2014-11-30
