慢性心功能不全患者合并肾功能不全的高危因素分析
2015-02-07张迪李斌马淑梅
张迪,李斌,马淑梅
(中国医科大学附属盛京医院心内科,沈阳 110004)
·论著·
慢性心功能不全患者合并肾功能不全的高危因素分析
张迪,李斌,马淑梅
(中国医科大学附属盛京医院心内科,沈阳 110004)
目的探讨心肾综合征(CRS)的相关危险因素,为防治CRS提供参考依据。方法采用回顾性对照研究,选取269例慢性心功能不全患者,根据肾小球滤过率估计值(eGFR)分为2组,eGRF<60 mL/(min·1.73 m2)者为病例组(CRS组),eGRF≥60 mL/(min·1.73 m2)者为对照组,收集患者的一般资料及相关临床化验指标和辅助检查指标,采用多因素logistic回归分析慢性心功能不全合并肾功能不全的相关危险因素。结果慢性心功能不全患者发生CRS的患病率为26.39%。单因素分析结果显示,2组间年龄、体质量、高血压病史、糖尿病史差异有统计学意义(P<0.05)。CRS组尿酸、胱抑素C、血清尿素氮、脑钠肽、糖化血红蛋白、超敏C反应蛋白及左室舒张末内径较对照组明显升高;红细胞计数、血红蛋白、白蛋白及左室射血分数较对照组明显降低,差异有统计学意义(P<0.05)。多因素logistic回归分析表明,高龄、低体质量、高血压病史、糖尿病史、低白蛋白血症、高超敏C反应蛋白水平、高尿酸血症、高胱抑素C血症、低射血分数与CRS的发生独立相关。结论高龄、低体质量、高血压病史、糖尿病史、低白蛋白血症、高超敏C反应蛋白水平、高尿酸血症、高胱抑素C血症、低射血分数是心衰患者发生CRS的高危因素,且独立相关。早期识别及控制这些危险因素对CRS的防治具有重要意义。
慢性心功能不全;心肾综合征;危险因素
慢性心功能不全是大多数心脏疾病的终末期表现,其病死率接近于恶性肿瘤,是世界范围的公共卫生问题。临床中,心功能不全患者常合并肾功能不全。近期Ronco等[1]将这种心肾损害称为心肾综合征(cardiorenal syndrome,CRS),其发病机制复杂,至今尚未能完全阐述。尽管慢性心功能不全控制后肾功能可以在短时间内有所缓解,但由于CRS自身维持机制的存在,终末器官仍将持续受损,最后产生抗心衰药物的抵抗,此时CRS的处置将变得尤为棘手。目前认为CRS重在预防,本文回顾分析了我院慢性心功能不全住院患者发生CRS的危险因素,及早识别及控制相关危险因素对CRS的防治具有重要的临床意义。
1 材料与方法
1.1 研究对象
选取我院心内科2011年9月至2013年12月收治的269例慢性心功能不全患者为研究对象。其中慢性心功能不全合并肾功能不全患者为病例组(CRS组),慢性心功能不全、肾功能正常者为对照组。
1.2 诊断标准
所有研究对象均符合我国《慢性心力衰竭诊断治疗指南》标准,被诊断慢性心功能不全患者至少有一心衰的症状及体征。症状包括休息或劳累时气短、端坐呼吸,夜间阵发性呼吸困难、咳嗽、咳痰,或心衰的不典型症状(乏力、头晕);体征包括奔马律、双下肺野的湿罗音、颈静脉充盈、外周水肿、体质量增加,或放射线证据(包括肺水肿、叶间积水、心脏扩大)。
1.2.1 心功能分级标准:心功能分级采用美国纽约心脏病协会心功能分级标准。Ⅰ级:患者患有心脏病,但日常活动量不受限,一般活动不引起过度的乏力、心悸、呼吸困难或心绞痛。Ⅱ级:心脏病患者的体力活动受到轻度的限制,休息时无自觉症状,但一般体力活动下可出现疲乏、心悸、呼吸困难或心绞痛。Ⅲ级:心脏病患者体力活动明显受限,小于平时一般活动即引起上述的症状。Ⅳ级:心脏病患者不能从事任何体力活动。休息状态下出现心衰的症状,体力活动后加重。
1.2.2 CRS诊断标准:本研究采用目前应用比较多的CRS诊断标准,心力衰竭患者出现肾功能异常,即肾小球滤过率估计值(estimated glomerular filtration rate,eGFR)<60 mL/(min·1.73 m2),eGFR=(140-年龄)×体质量(kg)/72×Scr(mg/dL),女性患者×0.85。
1.3 排除标准
(1)危重患者,入院时有血流动力学障碍者(血压<90/60 mmHg);(2)合并全身系统性疾病如狼疮、风湿性疾病、结核等;(3)恶性肿瘤患者,包括接受化学治疗病情改善者;(4)既往有原发性肾脏疾病病史及规律透析者;(5)病史、资料不全者。
1.4 研究方法
收集患者一般资料及病史,包括年龄、性别、吸烟、饮酒、冠脉造影或冠脉支架植入术史及高血压、糖尿病、脑血管疾病病史;评价入院时心功能分级,记录患者体质量;化验指标包括白细胞计数、红细胞计数、血红蛋白、谷丙转氨酶、谷草转氨酶、血清白蛋白、超敏C反应蛋白、糖化血红蛋白、肌钙蛋白Ⅰ、胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白、脑钠肽、血清尿素氮、胱抑素C及尿酸等,记录患者入院时血清肌酐水平;辅助检查包括心脏超声左室舒张末内径、左室射血分数等。
1.5 统计学方法
所有数据采用SPSS 19.0进行处理。计量资料符合正态分布者用表示,2组间比较采用t检验;偏态分布计量资料用中位数(最小值,最大值)表示,非连续性变量采用秩和检验;计数资料采用χ2检验。分析危险因素时将预后按二分类变量表示,采用logistic回归筛选发生CRS的危险因素,采用条件向前法进行自变量筛选,危险因素筛选条件以P<0.05为纳入标准,P>0.1为排除标准。取双侧P<0.05为差异有统计学意义。
2 结果
2.1 一般资料分析
本研究收集的269例心功能不全患者中,缺血性心肌病138例(51.30%),扩张型心肌病82例(30.48%),瓣膜病26例(9.67%),高血压性心肌病13例(4.83%),肺心病7例(2.60%),先心病3例(1.12%)。患者一般资料及病史见表1。
2.2 实验室生化指标及超声心动图相关指标分析
对2组生化或超声检查指标进行单因素分析,CRS组尿酸、胱抑素C、血清尿素氮、脑钠肽、糖化血红蛋白、超敏C反应蛋白及心脏超声左室舒张末内径较对照组明显升高,红细胞计数、血红蛋白、白蛋白及左室射血分数较对照组明显降低,差异有统计学意义(P<0.05),2组间白细胞计数、谷丙转氨酶、谷草转氨酶、胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白、肌钙蛋白Ⅰ、血清游离三碘甲状腺原氨酸、血清游离甲状腺素、促甲状腺激素均无统计学差异(P>0.05),见表2。
2.3 慢性心功能不全进展为CRS危险因素分析
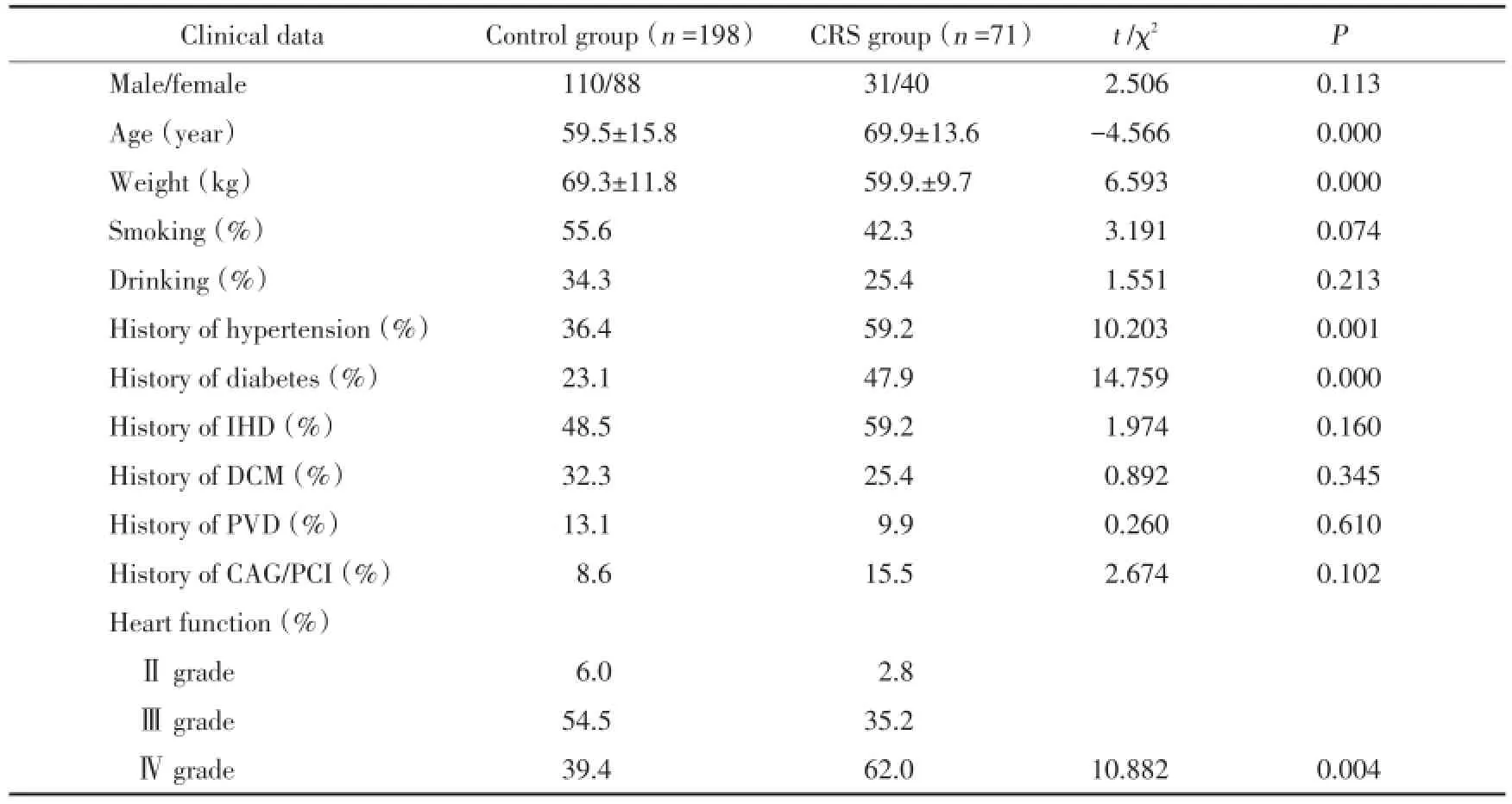
表1 患者一般资料及病史比较Tab.1 Comparison of the general information and medical history of subjects
将2组间单因素分析中具有统计学差异的危险因素纳入方程,引入水平0.05,剔除水平0.1,采用条件向前法,经二元logistic回归分析慢性心功能不全患者进展为CRS的高危因素。结果显示:低体质量,高龄,既往有高血压、糖尿病史,超敏C反应蛋白、尿酸及胱抑素C水平升高,低白蛋白血症,低射血分数是慢性心功能不全患者发展为CRS的独立危险因素,见表3。
3 讨论
近年来传统的慢性疾病如冠心病、高血压、糖尿病等日益增多,心功能不全发生率逐年增加,已然成为世界范围的公共卫生问题。随着心肾联系研究的不断深入,CRS逐渐引起医学界重视。CRS患者肾功能常呈进行性恶化,并出现药物治疗抵抗。且目前尚缺乏CRS诊断的金标准,其发病机制及治疗方法仍有争议。笔者认为CRS重在预防,因此本文回顾分析了慢性心功能不全患者并发肾功能不全的高危因素,具有重要的临床意义。
传统认为高血压、糖尿病、入院时已有肾功能不全、中重度以上心功能不全是心功能不全患者肾功能恶化公认的危险因素。本研究进一步发现CRS与高龄、低体质量、高血压病史、糖尿病史、低蛋白血症、高超敏C反应蛋白水平、高尿酸血症、高胱抑素C血症、低射血分数等相关。区别于传统的CRS危险因素,我们新发现低体质量、低白蛋白血症等易诱发CRS,现综合分析如下。
既往研究表明,“肥胖”是慢性肾脏病及终末期肾病强烈的预测因子[2]。本研究新发现低体质量心衰患者亦容易并发CRS且独立相关:低体质量心衰患者活动常伴有活动量减少、活动耐力下降、不经意间的过度劳累及虚弱等,这些均增加慢性肾脏病的发病风险[3]。近期研究发现,低体质量透析患者死亡率明显升高[4],增加了本研究的可信度。
随着年龄的增长,肾脏的浓缩及排水功能逐渐下降。正常情况下,高龄人群肾小球硬化率可达10%~30%。再者,老年患者常伴有动脉粥样硬化,肾单位继发性缺血将导致肾功能进行性恶化。现已证实高龄是肾功能不全发生的高危因素。本研究结果与前人一致,高龄与CRS的发生呈独立相关。
糖尿病属于传统的CRS危险因素,关于其引起肾损伤的机制目前已被广泛研究。高血糖状态、氧化应激等刺激肾脏表达一系列生长因子包括纤维生长转化因子β及血管内皮生长因子等。另外糖基化终末产物、游离脂肪酸、脂质代谢紊乱等加速了动脉粥样硬化的进程,逐渐累积肾脏各级血管。本研究显示CRS组与对照组间糖尿病史及糖化血红蛋白水平差异显著,纳入回归方程,显示糖尿病病史与CRS的发生独立相关。
高血压是慢性心功能不全的常见病因,同时也是发生慢性肾脏病的危险因素。大部分终末期肾病患者均合并有高血压,轻中度高血压引起的肾损害进程缓慢,但恶性高血压进展迅速,常引起肾小管纤维样坏死,肾功能急剧恶化。本研究发现高血压病史与CRS的发生独立相关,与既往的研究相一致。

表2 患者生化检查及辅助检查资料比较Tab.2 Comparison of biochemical and accessory examination indices of subjects
越来越多的证据表明高尿酸血症在CRS的发生和发展中起着重要作用。高尿酸血水平可引起炎性反应、氧化应激、胰岛素抵抗、血糖紊乱、内皮功能障碍、肾小球高滤过及诱发蛋白尿等。另外尿酸还可形成微结晶,堵塞肾小管,直接影响肾功能。本研究发现,住院期间对照组与CRS组尿酸水平有统计学差异,并且与CRS的发生独立相关,提示我们痛风患者住院期间应进行肾功能动态监测,防止CRS的发生。
已有实验表明,心功能不全患者血清中TNF-α明显升高[5],提示炎性反应在心功能不全患者的发生和发展中起着关键作用。Lennart等[6]明确指出炎性反应可诱发氧化氮-活性氧簇失衡、过度激活RAAS及交感神经系统,四者形成恶性循环,使心、肾功能持续恶化。超敏C反应蛋白是急性时相反应蛋白,作为一种促炎细胞因子,其在CRS中的作用近年来受到格外关注。研究表明血清高水平超敏C反应蛋白往往加重肾小管损伤[7]。本研究提示,超敏C反应蛋白明显升高者更易发生CRS,并且独立相关,与既往的研究相一致。
胱抑素C是体内有核细胞产生的半胱氨酸酶抑制剂,可以通过肾小球,并被肾小管重吸收,其在血清中的浓度并不受年龄、性别、种族及激素治疗、感染、肝脏疾病及炎症等多种因素的影响。研究发现,急性肾损伤患者血清胱抑素C浓度升高明显早于血清肌酐[8],是早期肾功能损害的敏感及特异性指标。另外,胱抑素C已被证实是心衰及心血管疾病病死率的危险因素。本研究发现,住院期间胱抑素水平明显升高者更易发生CRS,并且独立相关,与大多数研究一致。
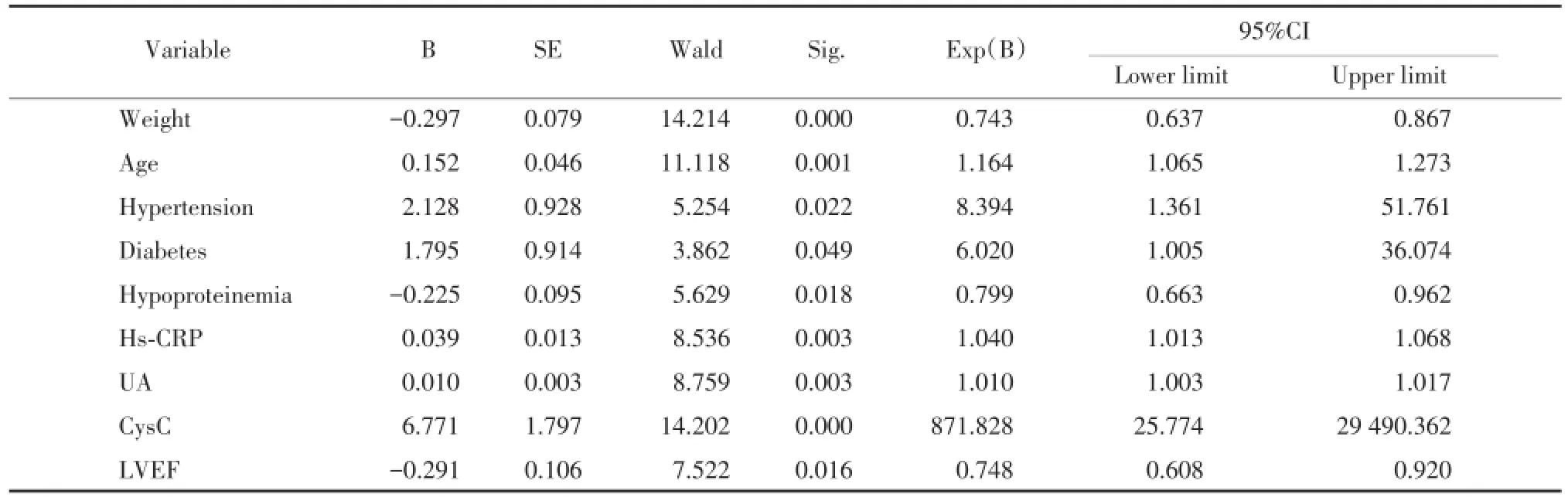
表3 慢性心功能不全进展为CRS危险因素多因素分析Tab.3 The multivariate analysis of the risk factors of the chronic heart failure patients with CRS
低蛋白血症在CRS发病的过程中常被忽略,极少有研究提及低蛋白血症在CRS中的作用。研究表明,白蛋白能够增加肾小管细胞培养的成活率,而且这种作用并不依赖于其胶体渗透压的维持,这可能与白蛋白具有清除氧自由基,防止应激损伤及结合溶血磷脂酸等有关[9,10]。鉴于白蛋白的肾脏保护作用,临床中我们应格外关注低白蛋白血症的心衰患者,警惕CRS的发生。
综上所述,CRS的防治策略基于对危险因素的控制,防止随后的终末器官损害。对于肾功能正常的心衰患者,控制传统的危险因素包括高血压、糖尿病、心功能等能够明显地减少CRS的发病率。本研究提示低体质量、高龄、既往有高血压、糖尿病史、低白蛋白血症,超敏C反应蛋白、尿酸及胱抑素C水平升高是慢性心功能不全患者进展为CRS的独立危险因素,早期识别及控制这些危险因素对CRS的防治及预后具有重要意义。
[1]Ronco C,Haapio M,House AA,et al.Cardiorenal syndrome[J].J Am Coll Cardiol,2008,52(19):1527-1539.
[2]Sowers JR,Whaley-Connell A,Hayden MR.The role of overweight and obesity in the cardiorenal syndrome[J].Cardiorenal Med,2011,1(1):5-12.
[3]Stengel B,Tarver-Carr ME,Powe NR,et al.Lifestyle factors,obesity and the risk of chronic kidney disease[J].Epidemiology,2003,14(4):479-487.
[4]Kim YK,Kim SH,Kim HW,et al.The association between body mass index and mortality on dialysis:a prospective cohort study[J]. Perit Dial Int,2014,34(4):383-389.
[5]李玉宏,富维强,张东旭,等.慢性心力衰竭患者单核细胞分泌TNF-α变化及开博通对其影响的研究[J].中国医科大学学报,2003,32(6):547-548.
[6]Buglioni A,Burnett JC.Pathophysiology and the cardiorenal connection in heart failure.Circulating hormones:biomarkers or mediators[J].Clin Chim Acta,2015,443:3-8.
[7]Otaki Y,Watanabe T,Takahashi H,et al.Association of renal tubular damage with cardio-renal anemia syndrome in patients with heart failure[J].Int J Cardiol,2014,173(2):222-228.
[8]Zappitelli M,Greenberg JH,Coca SG,et al.Association of definition of acute kidney injury by cystatin C rise with biomarkers and clinical outcomes in children undergoing cardiac surgery[J].JAMA Pediatr,2015,169(6):583-591.
[9]Levine JS,Koh JS,Triaca V,et al.Lysophosphatidic acid:a novel growth and survival factor for renal proximal tubular cells[J].Am J Physiol,1997,273(4 pt 2):F575-F585.
[10]Iglesias J,Abernethy VE,Wang Z,et al.Albumin is a major serum survival factor for renal tubular cells and macrophages through scavenging of ROS[J].Am J Physiol,1999,277(5 pt 2):F711-F722.
(编辑 陈 姜)
Analysisof Risk Factorsfor Chronic RenalInsufficiency in the Patientswith Chronic HeartFailure
ZHANGDi,LIBin,MA Shu-mei
(DepartmentofCardiology,Shengjing Hospital,China MedicalUniversity,Shenyang 110004,China)
ObjectiveTo elucidate the related risk factors for the cardiorenal syndrome(CRS),and to provide a reference for the prevention and treatment of CRS.MethodsA retrospective study was conducted on 269 patients with chronic heart failure.The subjects were divided into two groups in accordance with estimated glomerular filtration rate(eGFR):patient group(CRS group),eGRF<60 mL/(min·1.73 m2)and control group,eGRF≥60 mL/(min·1.73 m2).The patients’general information as well as the related clinical lab indices and accessory examination indices were collected.The risk factors for chronic heart failure and renal insufficiency were analyzed with multivariate logistic regression analysis.ResultsThe prevalence of chronic heart failure patients suffering from CRS was 26.39%.The single factor analysis showed that there were statistically significantdifferences between the two groups in terms ofage,body weight,history ofhypertension,and history ofdiabetes(all P<0.05).Compared to the control group,uric acid,cystatin C,serum urea nitrogen,brain natriuretic peptide,glycosylated hemoglobin,high-sensitivity C-reactive protein,and left ventricular end-diastolic diameter in the CRS group were significantly higher;white blood cell count,hemoglobin,albumin,and left ventricular ejection fraction were significantly lower(all P<0.05).There was no statistically significant difference(P>0.05)between the two groups in regard to white blood cell count,glutamic-pyruvic transaminase,glutamic oxalacetic transaminase,cholesterol,triglycerides,high density lipoprotein,low density lipoprotein,troponin I,serum free triiodothyronine,serum free thyroxine,or thyroid stimulating hormone.Multivariate logistic regression analysisshowed thatolderage,low body weight,history ofhypertension,history ofdiabetes,hypoalbuminemia,superb sensitivity C-reactive protein levels,high uric acid,high cystatin C hyperlipidemia,and low ejection fraction were independently associated with the occurrence of CRS.ConclusionOlder age,low body weight,history of hypertension,history of diabetes,hypoalbuminemia,high-sensitivity C-reactive protein levels,high uric acid,high cystatin C hyperlipidemia,and low ejection fraction are the high risk factorsforCRS in heartfailure patientsand are independently associated with the occurrence ofCRS.Early identification and controlofthese risk factors are importantforthe prevention and treatmentof CRS.
chronic heart failure;cardiorenal syndrome;risk factors
R54
A
0258-4646(2015)08-0725-05
张迪(1987-),女,医师,硕士.
马淑梅,E-mail:masm@sj-hospital.org
2015-01-06
网络出版时间:
