赤星病胁迫对不同抗性烟草品种光合作用和叶绿素荧光特性的影响
2015-02-06杨志晓丁燕芳张小全任学良任周营杨铁钊
杨志晓, 丁燕芳, 张小全, 薛 刚, 王 轶, 任学良, 任周营, 杨铁钊,*
1 河南农业大学烟草学院, 郑州 450002 2 贵州省烟草科学研究院, 烟草行业烟草分子遗传重点实验室, 贵阳 550081 3 河南省农业科学院烟草研究所, 许昌 461000 4 江西中烟工业公司, 南昌 330096
赤星病胁迫对不同抗性烟草品种光合作用和叶绿素荧光特性的影响
杨志晓1, 2, 丁燕芳3, 张小全1, 薛 刚1, 王 轶2, 任学良2, 任周营4, 杨铁钊1,*
1 河南农业大学烟草学院, 郑州 450002 2 贵州省烟草科学研究院, 烟草行业烟草分子遗传重点实验室, 贵阳 550081 3 河南省农业科学院烟草研究所, 许昌 461000 4 江西中烟工业公司, 南昌 330096
以不同烟草赤星病抗性品种JYH(抗病品种)和CBH(感病品种)为材料,在盆栽试验条件下,调查不同烟草赤星病胁迫程度(轻度胁迫、中度胁迫和重度胁迫)对光合色素含量、光合作用参数和叶绿素荧光动力学特征的影响。结果显示:1)烟草赤星病胁迫导致2个品种的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量均呈下降趋势,且JYH的降幅小于CBH。2)除JYH的净光合速率在轻度胁迫下有所增加外,JYH、CBH的净光合速率、气孔导度因烟草赤星病胁迫而降低。2个品种的胞间CO2浓度、气孔限制值变化具有明显差异,烟草赤星病胁迫导致CBH的胞间CO2浓度上升,气孔限制值则明显下降,这与JYH在重度胁迫下的变化趋势一致。而JYH的胞间CO2浓度在轻度、中度胁迫降低,气孔限制值则呈上升趋势。3)烟草赤星病胁迫下,2个品种的初始荧光(F0)、非光化学猝灭系数(NPQ)均有所增加。重度胁迫下,JYH、CBH的F0分别比对照增加16.5%、34.48%,NPQ分别上升95.54%、137.45%,差异均达到显著水平。而各品种的最大荧光(Fm)、可变荧光(Fv)、PSⅡ最大光化学效率(Fv/Fm)、PSⅡ潜在活性(Fv/F0)、光化学淬灭系数(qp)、PSⅡ实际光化学效率(ΦPSⅡ)在烟草赤星病胁迫下均呈下降趋势,降幅表现为JYH 烟草; 烟草赤星病; 光合色素; 光合特性; 叶绿素荧光参数 烟草赤星病[Alternariaalternata]是中国烟叶生产中的主要病害之一,属于真菌性病害。该病具有潜育期短、流行速度快的特点,烟株现蕾后至成熟期为易感病阶段;在环境条件适宜的情况下,短时间内即可大面积发生流行。烟草赤星病主要侵染叶片,严重时还会危害茎杆、花梗和蒴果,严重影响烟叶产量和品质,不利于优质烟叶生产,但至今尚无有效的防治手段[1- 3]。因此,深入研究烟草赤星病的致病机理,选育抗性较好的优质烟草品种是目前烟叶生产中亟待解决的问题。而现阶段关于烟草赤星病致病机理的研究报道较少,主要集中在感病组织形态结构的描述上。Lioyd[4]认为细嫩组织细胞壁较厚是烟株苗期较抗赤星病的原因之一。Stavely[5]对病叶组织的显微观察发现,烟叶组织在侵染点周围形成瘢痕层,阻止菌丝胞间伸长,病斑扩展受阻。 光合作用是最重要的基础生理活动,为植物生长发育提供所需的物质和能量,是决定产量和品质的主要因素。一些研究发现,病原菌侵染能够引起光合作用的改变,导致光合速率明显下降,叶绿体结构受到破坏,叶绿素含量降低,光合电子传递活力减弱,光合磷酸化作用受抑[6- 7]。相关研究结果显示,病原菌抑制光合作用可能是由气孔导度下降引起的[8]。而同时大量报道又表明,光合电子放氧复合体活性降低、PSⅠ和PSⅡ电子传递速率下降等非气孔限制因素也对其有着重要影响[9- 10]。因此,病原菌胁迫如何影响植株内部的生理活性进而抑制光合作用始终是抗病育种研究的重点。 在正常情况下,叶绿体吸收的光能主要通过光合电子传递、叶绿素荧光和热耗散3种途径散失,这3种途径存在此消彼长的关系,因此叶绿素荧光的变化可以直接反映植物光合系统对光能的吸收和利用情况,病原菌侵染对光合机构的影响也可通过它体现出来[11- 12]。目前,关于外界逆境对光合作用和叶绿素荧光特性的影响主要集中在玉米、大豆等作物上[13- 14],而关于烟草赤星病侵染对烟草叶片光合作用和荧光特性的影响研究较少。因此,本文以2个不同烟草赤星病抗性品种为材料,从光合色素含量、光合作用参数以及叶绿素荧光动力学特征入手,探讨不同烟草赤星病胁迫程度对光合作用和叶绿素荧光特性的影响,旨在揭示烟草赤星病胁迫与光合作用及相关指标之间的关系,以期为抗烟草赤星病新品种选育提供理论依据和参考指标。 1.1 供试材料 供试烟草(NicotianatabacumL.)品种为抗病品种JYH、感病品种CBH[15- 16]。采用漂浮育苗方式进行育苗,挑选生长整齐一致的壮苗(6叶1心)进行盆栽种植,行株距为120 cm50 cm,每盆植烟1株。每盆装土10 kg,供试土壤为壤质潮土(有机质8.50 g/kg、全氮0.89 g/kg、速效氮65.46 mg/kg、速效磷24.42 mg/kg、速效钾108.00 mg/kg,pH值 7.91)。每盆烟株N、P2O5、K2O的施入量分别为0.13、0.13、0.39 g/kg,肥料分3次施入,施入时间分别为移栽当天、移栽后第一周和第二周,肥量比例为2∶1∶1。烟株进入现蕾期进行打顶,每株留叶数均为18片叶,其他管理措施均按照优质烟叶生产技术规程进行。试验设3次重复,每个品种每次重复种植50盆。 以致病力较强的烟草赤星病菌种GM831为供试菌株。将供试菌株在PDA平板上25 ℃培养7 d,待充分产孢后,加1%无菌葡萄糖溶液10 mL浸泡15 min,用无菌棉签洗下孢子和菌丝体,经4层无菌纱布过滤,除去菌丝体,再用1%无菌葡萄糖溶液配成孢子悬浮液(浓度为1.0×105个/mL)待用。 1.2 试验设计及取样 当下部烟叶变黄成熟时(移栽后60 d),开始进行烟草赤星病菌接种。将孢子悬浮液以悬滴法接种于烟株的第3、4叶位叶片(自下而上数,下同),均等距离每叶点12滴,每滴为25 μL,以1%无菌葡萄糖溶液处理为对照[17]。根据在品种、温度和菌株组成一定的条件下,叶面湿润时数与烟草赤星病侵染概率呈线性关系这一研究结论[18],将烟株接种后在人工气候室中25 ℃分别保湿24、96和168 h,9 d后统计发病情况。根据张明厚的分级标准[19],调查发病情况,计算发病率和病情指数。根据病情指数,把叶片分为正常生长(CK,病情指数0,无病症)、轻度胁迫(病情指数25%)、中度胁迫(病情指数50%)和重度胁迫(病情指数75%)。选取第10叶位叶片进行各项指标测定。 1.3 试验测定指标及方法1.3.1 光合色素含量 采用Arnon[20]的方法测定,结果以mg/gFW表示。每处理重复3次。 1.3.2 光合作用气体交换参数 在晴天9:30—11:30,采用LI- 6400便携式光合仪(Li-Cor Inc.,USA)测定净光合速率(Pn,μmol CO2m-2s-1),气孔导度(Gs, mmol m-2s-1),胞间CO2浓度(Ci, μmol/mol),气孔限制值(Ls)根据Berry[21]的方法计算(Ls=1-Ci/C0)(C0为空气中CO2浓度)。测定时选择红蓝光源叶室,使用开放式气路,叶室温度设定为25 ℃,空气相对湿度为60%—70%,CO2浓度为400 μmol/mol,光照强度为1000 μmol m-2s-1,光量子通量密度800 mol m-2s-1。每株测1片叶, 每处理重复5次,取平均值。 1.3.3 叶绿素荧光动力学参数 选择晴天9:30—11:30利用FMS- 2脉冲调制式荧光仪(Hansatech, UK), 以叶脉为轴的对称点测量叶绿素荧光参数。叶片经暗适应30 min后用弱测量光测定初始荧光(F0),然后给一个强闪光(5000 μmol m-2s-1),脉冲时间0.7 s,测得最大荧光(Fm)。然后在自然光下适应20 min后,当荧光基本稳定时测得叶片实际生长光强下的荧光值(Fs)。再给一个强闪光(5000 μmol m-2s-1),脉冲时间0.7 s,荧光上升到最大荧光(Fm′)。关闭作用光后,立即打开远红光,5 s后测最小荧光(F0′)。参照Demming-Adams[22]的方法计算可变荧光Fv、PSⅡ最大光化学效率Fv/Fm、PSⅡ潜在活性Fv/F0、PSⅡ实际光化学效率ΦPSⅡ、光化学淬灭系数qp和非光化学猝灭系数NPQ。其中Fv=Fm-F0,Fv/Fm=(Fm-F0)/Fm,ΦPSⅡ=(Fm′-Fs)/Fm′,qp=(Fm′-Fs)/(Fm′-F0′),NPQ=(Fm-Fm′)/Fm′。每株测1片叶,每处理重复5次,取平均值。 1.4 数据处理 采用Microsoft Excel 2010和SPSS 16.0软件进行统计分析,采用Duncan′s新复极差法检验显著性,结果用平均值±标准差表示。 2.1 烟草赤星病胁迫对不同抗性烟草品种光合色素含量的影响 如表1所示,烟草赤星病侵染导致CBH的叶绿素和类胡萝卜素含量有所下降,不同胁迫程度处理与对照相比,均达到显著差异水平。在重度胁迫下,CBH的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素较对照分别下降43.92%、22.81%、38.07%和71.92%。而JYH的叶绿素和类胡萝卜素含量在轻度胁迫下呈上升趋势,叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量较对照分别上升1.51%、1.26%、2.35%和1.59%,但无显著差异;此后,随着胁迫程度的加剧,叶绿素和类胡萝卜素含量均下降,在重度胁迫下,叶绿素a、叶绿素b、总叶绿素和类胡萝卜素的降幅分别为15.07%、19.93%、16.91%和21.59%,与对照相比达到显著差异水平。 表1 烟草赤星病胁迫对不同抗性烟草品种光合色素含量的影响Table 1 Effects of tobacco brown spot stress on photosynthetic pigment contents of two tobacco cultivars with different resistance 2.2 烟草赤星病胁迫对不同抗性烟草品种光合作用参数的影响 光合作用为植物提供所需的物质和能量,是植物生长发育的基础,光合作用参数的变化可以直接反映烟草赤星病侵染对烟株的伤害程度。 2.2.1 净光合速率(Pn) 从表2可以看出, CBH受到烟草赤星病侵染后,Pn呈下降趋势,而且随着胁迫程度的加剧,降幅也随之增加,重度胁迫下,CBH的Pn较对照下降31.41%,呈显著差异。在轻度胁迫下,JYH的Pn较对照有小幅上升,增幅为1.81%,但差异不显著,此后下降;重度胁迫下,降幅达到10.25%,与对照相比达到显著差异水平。 2.2.2 气孔导度(Gs) 烟草赤星病侵染使不同抗性品种Gs均呈下降趋势, CBH的降幅明显高于JYH(表2)。除轻度、中度胁迫使JYH的Gs降幅未达到显著差异外,JYH、CBH的Gs在烟草赤星病胁迫处理下与对照间均达到显著差异水平,重度胁迫下降幅分别为19.23%、48.94%。烟草赤星病胁迫引起Gs下降,导致光合作用所需的CO2向叶肉细胞的运输受阻,且CBH受阻程度更大。 2.2.3 胞间CO2浓度(Ci) 正常生长条件下,不同抗性品种的Ci相差不大。如表2所示,在轻度、中度胁迫下,JYH的Ci较对照降低2.64%、4.53%,但未达到显著差异水平, 说明经气孔扩散进入叶肉细胞的CO2浓度下降, 不能满足叶片进行正常光合作用的需要。而CBH则呈上升趋势,增幅为5.17%、9.58%,差异达到显著水平。此后,随着胁迫程度的增加,2个品种的Ci均升高。在重度胁迫下,JYH、CBH的Ci增幅分别为7.17%、15.13%,均达到显著差异水平。Ci升高, 表明叶肉细胞光合能力下降, 导致CO2过剩, 同时光合产物相应减少。 2.2.4 气孔限制值(Ls) 从表2可以看出,在轻度、中度胁迫下,JYH的Ls呈上升趋势,较对照分别升高10.71%、17.86%,但差异不显著;在重度胁迫下,Ls则呈下降趋势,与对照相比,降幅为39.39%,呈显著差异水平。而CBH在烟草赤星病侵染下,Ls均呈下降趋势,与对照相比,在轻度、中度和重度胁迫下分别降低22.86%、45.71%和65.71%,差异均达到显著水平。 表2 烟草赤星病胁迫对不同抗性烟草品种光合作用参数的影响Table 2 Effects of tobacco brown spot stress on photosynthetic parameters of two tobacco cultivars with different resistance 2.3 烟草赤星病胁迫对不同抗性品种叶绿素荧光动力学参数的影响 叶绿素荧光是光合作用变化的探针,通过对各种荧光动力学参数的分析可以获知有关光能利用途径的信息。 2.3.1 最大光化学效率 在正常生长及烟草赤星病胁迫下,CBH的F0均高于JYH(表3)。烟草赤星病侵染导致JYH、CBH的F0升高,且增幅随着胁迫程度的加剧而增大。与对照相比,轻度、中度和重度胁迫下,JYH的F0增幅分别为4.85%、9.71%和16.5%,在重度胁迫下达到显著差异水平。CBH分别为10.34%、16.38%和34.48%,与对照相比均达到显著差异水平。烟草赤星病导致F0增加,表明PSⅡ反应中心破坏或可逆失活。JYH增幅较小,显示其反应中心受破坏程度较低。 如表3所示,在烟草赤星病胁迫下,Fm、Fv均呈下降趋势。JYH的Fm、Fv在各处理间均未达到显著差异水平。而CBH的Fv除轻度胁迫处理与对照无显著差异外,其他处理间Fm、Fv均达到显著差异水平。重度胁迫下,JYH的Fm、Fv与对照相比,分别下降10.88%、13.66%,CBH降幅分别为45.37%、69.39%。JYH的Fm、Fv降幅较小,表明其在烟草赤星病胁迫下具有较高的PSⅡ光化学活性。 烟草赤星病胁迫使2个品种的Fv/F0均有所下降,且降幅随胁迫程度的上升而增加(表3)。与对照相比,轻度、中度和重度胁迫使JYH的Fv/F0分别减少8.54%、18.09%和25.63%,各处理间无显著差异。CBH的Fv/F0分别下降20.12%、47.74%和77%,与对照相比达到显著差异水平。Fv/F0下降,表明PSⅡ受到伤害,抑制光合作用原初反应过程,光合电子由PSⅡ反应中心向QA、QB及PQ库传递过程受到影响。 从表3可以看出,随着烟草赤星病胁迫程度的加剧,JYH、CBH的Fv/Fm均呈下降趋势,降幅表现为JYH 表3 烟草赤星病胁迫对不同抗性烟草品种叶绿素荧光参数的影响Table 3 Effects of tobacco brown spot stress on chlorophyll fluorescence kinetic parameters of two tobacco cultivars with different resistance 2.3.2 荧光猝灭动力学 正常生长条件下,JYH和CBH的qp相差不大。烟草赤星病侵染使2个品种的qp均有所下降,并且随着胁迫程度的增加,降幅越来越大(表4)。JYH的qp受烟草赤星病侵染影响小于CBH,只有重度胁迫处理与对照间达到显著差异水平。而CBH各处理间与对照相比,均达到显著差异水平。qP下降说明PSⅡ中的QA氧化态数量减少,导致PSⅡ反应中心开放部分比例降低,使QA向QB光合电子传递受到抑制。JYH的qP较高,表明在烟草赤星病胁迫下其QA重新氧化的能力较强,烟草赤星病对PSⅡ受体电子传递的破坏程度较轻,也显示出该品种在烟草赤星病胁迫下具有较强的电子传递活性和光氧化速率,从而保持较高的光合速率。 表4 烟草赤星病胁迫对不同抗性烟草品种qp,NPQ 和ФPSⅡ的影响 Table 4 Effects of tobacco brown spot stress on photochemical quenching coefficient (qp),non-photochemical quenching(NPQ)and PSⅡ actual quantum yield(ФPSⅡ)of two tobacco cultivars with different resistance 表内数据为平均值±标准差; 每列数据右侧字母相同者表示差异未达显著水平(P>0.05); 字母不同者表示差异达显著水平(P<0.05) 如表4所示,烟草赤星病胁迫下,JYH和CBH的NPQ均呈上升趋势。与对照相比,JYH的NPQ在轻度、中度和重度胁迫下分别较对照升高5.94%、41.58%和95.54%,在重度胁迫下与对照达到显著差异水平,CBH分别为16.73%、52.36%和137.45%,与对照相比均呈显著差异水平。NPQ上升说明PSⅡ反应中心耗散过剩光能的能力增强, CBH的NPQ增幅高于JYH,表明其吸收的光能通过热量形式耗散较多, 而JYH耗散较少, 光能转化率高。 从表4可以看出,随着烟草赤星病胁迫程度的增加,2个品种的ФPSⅡ均呈下降趋势, 但降幅不同。在轻度、中度胁迫下, JYH的ФPSⅡ与对照差异不显著, 而在重度胁迫处理下, 较对照降低16.92%,达到显著差异水平; 而CBH的ФPSⅡ在轻度、中度和重度胁迫处理下, 分别比对照降低26.93%、52.54%和77.48%,各处理间差异显著。 3.1 烟草赤星病胁迫对光合色素含量的影响 植物进行光合作用的能量主要来源于光合色素捕获的光能,所以光合色素含量的高低与光合功能密切相关[23]。光合色素中叶绿素a是光反应的中心色素分子, 而叶绿素b是捕光色素分子。类胡萝卜素一方面是光合色素,吸收光能并传递给反应中心, 参与光合作用;又是细胞内源抗氧化剂,能够吸收剩余光能, 淬灭活性氧, 防止细胞膜脂过氧化[24]。在本文中,不同抗性品种的叶绿素和类胡萝卜素含量在烟草赤星病侵染下均有所下降,说明烟草赤星病不仅使光合色素的合成受阻, 也可能促进光合色素的降解。其主要原因可能是烟草叶片感染赤星病后,导致叶绿素分解酶活性上升,使叶绿素转化为叶绿素酯和叶绿素醇,因此叶绿素含量降低[25];也有可能是烟草赤星病侵染破坏叶绿体结构和功能,导致叶绿素含量下降[8]。烟草赤星病侵染导致光合色素含量降低,在一定程度上减少烟株的有效光合面积,限制碳素同化能力,从而抑制光合作用。同时,由于类胡萝卜素含量下降,减弱对活性氧的猝灭,导致细胞内积累较多的活性氧自由基,破坏叶绿体膜结构,加速叶绿素降解,从而降低光合作用中光能的吸收和传递[26]。烟草赤星病胁迫下JYH的叶绿素和类胡萝卜素含量高于CBH,表明抗病品种的光能转换、吸收和传递能力较强,在烟草赤星病侵染下仍具有较高的光合速率,从而维持烟株体内光合碳素同化活动的正常进行。而感病品种光合色素含量大幅下降,光合作用减弱,使光合产物积累减少,碳素同化能力受到严重抑制,加速衰老死亡。 3.2 烟草赤星病胁迫对光合作用的影响 光合作用是植物生长的生理基础,反映植株的生长势和抗逆性[27]。导致光合速率降低的因素包括气孔限制和非气孔限制。气孔限制因素是由于气孔导度的降低导致Ci下降,使叶绿体内CO2运输受阻。非气孔因素则是由于叶肉细胞使气孔扩散的阻力增加、CO2溶解度下降、Rubisco酶对CO2的亲和力降低和RuBP再生能力下降或光合机构关键成分的稳定性因逆境胁迫而降低等原因所致[28- 29]。根据Farquhar和Sharkey[30]的气孔限制值分析观点,判定引起光合速率降低主要因素的依据是Ci和Ls的变化方向,Ci降低和Ls升高表明气孔导度降低是主要原因,而Ci增高和Ls降低则表明引起光合速率降低的主要原因是非气孔因素。 在本文中,JYH在轻度、中度胁迫下,Gs下降,Ls升高,同时伴随Ci降低, 导致Pn下降, 表明气孔导度导致CO2供应减少是引起Pn下降的主要原因,这是由于烟草赤星病侵染使叶片气孔收缩,气孔导度降低,引起CO2由外界向细胞内扩散的阻力增加,光合碳固定的底物减少[31]。此后,JYH的Pn、Gs在重度胁迫下均呈下降趋势,但Ci转向升高,Ls下降,这可能是由于随着胁迫程度的加剧,烟草赤星病胁迫破坏叶片光合机构,造成叶肉细胞气孔扩散阻力增加,Rubisco酶对CO2的亲和力降低,碳同化能力下降,说明此时非气孔限制已成为导致光合速率降低的主要因素。而CBH在烟草赤星病侵染下,随着Gs的下降,Ci上升和Ls降低,表明感病品种光合速率降低主要是由非气孔限制因素引起。这可能是由于烟草赤星病胁迫破坏叶绿体结构,光合器官受到不可逆伤害,光合细胞活性降低[32]。CBH的光合参数受烟草赤星病胁迫影响明显大于JYH,表现感病特性,而JYH在烟草赤星病胁迫下具有相对较高的光合速率和气孔开放度,表现出良好的抗病性。在轻度胁迫下,JYH的Pn有小幅上升,表明抗病品种通过提高净光合速率以抵抗烟草赤星病侵染,但当胁迫程度增强时,抗病品种的净光合速率最终还是受到影响。 3.3 烟草赤星病胁迫对叶绿素荧光特性的影响 叶绿素荧光特性常用于检测光合机构对环境胁迫的响应[33]。本文研究表明,烟草赤星病侵染导致Fm、Fv/F0和Fv/Fm下降,说明烟草叶片发生光抑制[34]。而同时F0上升,表明PSⅡ受到破坏[35],伤害部位可能位于PSⅡ氧化侧,或者PSⅡ反应中心,或者PSⅡ原初电子受体,也可能3个部位均受到伤害[36]。但也有研究表明Fv/Fm降低并不是PSⅡ反应中心发生不可逆转的失活或破坏,而是植物保护反应的结果[37]。JYH的F0增幅较小,显示烟草赤星病胁迫对抗病品种PSⅡ破坏程度较轻,光合色素吸收的能量仍主要进行光化学反应。不同抗性品种Fm降幅为10.88%—69.39%,表明烟草赤星病胁迫降低PSⅡ反应中心QA的氧化态数量。抗、感品种的Fv/F0和Fv/Fm均降低,表明烟草赤星病侵染阻碍光合电子传递,导致同化力(NADPH、ATP)的合成受阻,进而影响暗反应阶段CO2的固定与同化[38]。JYH在烟草赤星病胁迫下Fv/Fm、Fv/F0降幅较小,表明抗病品种可降低烟草赤星病侵染对PSⅡ活性中心的损伤,有利于维持PSⅡ较高的光化学活性和光合电子传递正常进行。而烟草赤星病胁迫导致感病品种的原初光能转换效率下降比例较大,潜在活性中心受损,严重抑制光合作用原初反应。 植物对光能的利用主要包括光化学反应转化光能、非光化学热能耗散和以叶绿素荧光形式耗散过剩的光能。光化学反应和热耗散的变化会引起叶绿素荧光猝灭过程的相应变化, 叶绿素荧光猝灭有光化学猝灭和非光化学猝灭两个过程, 光化学猝灭与PSⅡ电子传递和初始电子受体QA的氧化还原有关[39]。本研究结果表明,在烟草赤星病胁迫下,不同抗性品种的qP和ΦPSⅡ均有所下降,这进一步证实光合电子传递受到抑制, PSⅡ光能转换效率降低, 过剩激发能增加[40]。JYH的ΦPSⅡ和qP下降幅度较小, 说明抗病品种在烟草赤星病胁迫下光能捕获与转化能力仍然较强, 能够保持较高的光能利用效率和光合作用潜力,是其对烟草赤星病具有抗性的光合生理原因。NPQ是衡量过剩激发能耗散的指标[41], 烟草赤星病侵染后抗、感品种NPQ均不同程度的上升, 导致PSⅡ将过剩光能以热能形式耗散,以防止过剩光能对光合机构造成进一步伤害[42]。JYH的NPQ增幅小于CBH, 说明烟草赤星病胁迫下抗病品种热耗散较少, 碳同化能力和PSⅡ激发能利用效率较高。在相同胁迫程度下,感病品种叶绿素荧光动力学参数变化幅度明显高于抗病品种,说明烟草赤星病侵染导致其光合机构受损,原初电子受体遭到破坏,荧光产量减少,导致PSⅡ活性下降,光化学反应减弱,无法耗散过剩光能,从而使烟株受到光抑制和光破坏。而抗病品种各荧光参数降幅较小,可能是叶绿体未受损伤部分的光合能力仍较强,或是结合在光合膜上的一些作用中心色素或电子传递体的蛋白质复合体受损程度较轻,从而对光合电子传递速率影响较小,有效保护光合机构。 [1] Shew H D, Lucas G B. Compendium of Tobacco Disease. Saint Paul: American Phytopathological Society, 1991: 10- 12. [2] Shafik J, Taha K H. Chemical control of brown spot of tobacco in Northern Iraq. Indian Phytopathology, 1984, 37(4): 669- 672. [3] Lucas G B. Diseases of Tobacco (3rded). Raleigh N C: Harold E. Parker & Sons Printer, 1975: 267- 296. [4] Lloyd H L. Therapeutic effect of kinetin on tobacco Alternariosis. Nature: New Biology, 1972, 240(98): 94- 96. [5] Stavely J R, Main C E. Influence of temperature and other factors on initiation of tobacco brown spot. Phytopathology, 1970, 60: 1591- 1596. [6] Funayama S, Sonoike K, Terashima I. Photosynthetic properties of leaves of Eupatorium makinoi infected by a geminivirus. Photosynthesis Research, 1997, 53: 253- 261. [7] 王春梅, 施定基, 朱水芳, 田波, 魏宁生. 黄瓜花叶病毒对烟草叶片和叶绿体光合活性的影响. 植物学报, 2000, 42(4): 388- 392. [8] 郭兴启, 李向东, 朱汉城, 朱常香.马铃薯Y病毒(PVY)的侵染对烟草叶片光合作用的影响. 植物病理学报, 2000, 30(1): 94- 95. [9] Hao L M, Liang H G, Wang Z L, Kiu X M. Effects of water stress and rewatering on turnover and gene expression of photosystem Ⅱ reaction center polypeptide D1 inZeamays. Australian Journal of Plant Physiology, 1999, 26(4): 375- 378. [10] 李文瑞, 冯金朝, 江天然, 张立新, 刘新民. 沙冬青几种光合特性的季节性变化的研究. 植物学报, 1999, 41(2): 190- 193. [11] 付东亚, 洪健, 陈集双, 吴建祥. 芜菁花叶病毒外壳蛋白在寄主植物叶绿体中的积累及其对光系统Ⅱ活性的影响. 植物生理与分子学报, 2004, 34(1): 34- 40. [12] 沈喜, 李红玉, 贾秋珍, 冯汉青, 李敏权, 粱厚果. 条锈病对小麦(TriticumaestivumL.)叶片光合功能及光合功能蛋白D1表达的影响. 生态学报, 2008, 28(2): 669- 676. [13] 杜伟莉, 高杰, 胡富亮, 郭德林, 张改生, 张仁和, 薛吉全. 玉米叶片光合作用和渗透调节对干旱胁迫的响应. 作物学报, 2013, 39(3): 530- 536. [14] 郑有飞, 徐卫民, 吴荣军, 张金恩, 刘瑞娜, 姚摇娟, 胡会芳. 地表臭氧浓度增加和UV-B辐射增强及其复合处理对大豆光合特性的影响. 生态学报, 2012, 32(8): 2515- 2524. [15] 雷吕英, 李黎明. 烤烟品种和打顶时期对赤星病抗性的作用. 烟草科技, 2000, (11): 42- 43. [16] 郭永峰, 石金开, 孔凡玉, 王年, 王从丽, 何京美, 朱贤朝. 烟草赤星病抗性因素遗传的双列分析. 中国烟草科学, 2000, 21(4): 17- 20. [17] 董汉松,王智发. 烟草赤星病菌致病力测定方法的研究. 山东农业大学学报,1989, 4: 1- 8. [18] 刘学敏,陈宇飞,常稳,李大壮. 温度和叶面湿润时数对烟草赤星病菌侵染的影响.烟草科技,2002, (4): 46- 48. [19] 张明厚,张敬荣,贾文香,赵寅,马锐. 烟叶成熟衰老程度与对赤星病感病性的关系. 植物病理学报,1998, 28(1): 49- 54. [20] Arnon D I. Copper enzymes in isolated chloroplasts. polyphenoloxidase in Beta valgaris. Plant Physiology, 1949, 24(1): 1- 15. [21] Berry J, Bjorkman O. Photosynthetic response and adaptation to temperature in higher plants. Annual Review of Plant Physiology, 1980, 31: 491- 543. [22] Demmig-Adams B, Adams W W, Baker D H, Logan B A, Bowling D R, Verhoeven A S. Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation. Physiologia Plantarum, 1996, 98(2): 253- 264. [23] Li X G, Meng Q W, Jiang G Q, Zou Q. The susceptibility of cucumber and sweet pepper to chilling under low irradiance is related to energy dissipation and water-water cycle. Photosynthetica, 2003, 41(2): 259- 265. [24] Willekens H, Van Camp W, Van Montagu M, Inze D, Langebartels C, Sandermann Jr H. Ozone, sulfurd ioxide, and ultraviolet B have similar effects on mRNA accumulation of antioxidant genes inNicotianaplumbaginifoliaL. Plant Physiology, 1994, 106(3): 1007- 1014. [25] 李燕宏,洪健,谢礼,杨勇,周雪平,蒋德安. 蚕豆萎蔫病毒2号分离物侵染对蚕豆叶片光合活性和叶绿体超微结构的影响. 植物生理与分子生物学学报, 2006, 32(4): 490- 496. [26] Sakaki T, Kondo N, Sugahra K. Breakdown of photosynthetic pigment and lipids in spinach leaves with ozone fumigation: Role of active oxygen. Physiologia Plantarum, 1983, 59(1): 28- 34. [27] 许大全. 光合作用效率. 上海:上海科学技术出版社,2002: 821- 834. [28] Yang X H, Chen X Y, Ge Q Y, Li B, Tong Y P, Zhang A M, Li Z S, Kuang T Y, Lu C M. Tolerance of photosynthesis to photoinhibition, high temperature and drought stress in flag leaves of wheat: A comparison between a hybridization line and its parents grown under field conditions. Plant Science, 2006, 171(3): 389- 397. [29] 薛忠财, 高辉远, 柳洁. 野生大豆和栽培大豆光合机构对NaCl胁迫的不同响应. 生态学报, 2011, 31(11): 3101- 3109. [30] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33(1): 317- 345. [31] Lu C M, Qiu N W, Wang B S, Zhang J H. Salinity treatment shows no effects on photosystem Ⅱ photochemistry, but increases the resistance of photosystemⅡ to heat stess in halophyteSuaedasalsa. Journal of Experimental Botany, 2003, 54(383): 851- 860. [32] 李倩, 王明, 王雯雯, 张瑞昌, 岳明. 华山新麦草光合特性对干旱胁迫的响应. 生态学报, 2012, 32(13): 4278- 4284. [33] Wang P, Duan W, Takabayashi A, Endo T, Shikanai T, Ye J Y, Mi H L. Chloroplastic NAD(P)H dehydrogenase in tobacco leaves functions in alleviation of oxidative damage caused by temperature stress. Plant Physiology, 2006, 141(2): 465- 474. [34] Xu C C, Li D Q, Zou Q, Zhang J H. Effect of drought on chlorophyll fluorescence and xanthophyll cycle components in winter wheat leaves with different ages. Acta Phytophysiologica Sinica, 1999, 25(1): 29- 37. [35] Guo D P, Guo Y P, Zhao J P, Liu H, Peng Y, Wang Q M, Chen J S, Rao G Z. Photosynthesis rate and chlorophyll fluorescence in leaves of stem mustard (Brassicajunceavar. tsatsai) after turnip mosaic virus infection. Plant Science, 2005, 168(1): 57- 63. [36] 宋丽丽, 郭延平, 徐凯, 张亮诚. 温州蜜柑叶片光合作用光抑制的保护机理. 应用生态学报, 2003, 14(1): 47- 50. [37] Murata N, Takahashi S, Nishiyama Y, Allakhverdiev S I. Photoinhibition of photosystem Ⅱ under environmental stress. Biochimica et Biophysica Acta-Bioenergetics, 2007, 1767(6): 414- 421. [38] Parida A K, Das A B. Salt tolerance and salinity effects on plants: a review. Ecotoxicology and Environmental Safety, 2005, 60(3): 324- 349. [39] Degl′Innocentia E, Guidia L, Stevanovicb B, Navari F. CO2fixation and chlorophyll a fluorescence in leaves oframondaserbicaduring a dehydration-rehydration cycle. Journal of Plant Physiology, 2008, 165(7): 723- 733. [40] 刘建新, 王金成, 王鑫, 王瑞娟. 外源NO对NaHCO3胁迫下黑麦草幼苗光合生理响应的调节. 生态学报, 2012, 32(11): 3460- 3466. [41] Aroca R, Irigoyen J J, Sánchez-díaz M. Drought enhances maize chilling tolerance Ⅱ. photosynthetic traits and protective mechanisms against oxidative stress. Physiologia Plantarum, 2003, 117(4): 540- 549. [42] Efeogˇlua B, Ekmekçi Y, Çiçekb N. Physiological responses of three maize cultivars to drought stress and recovery. South African Journal of Botany, 2009, 75(1): 34- 42. Impacts ofAlternariaalternatastress on characteristics of photosynthesis and chlorophyll fluorescence in two tobacco cultivars with different resistances YANG Zhixiao1,2, DING Yanfang3, ZHANG Xiaoquan1, XUE Gang1, WANG Yi2, REN Xueliang2, REN Zhouying4, YANG Tiezhao1,* 1CollegeofTobaccoScience,HenanAgriculturalUniversity,Zhengzhou450002,China2KeyLaboratoryofMolecularGenetics,GuizhouAcademyofTobaccoScience,Guiyang550081,China3TobaccoResearchInstituteofHenanAcademyofAgriculturalSciences,Xuchang461000,China4ChinaTobaccoJiangxiProvincialIndustrialCompany,Nanchang330096,China Tobacco brown spot is one of the most serious diseases in tobacco production in China leading to enormous losses in yield and quality. It is necessary to select resistant tobacco cultivars to meet the demands for high quality tobacco production, but there have only been occasional reports on the pathogenesis of tobacco brown spot in the past. It is therefore very important to study the disease mechanism of tobacco brown spot in order to establish recommendations and a foundation for breeding resistant cultivars. The responses of photosynthetic pigment content, photosynthetic parameters and chlorophyll fluorescence kinetic characteristics were investigated under three different stress levels of tobacco brown spot (mild, moderate and severe stress) at maturity using pot cultures. Two tobacco cultivars with different resistances to tobacco brown spot were selected as experimental materials to determine whether there was a correlation between photosynthetic characteristics and resistance. The cultivars selected were JYH (resistant cultivar) and CBH (sensitive cultivar). The results showed that tobacco brown spot stress could decrease chlorophyll a, chlorophyll b, total chlorophyll and carotenoids in the two cultivars with different resistances. In addition, the decreased range of photosynthetic pigments was less in JYH than in CBH. Tobacco brown spot stress decreased both the net photosynthetic rate and stomatal conductance. However, the net photosynthetic rate of JYH increased under mild stress whereas there was a decrease under moderate and severe stress. In the two cultivars with different resistances, the changes in intercellular CO2concentration and stomatal conductance were divergent. The intercellular CO2concentration in CBH tended to rise under the three different tobacco brown spot stress levels, whereas the stomatal limitation value showed a significant decrease. In JYH under severe stress, the photosynthetic parameters consisting of both intercellular CO2concentration and stomatal conductance showed the same trend as in CBH. However, compared with the rising trend of intercellular CO2concentration under severe stress, the stomatal limitation value of JYH decreased under both mild and moderate stress. With the increasing levels of tobacco brown spot stress, the initial fluorescence (F0) and non-photochemical quenching (NPQ) of the two cultivars with different resistances both increased. Compared with controls (no stress), the increases inF0in JYH and CBH were 16.50% and 34.48%, respectively under severe stress, whereas NPQ increased by 95.54% and 137.45%, respectively, at the same time. For these two parameters, all the differences between severe stress and control conditions were significant for JYH and CBH. However, the chlorophyll fluorescence kinetic parameters including maximal fluorescence (Fm), variable fluorescence (Fv), maximal photochemical efficiency (Fv/Fm), PSⅡ potential efficiency (Fv/F0), photochemical quenching coefficient (qp) and PSⅡ actual quantum yield (ΦPSⅡ) for the two cultivars with different resistances all decreased by varying degrees under the three levels of tobacco brown spot stress, and the decreased range was less in JYH than in CBH. These results indicate that tobacco brown spot disease had a destructive effect on photosynthetic characteristics. The photosynthetic pigments, photosynthesis and chlorophyll fluorescence characteristics of JYH were less influenced by tobacco brown spot stress than CBH. So a higher photosynthetic performance may be a major physiological trait of resistant cultivars in the adaptability to tobacco brown spot infection. tobacco; tobacco brown spot; photosynthetic pigment; photosynthetic characteristics; chlorophyll fluorescence parameters 中国烟草总公司科技项目(110201002008, Ts- 01- 2011003); 贵州省烟草专卖局资助项目(中烟黔科〔2012〕11号); 河南省烟草专卖局科技攻关项目(hykj200817) 2013- 08- 21; 2014- 07- 02 10.5846/stxb201308212124 *通讯作者Corresponding author.E-mail: yangtiezhao@126.com 杨志晓, 丁燕芳, 张小全, 薛刚, 王轶, 任学良, 任周营, 杨铁钊.赤星病胁迫对不同抗性烟草品种光合作用和叶绿素荧光特性的影响.生态学报,2015,35(12):4146- 4154. Yang Z X, Ding Y F, Zhang X Q, Xue G, Wang Y, Ren X L, Ren Z Y, Yang T Z.Impacts ofAlternariaalternatastress on characteristics of photosynthesis and chlorophyll fluorescence in two tobacco cultivars with different resistances.Acta Ecologica Sinica,2015,35(12):4146- 4154.1 材料与方法
2 结果与分析
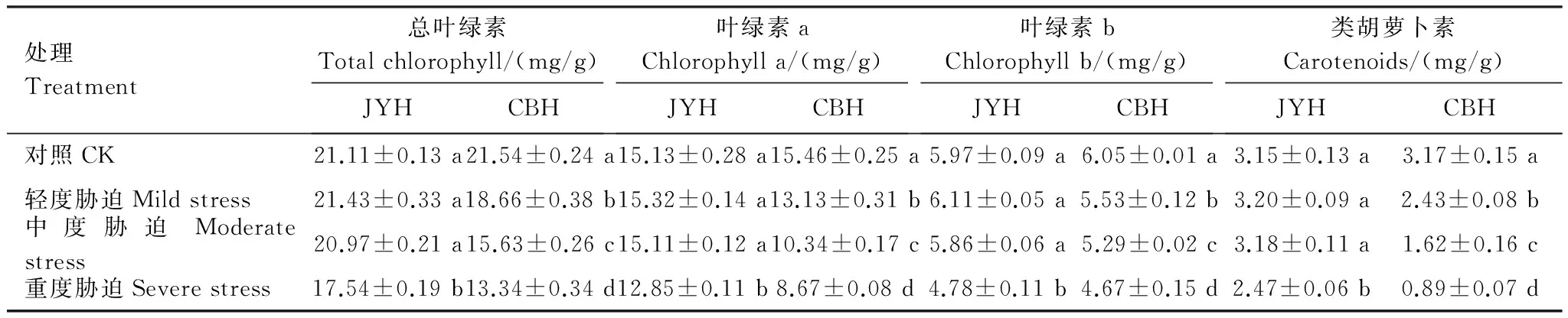
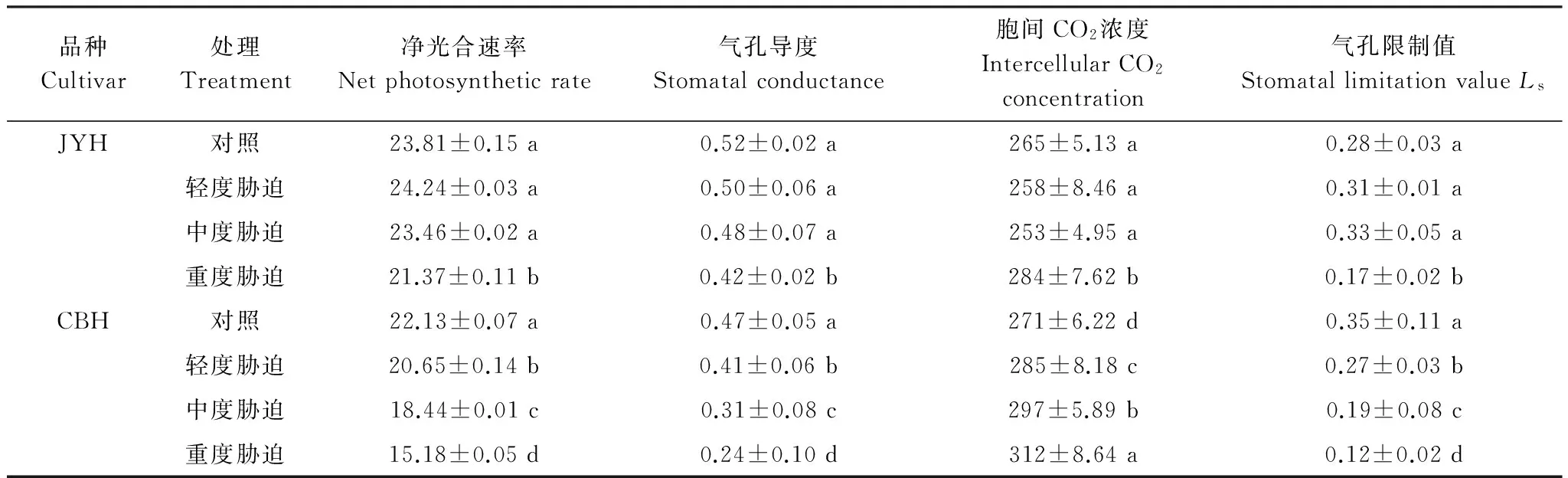
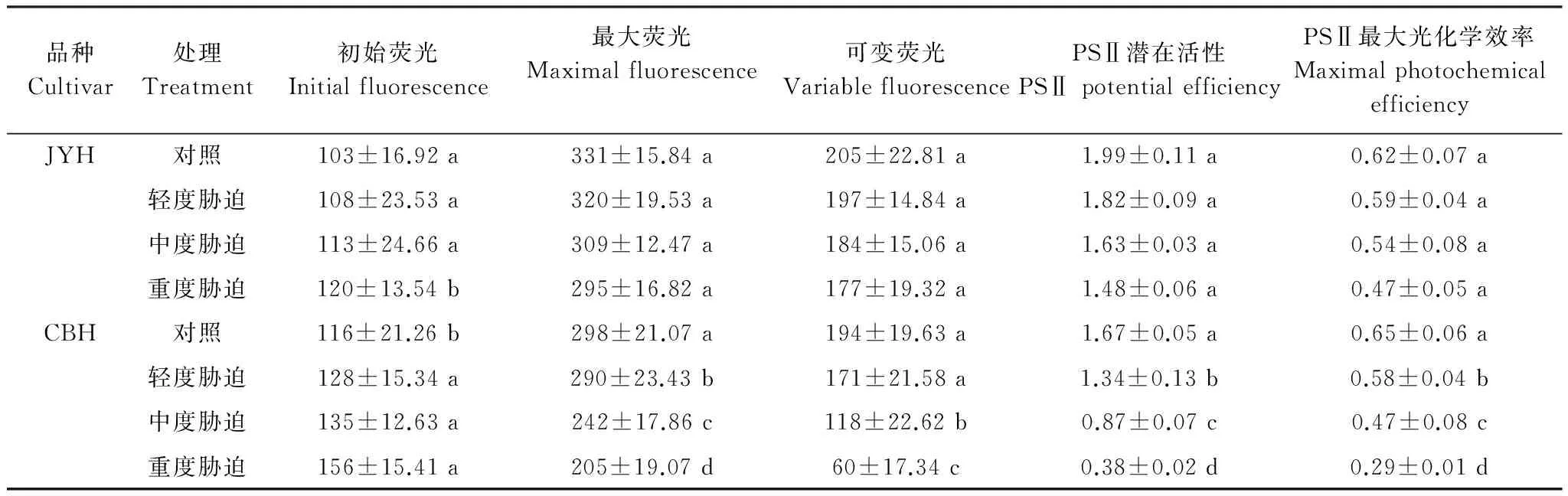
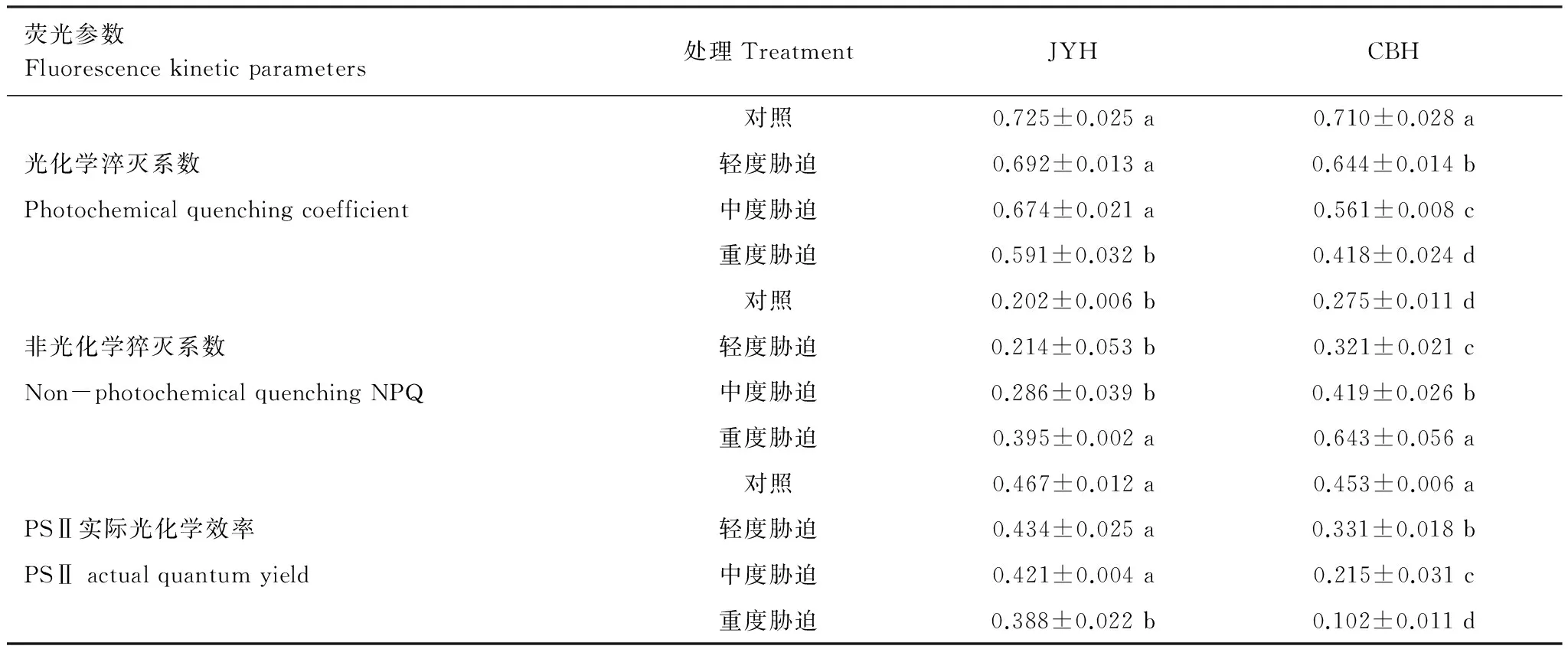
3 讨论
