NPY通过小胶质细胞介导的神经免疫途径对大鼠癫痫发作行为学影响
2015-02-06李琦军吴永波常军英邢兆国张淑丽王道爱王彦志穆卫卢贾东召陈涛平
李琦军,吴永波,常军英,邢兆国,张淑丽,王道爱,王彦志,穆卫卢,李 炎,贾东召,陈涛平
(1. 河北省石家庄市第三医院,河北 石家庄 050011;2. 河北省石家庄市公安局法医损伤检验鉴定室,河北 石家庄 050011;3. 河北省秦皇岛市骨科医院,河北 秦皇岛 066001;4. 河北省正定县疾病预防控制中心,河北 正定 050800;5. 河北大学附属医院,河北 保定 071000)
NPY通过小胶质细胞介导的神经免疫途径对大鼠癫痫发作行为学影响
李琦军1,吴永波2,常军英1,邢兆国1,张淑丽3,王道爱4,王彦志1,穆卫卢1,李 炎1,贾东召1,陈涛平5
(1. 河北省石家庄市第三医院,河北 石家庄 050011;2. 河北省石家庄市公安局法医损伤检验鉴定室,河北 石家庄 050011;3. 河北省秦皇岛市骨科医院,河北 秦皇岛 066001;4. 河北省正定县疾病预防控制中心,河北 正定 050800;5. 河北大学附属医院,河北 保定 071000)

目的 探讨神经肽Y(NPY)以中枢神经系统小胶质细胞为靶点对大鼠癫痫发作的影响。方法 培养和纯化原代SD大鼠皮质小胶质细胞,免疫细胞化学染色,鉴定小胶质细胞纯度及观察细胞形态。将小胶质细胞分为对照组、LPS组、NPY+LPS组和BIBP3226+NPY+LPS组。对照组细胞以无血清胶质细胞培养液孵育6 h,LPS组细胞以含终浓度为100 ng/mL LPS的无血清胶质细胞培养液孵育6 h,NPY+LPS组细胞是先以含NPY (终浓度为1 μmol/L)的无血清胶质细胞培养液孵育0.5 h,然后加入LPS(终浓度为100 ng/mL)继续孵育6 h。IBP3226+NPY+LPS组细胞先用含NPY Y1受体阻断剂BIBP3226 (终浓度为1 μmol/L)的无血清胶质细胞培养液孵育0.5 h,再加入终浓度为1 μmol/L的NPY孵育0.5 h,最后加入终浓度100 ng/mL的LPS继续孵育6 h。20只SD大鼠随机分为对照组、LPS组、NPY+LPS组、BIBP3226+NPY+LPS组,每组5只。将各组小胶质细胞条件培养液离心后注入相应各组大鼠的侧脑室,观察各组大鼠的行为学表现。根据Diehl分级标准对大鼠癫痫发作程度进行评估。结果 20 min内,LPS组和BIBP3226+NPY+LPS组5只大鼠均出现重度癫痫发作,NPY+LPS组有4只出现轻度癫痫发作,对照组未见癫痫发作。LPS组发作程度显著重于对照组,NPY+LPS组发作程度显著轻于LPS组,BIBP3226+NPY+LPS组发作程度显著重于NPY+LPS组,LPS组和BIBP3226+NPY+LPS组发作程度比较差异均无统计学意义。结论 激活后的小胶质细胞可以导致大鼠癫痫发作,这种作用是通过小胶质细胞与神经元之间的非直接接触途径实现的,可能与小胶质细胞分泌到细胞外的生物活性物质有关。NPY可以通过作用于小胶质细胞上NPY Y1受体,抑制大鼠的癫痫发作。
神经肽Y;小胶质细胞;癫痫
癫痫是一种慢性、反复发作的以颅内神经元异常同步放电为基础的中枢神经系统疾病[1]。近年虽然随着外科手术、伽马刀技术的发展,很多药物治疗无效的患者得到了有效治疗,但在我国估计仍有约100万患者为难治性癫痫[2]。过去人们研究癫痫的重点在神经元,现在发现胶质细胞在癫痫发生中也起着重要作用[3]。小胶质细胞是中枢神经系统中体积最小的一种免疫细胞,广泛存在于中枢神经系统,它产生的很多细胞因子和癫痫的发生有关,它是把免疫和癫痫联系起来的重要桥梁,它分泌的细胞因子在癫痫中起着重要作用,故其在脑内神经免疫功能调节和介导炎症反应方面起着重要作用[4]。癫痫也是一种与炎症有关的中枢神经系统疾病,很多细胞因子在癫痫的发病中起着重要作用[5-6]。笔者前几部分实验已经在细胞水平证明神经肽Y(NPY)能够抑制小胶质细胞的免疫活性,减少小胶质细胞来源的IL-1β等炎症因子的产生,并通过抑制小胶质细胞的免疫活性降低体外培养的大鼠皮质神经元的NMDA电流[7]。为了探讨NPY是不是能够通过神经免疫途径影响活体动物的癫痫发作,本实验通过LPS激活后的小胶质细胞条件培养液和经过NPY处理后的小胶质细胞条件培养液注射入大鼠脑室,观察了活体大鼠癫痫发作的行为学变化,现将结果报道如下。
1 实验资料
1.1 实验动物 SD大鼠20只,体质量200~250 g,雄性。24 h内新生SD大鼠30只。均为清洁级,河北医科大学实验动物中心提供,动物生产许可证号SCXK(冀)2013-1-03。根据科技部《关于善待实验动物的指导性意见》使用动物。
1.2 主要仪器和试剂 超净工作台(日本Sanyo公司),恒温培养箱(德国Heraeus公司),光学显微镜(日本OLYMPUS公司),荧光显微镜MI3000B+DFC450C型(德国Leica公司),TLL-C台式高速低温离心机(北京四环科学仪器厂),立体定向仪(深圳市瑞沃德生命科技有限公司),微量注射器(上海光正医疗仪器有限公司),实验动物电子秤(苏杭科技器材有限公司),医用止血钳(福州宜欣医疗器械公司),手术剪(福州宜欣医疗器械公司),医用磨钻(张家港市华新医疗器械厂),医用缝合线(浙江亿人医疗器械有限公司),小鼠单克隆抗体IBA-1 (美国Sigma公司),FITC标记的山羊抗小鼠IgG(美国Proteintech公司),脂多糖(LPS)(美国Sigma公司),胎牛血清(美国Gibco公司),DMEMF12培养液(美国Gibco公司),BIBP3226(美国Tocris Bioscience公司),水合氯醛 (分析纯)(上海生工公司),75%医用乙醇(浙江一佳医疗器械有限公司),生理盐水 (石家庄四药有限公司)。
1.3 原代大鼠皮质混合胶质细胞的培养和小胶质细胞的分离纯化 参照Nakajima等[8]所述方法,先将24 h内新生大鼠头部置于碎冰中2 min降温,然后乙醇消毒头部,无菌环境下开颅取脑,将脑组织放入装有DMEM/F12培养液的培养皿中,培养皿放置于冰板上保持低温。在800倍解剖显微镜下剥除脑膜及血管,取部分大脑皮质,剪碎后用0.125%胰蛋白酶37 ℃消化15 min,加入含10%血清的DMEM/F12培养液终止消化,1 000 r/min离心5 min后,弃上清,在沉淀物中加入胶质细胞培养液,胶质细胞培养液为含10%胎牛血清、1 IU/mL青霉素、100 μg/mL链霉素的DMEM/F12培养液,制成单细胞悬液,以15×106个细胞/瓶接种于750 mL培养瓶中,放置于37 ℃、5%CO2培养箱中培养。第2天全量换液1次,以后每3 d更换1/2体积培养液,光学显微镜下观察混合胶质细胞生长情况。培养至第14天,细胞充分分层生长后,置于37 ℃恒温摇床中180 r/min振摇2 h,收集细胞悬液,1 000 r/min离心5 min,去上清,用DMEM/F12胶质细胞培养液吹打成单细胞悬液,以1×104个细胞/皿接种于预先放置经多聚赖氨酸处理过的盖玻片的3.5 cm培养皿,用于形态学观察和细胞免疫化学染色。
1.4 小胶质细胞分组及处理方法 将分离纯化好的小胶质细胞以5×105个细胞/孔接种于6孔培养板。培养3 d后换新鲜无血清胶质细胞培养液培养12 h使细胞同步化,然后将细胞分为对照组、LPS组、NPY+LPS组和BIBP3226+NPY+LPS组。对照组细胞以无血清胶质细胞培养液孵育6 h,LPS组细胞以含终浓度为100 ng/mL LPS的无血清胶质细胞培养液孵育6 h,NPY+LPS组细胞先以含终浓度为1 μmol/L NPY的无血清胶质细胞培养液孵育0.5 h,然后加入终浓度为100 ng/mL LPY继续孵育6 h。IBP3226+NPY+LPS组细胞先用含终浓度为1 μmol/L NPY Y1受体阻断剂BIBP3226的无血清胶质细胞培养液孵育0.5 h,再加入终浓度为1 μmol/L的NPY孵育0.5 h,最后加入终浓度100 ng/mL的LPS继续孵育6 h。取各组培养液离心后备用。
1.5 动物分组及处理 将SD大鼠随机分为对照组、LPS组、NPY+LPS组、BIBP3226+NPY+LPS组,每组5只。将各组小胶质细胞条件培养液离心后注入相应各组动物的侧脑室。具体方法:根据大鼠体质量,将配置好的10%水合氯醛以 3.5 mg/kg剂量行腹腔注射麻醉,麻醉起效后,将大鼠固定于立体定向仪上,在头部切口区域剪毛,显露头部皮肤,用75%乙醇消毒,沿头顶部正中线做纵向切口,约3 cm,切开头皮,用头皮拉钩将头皮向两侧牵开固定,在颅骨上涂抹少量双氧水,以清晰显示人字缝。根据George Painos大鼠脑立体定位图谱,确定右侧脑室三维坐标:X=-1.0 mm,Y=1.5 mm,Z=-3.8 mm,以此为注射点,电动磨钻磨开颅骨,显露脑膜,在定位器引导下用微量注射器注入10 μL小胶质细胞条件培养液。骨蜡封闭颅骨缺损,缝合皮肤,观察各组动物行为学表现,根据Diehl的分级标准[9]对大鼠的癫痫发作程度进行评估。
1.6 统计学方法 利用SPSS 10.0统计分析软件进行统计学处理,采用Kruskal Wallis秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 原代小胶质细胞形态学观察 分离纯化后的小胶质细胞,可见体积较小、折光性强,有着细长突起(箭头),偶可见体积较大的星形胶质细胞,神经元已经很难看到,见图1。分离纯化后的小胶质细胞采用IBA-1免疫细胞化学荧光染色方法进行鉴定,可见细胞呈分支状或者梭形,有细长的突起(箭头),IBA-1将胞体和突起染成红色,Hoechst 33258将胞核染成蓝色,纯度大于95%,满足实验需要,见图2。
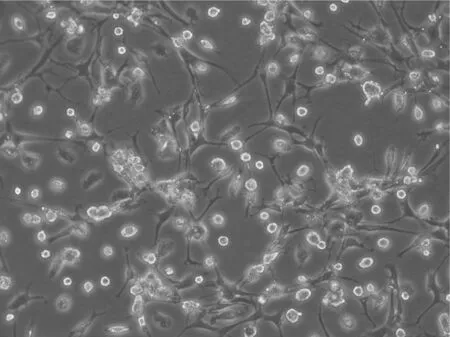
图1 原代培养的大鼠皮质小胶质细胞 (400×)
2.2 各组大鼠癫痫发作情况 LPS组和BIBP3226+NPY+LPS组大鼠注射相应培养液后20 min内出现前肢或后肢间断性抽搐、四肢节律性抽搐,发作等级为Ⅲ~Ⅳ级(重度发作);NPY+LPS组有4只大鼠出现点头、咀嚼、须动、头面部抽搐,发作等级为Ⅰ~Ⅱ级(轻度发作);对照组未见点头、竖毛、抽搐等表现。LPS组和BIBP3226+NPY+LPS组发作等级明显高于对照组和NPY+LPS组(P均<0.05)。
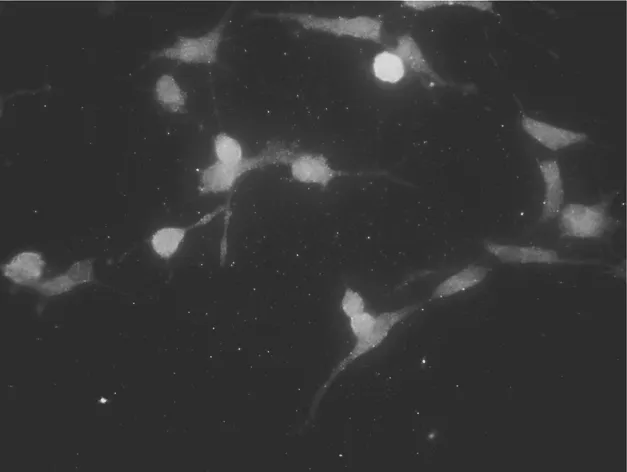
图2 IBA-1抗体染色后的大鼠皮质小胶质细胞 (600×)
3 讨 论
癫痫是一种以脑部神经元反复过度同步放电为特征的疾病,临床上表现为短暂、反复的神经系统功能失常。癫痫的发生与很多因素有关,包括遗传因素、脑内疾病、外伤、全身疾病等,如先天性脑畸形、先天性颅内积水、婴儿的产伤及成人的颅内损伤、细菌或病毒性颅内感染、颅内肿瘤等。癫痫发作时,患者意识突然丧失会导致跌倒,发生外伤性损害,长期癫痫也会导致精神障碍、智力衰退,甚至会导致患者死亡。虽然有伽马刀、手术切除癫痫灶等新的治疗方法出现,但药物治疗仍是治疗癫痫的主要方法之一。很多癫痫经过药物或者手术治疗后症状能够明显缓解,但也有些病例经过长期(2~3年)使用多种抗癫痫药后症状仍不能缓解,这种癫痫称为顽固性癫痫。寻找新的治疗方法及有效的治疗药物是人们攻克癫痫顽疾的关键。
癫痫发病机制涉及很多方面,其中神经机制是其发病的主要因素,但很多其他因素如免疫和内分泌因素对神经元的功能起着调节作用,这种调节功能的失调会加重癫痫的发生、发展。目前研究发现中枢神经系统内的IL-1β和TNF-α主要由小胶质细胞和星形胶质细胞产生,侧脑室注射IL-1β能够促进热性惊厥的发生,而注射IL-1β受体拮抗剂则起到相反的作用。在癫痫发生后,脑内IL-1β、TNF-α明显上升,说明IL-1β、TNF-α与癫痫发生有着密切关系[10-11],二者增加都起到促进癫痫发生的作用[12]。Vezzani等[13]研究证实给予IL-1β后,动物的脑电活动增强,这种效应可被NMDA受体阻断剂阻断,说明IL-1β是通过NMDA受体起作用的。朱晓琴等[14]研究证明,脑室内注射IL-1β能够诱发癫痫,其作用机制可能与其激活谷氨酸受体有关。NMDA受体是一种谷氨酸受体,其介导的兴奋性神经毒性在癫痫的发病发展过程中起着关键作用[15]。此受体被过度激活后,可以导致神经元损伤[16-17]。IL-1β和TNF-α促进癫痫发作的机制可能是激活谷氨酸NMDA受体,促进Ca2+内流,导致神经元细胞内Ca2+超载,从而产生细胞毒性作用,诱发癫痫的产生[18-19]。另外小胶质细胞是脑内起着监视作用的免疫细胞,对刺激非常敏感。当内环境发生变化时,小胶质细胞被激活,激活的小胶质细胞释放大量的炎性因子,对神经元产生毒性作用,导致癫痫发生或加重癫痫发作程度[20-21]。Rodgers等[22]研究表明,LPS可以诱发局部癫痫样放电,其机制可能是LPS激活胶质细胞,通过胶质细胞的激活,产生大量IL-1β,诱发癫痫。加入IL-1β受体拮抗剂后,阻断了IL-1β的作用,这种放电明显减弱或消失,说明胶质细胞来源的IL-1β是诱发放电的主要因素之一,而并非LPS 本身影响神经元导致的癫痫。
LPS可以导致小胶质细胞大量产生IL-1β和TNF-α,这可能是经LPS处理后的胶质细胞培养液注入大脑侧脑室后诱发动物癫痫的机制之一。而NPY可以抑制小胶质细胞的激活和IL-1β、TNF-α的产生。本实验结果显示,经LPS激活的胶质细胞培养液注入大鼠脑室并未出现癫痫发作,经过LPS激活后的小胶质细胞培养液注入大鼠侧脑室时可以很快诱发大鼠癫痫的发生,且发作程度较重,将使用NPY抑制小胶质细胞生物活性的条件培养液注入大鼠侧脑室后癫痫发作明显减轻。本实验中,体外培养的小胶质细胞与脑组织并未直接接触,说明小胶质细胞分泌到培养液中的生物活性物质是造成癫痫发作的主要原因。当用BIBP3226阻断NPY Y1受体后,NPY的作用消失,说明NPY是通过Y1受体起作用的。这为NPY以小胶质细胞为治疗靶点,通过神经-免疫途径治疗癫痫提供了实验依据。
[1] 来海欧. NMDA 受体与癫痫发病机制的研究现状[J]. 国际神经病学神经外科学杂志,2008,35(1):72-75
[2] 臧颖卓,范亚林,李虹,等. 癫痫发病机制的研究现状[J]. 脑与神经疾病杂志,2009,17(1):78-81
[3] 赖娅莉,孙红斌. 星形胶质细胞在癫痫发病机制中的作用研究进展[J]. 实用医院临床杂志,2011,8(4):202-205
[4] Wirenfeldt M,Babcock AA,Vinters HV. Microglia-insights into immune system structure, function, and reactivity in the central nervous system[J]. Histology and Histopathology,2011,26(4):519-530
[5] Friedman A,Dingledine R. Molecular cascades that mediate the influence of inflammation on epilepsy[J]. Epilepsia,2011,52(s3):33-39
[6] Choi J,Nordli DR,Alden TD,et al. Cellular injury and neuroinf-lammation in children with chronic intractable epilepsy[J]. Journal of neuroinflammation,2009,6(1):38
[7] Li QJ,Dong CZ,Li WL,et al. Neuropeptide Y protects cerebral cortical neurons by regulating microglial immune function[J]. Neural Regen Res,2014,9(9):959-967
[8] Nakajima K,Takemoto N,Kohsaka S. Retinoic acid enhances the secretion of plasminogen from cultured rat microglia[J]. FEBS Lett,1992,314(2):167-170
[9] Diehl RG,Smialowski A,Gotwo T. Development and persistence of kindled seizures after repeated injections of pentylenetetrazol in rats and guinea pigs[J]. Epilepsia,1984,25(4):506-510
[10] 牛延献,罗晓红,史智勇,等. 癫痫大鼠血清和脑组织IL-1β、IL-6和TNF-α水平变化[J]. 放射免疫学杂志,2005,18(4):256-259
[11] 王珍,刘庆莹,朱长庚,等. 戊四氮致痫大鼠脑和脑脊液 IL-1β、TNF-α 含量的变化及大脑皮质和海马内GFAP和cyclin D1表达[J]. 华中科技大学学报,2005,34(2):129-133
[12] Zhu XQ,LI ZL,Zhu CG,et al. Changes in behavior and amino acid neurotransmitters in the brain of rats with seizure induced by IL-1 or IL-6[J]. Journal of Huazhong University of Science and Technology Medical Sciences,2005,25(3):236-239
[13] Vezzani A,Conti M,De Luigi A,et al. Interleukin-1β immunoreactivity and microglia are enhanced in the rat hippocampus by focal kainate application: functional evidence for enhancement of electrographic seizures[J]. The Journal of Neuroscience,1999,19(12):5054-5065
[14] 朱晓琴,李正莉,朱长庚,等. IL-1β或IL-6致痫大鼠脑内γ-氨基丁酸和谷氨酸免疫反应性的变化[J]. 解剖学报,2005,36(6):586-590
[15] Hellier JL,White A,Williams PA,et al. NMDA receptor-mediated long-term alterations in epileptiform activity in experimental chronic epilepsy[J]. Neuropharmacology,2009,56(2):414-421
[16] Metzler M. Mutations in NMDA receptors influence neurodevelopmental disorders causing epilepsy and intellectual disability[J]. Clinical Genetics,2011,79(3):219-220
[17] Costa BM,Irvine MW,Fang G,et al. A novel family of negative and positive allosteric modulators of NMDA receptors[J]. Journal of Pharmacology and Experimental Therapeutics,2010,335(3):614-621
[18] Viviani B,Bartesaghi S,Gardoni F,et al. Interleukin-1β enhances NMDA receptor-mediated intracellular calcium increase through activation of the Src family of kinases[J]. The Journal of Neuroscience,2003,23(25):8692-8700
[19] Zhu W,Zheng H,Shao X,et al. Excitotoxicity of TNFα derived from KA activated microglia on hippocampal neurons in vitro and in vivo[J]. Journal of neurochemistry,2010,114(2):386-396
[20] Galic MA,Riazi K,Heida JG,et al. Postnatal inflammation increases seizure susceptibility in adult rats[J]. The Journal of Neuroscience,2008,28(27):6904-6913
[21] Ravizza T,Rizzi M,Perego C,et al. Inflammatory response and glia activation in developing rat hippocampus after status epilepticus[J]. Epilepsia,2005,46(s5):113-117
[22] Rodgers KM,Hutchinson MR,Northcutt A,et al. The cortical innate immune response increases local neuronal excitability leading to seizures[J]. Brain,2009,132(9):2478-2486
The inhibiting effect of NPY on the epileptic seizures of rats by acting on microglia
LI Qijun1, WU Yongbo2,CHANG Junying1,XING Zhaoguo1,ZHANG Shuli3, WANG Daoai4,WANG Yanzhi1,MU Weilu1, LI Yan1,JIA Dongzhao1,Chen Taoping5
(1.The Third Hospital of Shijiazhuang, Shijiazhuang 050011,Hebei, China; 2.Forensic Damage Identification Room,the Public Security Bureau of Shijiazhuang, Shijiazhuang 050011,Hebei, China; 3.Orthopedic Hospital of Qinghuangdao, Qinhuangdao 066001, Hebei, China; 4.Zhengding Centers for Disease Control, Zhengding 050800, Hebei, China;5. Affiliated Hospital of Hebei University,Baoding 071000,Hebei,China)
Objective It is to explore the influence of NPY on the epileptic seizure of rats by acting on microglia.Methods The primary cortex microglia of rats was cultured and purified, morphology of microglia were observed through immunocytochemistry staining, Primary cerebral cortical microglia of rats was divided into control group, LPS group, NPY+LPS group, NPY group and BIBP3226+NPY+LPS group. Microglia cells in control group were incubated with serum-free medium for 6 h; microglia cells in LPS group were incubated with serum-free medium including LPS(final concentration 100 ng/mL)for 6 h; microglia cells in NPY+LPS group were incubated with serum-free medium including NPY(final concentration 1 μmol/L) for 0.5 h firstly, then continued the incubation for 6 h after adding LPS (final concentration 100 ng/mL); microglia cells in NPY group were incubated in serum-free medium including NPY (final concentration 1 μmol/L) for 6 h; microglia cells in BIBP3226+NPY+LPS group were incubated in serum-free medium including BIBP3226 (final concentration 1 μmol/L) which was NPY Y1 receptor blocking reagent for 0.5 h, then we incubated them for 0.5 h after adding NPY (final concentration 1 μmol/L),at last the cells were incubated for 6 h after adding LPS with the final concentration 100 ng/mL. 20 adult SD rats were divided into control group,LPS group,NPY+LPS group and BIBP3226+NPY+LPS group,every group included five rats. The levels of epileptic seizure of rats in each group were observed after microglia conditioned mediums were injected respectively into ventricle of the adult rats. Behaviors of the rats in every group were observed, and epilepsy degree was evaluated based on Diehl’s method.Results In 20 minutes, all the 5 rats in LSP group and BIBP3226+NPY+LPS group appeared severe epileptic seizure. There were 4 rats in NPY+LPS group appeared mild epileptic seizures in the same time.There was no rat appeared epileptic seizure in control group. The degrees of epileptic seizure of LPS group were significantly higher than that of the control group. the degrees of NPY+LPS group were significantly lower than that of LPS group. The degrees of BIBP3226+NPY+LPS group were significantly higher than that of NPY+LPS group. There was no difference in the degrees between LPS group and BIBP3226+NPY+LPS group. Conclusion LPS could stimulate microglia cells to cause epileptic seizure of rats. NPY can restrain epileptic seizure of rats through acting on NPYY1 receptor on microglia. This may be related to something with biological activity.
neuropeptide Y; microglia; epileptic seizur
李琦军,男,副主任医师,博士,从事骨科诊治研究工作。
陈涛平,E-mail:18603121976@163.com
10.3969/j.issn.1008-8849.2015.11.004
R-332
A
1008-8849(2015)11-1150-04
2014-09-14
