色氨酸羟化酶基因A218C多态性对抑制控制影响的事件相关电位研究
2015-02-06詹向红韩贺云王慧霞闫秀娟侯俊林王友杰
刘 永,詹向红,韩贺云,王慧霞,闫秀娟,侯俊林,王友杰
(1. 山东中医药大学基础医学院,山东 济南 250300;2. 河南中医学院基础医学院,河南 郑州 450008)
论 著
色氨酸羟化酶基因A218C多态性对抑制控制影响的事件相关电位研究
刘 永1,2,詹向红2,韩贺云2,王慧霞2,闫秀娟2,侯俊林2,王友杰2
(1. 山东中医药大学基础医学院,山东 济南 250300;2. 河南中医学院基础医学院,河南 郑州 450008)

目的 应用事件相关电位技术,检测不同色氨酸羟化酶(TPH)基因A218C多态性被试抑制控制的脑电特征。方法 以51名在校正常大学生为受试者,PCR-LDR法测定受试者基因型(AA/AC/CC),采用Go/Nogo范式,由Neuroscan系统记录并分析受试者脑电特征,比较不同基因型受试者的脑电成分。结果 不同基因型受试者Go/Nogo任务的行为反应比较差异无统计学意义,不同基因型受试者N2差异波幅比较差异有统计学意义,P3波幅、N2成分波幅和潜伏期比较差异均无统计学意义。结论 不同色氨酸羟化酶基因A218C多态性对大脑信息加工和处理过程产生了影响,不同基因型影响对刺激的监控过程,具有不同的脑电活动特征。
色氨酸羟化酶多态性;连接酶特异检测反应;事件相关电位;执行功能;抑制控制
情绪个体差异的遗传背景受到越来越多的关注,研究发现情绪的产生、表达和控制受到遗传因素的影响。基因多态性是指DNA碱基序列的差异,这种差异在群体中出现的频率大于1%,且以孟德尔遗传方式遗传。色氨酸羟化酶(tryptophan hydroxylase,TPH)是5-羟色胺(5-hydroxy tryptamine,5-HT)合成的限速酶,定位于人类11号染色体短臂上,TPH基因中存在一个多态性位点A218C,研究报道其与自杀冲动等多种情绪精神障碍的发生相关[1-2],也与愤怒特质相关[3]。愤怒、抑郁情绪等的产生均与抑制控制密切相关[4]。为探讨TPH基因多态性对情绪的影响是否与人的抑制控制能力有关,本研究选择事件相关电位技术(event related potentials,ERPs)考察了不同TPH基因型受试者抑制控制的能力,现报道如下。
1 研究资料
1.1研究对象 经伦理委员会批准后招募在校正常大学生51人为受试者,填写知情同意书及一般情况调查表,参考文献[5]方法设立入组及排除标准。
1.2 试验程序和任务 刺激由E-prime 2.0系统控制呈现。参考文献[6]做法,以黑色单/双三角形构成Go/Nogo任务刺激图形,共8组刺激,每组含100个试次,其中Go任务为60个,Nogo任务为40个。要求受试者Go任务时做按键反应,出现Nogo任务则不做任何反应,按键手在受试者中交叉以平衡左右手动作对脑电的影响。整个实验约需要20 min,实验完成后给予被试一定酬劳。
1.3 数据采集与处理 采用NuAmps 40导系统(Neuroscan Inc)记录脑电图(EEG),同步记录连续EEG与行为学数据。用Neuroscan 4.5软件对脑电数据进行离线分析。对反应正确的EEG进行分类叠加,得到Go和Nogo刺激产生的两类ERPs数据,对得到的ERPs进行30 Hz(24 dB/oct)无相移低通数字滤波。
1.4 基因分型 采用PCR-LDR法进行基因分型。聘请检验科护士采血,以血样白细胞基因组DNA为模板,扩增目的基因片段。聚合酶链式反应(PCR)的引物序列为5’-GCA TTT AGA ATG GTA CCT GGC-3’,5’-CAC CAC TCG ATG CAA CAT TTG-3’。PCR反应体系:模板DNA 1 μL,10×PCR buffer 1.5 μL,MgCl2(25 mmol/L)1.5 μL,dNTP(10 mmol/L)0.3 μL,Taq酶1.25 IU,引物各0.25 μL,使用去离子水补足体积至25 μL。反应条件:94 ℃预变性2 min;94 ℃变性15 s、60 ℃退火15 s、72 ℃延伸30 s共35个循环;72 ℃延伸3 min。扩增产物通过连接酶特异检测反应(LDR)检测基因多态性位点。针对多态性位点设计识别两种不同碱基的左端探针(长度相差3 bp)以及带荧光(FAM)的右端共用探针,终产物长度差别即为左端探针的长度差别。LDR探针序列为右端公用探针P-TAG CTG CTA TTC TGA GCA TAG GGA A-FAM;左端探针TA:TAT TAA TTG ACA ACC TAT TAC GTG A,连接产物为50/A;左端探针TC:TTT TAT TAA TTG ACA ACC TAT TAC GTG C,连接产物为53/C。10 μL连接体系为:PCR产物3 μL、10×Taq DNA ligase buffer 1 μL、Taq DNA ligase 5 IU,特定LDR探针各0.1 pmol,去离子水补足体积至10 μL。连接反应参数:94 ℃变性30 s、60 ℃退火并连接3 min,循环20次。反应结束后,4 ℃保存待用。取1 μL连接反应产物,加10 μL上样buffer(已混入MarKer),95 ℃变性3 min,立即冰水浴。连接产物经ABI 3730XL测序仪扫描,根据目的峰与MarKer的位置差距来读取结果(上海捷瑞生物工程有限公司合成引物并完成测定)。最终各基因型纳入受试者AA型14人,AC型22人,CC型15人。
1.5 数据分析与统计 所有数据均采用SPSS 22.0软件进行统计分析。导出行为学数据(反应时、正确率)进行单因素方差分析。对于EEG结果本研究主要对中线的5个电极位点(Fz、Fcz、Cz、Cpz和Pz)进行统计分析。以刺激出现后200~300 ms时间窗内最大负向波峰值及其出现时间为N2幅值和潜伏期,300~500 ms时间窗内最大正向波峰值及出现时间为P3的幅值和潜伏期。为了强调Nogo效应和进行组间比较,研究使用相减技术从Nogo成分中减去Go成分,分别获得N2和P3的差异波(N2d和P3 d),以刺激出现后200~300 ms、300~500 ms时间窗内N2d和P3d的面积作为Nogo效应的指标[7]。分别对N2、P3 峰潜伏期和波幅以及差异波进行混合重复测量数据方差分析。重复测量方差分析的P值采用Greenhouse-Geisser法校正。在以上所有统计分析中,以P<0.05为差异有统计学意义。
2 结 果
2.1不同基因型受试者行为学数据 不同基因型受试者正确率、反应时差异均无统计学意义。见表1。
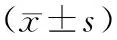
表1 不同基因型受试者行为数据比较
2.2 不同基因型受试者ERPs分析 不同基因型在不同刺激条件下产生的N2、P3成分及差异波成分见图1~3。
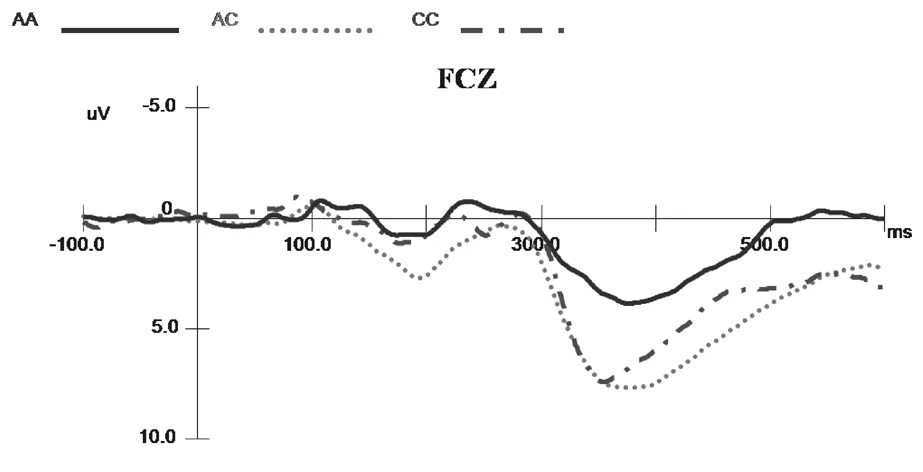
图1 不同基因型受试者Go刺激下产生的ERPs成分(额中央区Fcz)
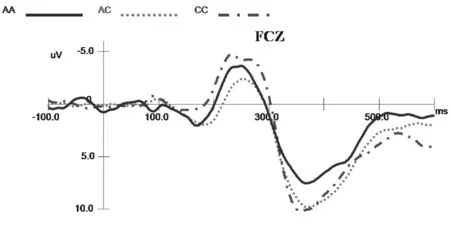
图2 不同基因型受试者在Nogo刺激下产生的ERPs成分(额中央区Fcz)
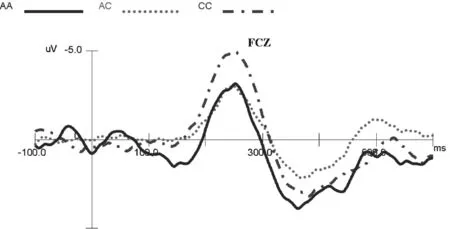
图3 不同基因型受试者ERPs差异波成分(额中央区Fcz)
2.2.1 潜伏期 不同基因型组间Go和Nogo 刺激产生的N2成分及反应类型间比较差异均无统计学意义[F(2,48)=0.277,P=0.759,η2=0.011;F(1,48)=0.137,P=0.713,η2=0.003];不同组间Go和Nogo刺激产生的P3成分潜伏期比较差异无统计学意义[F(2,48)=2.705,P=0.077,η2=0.101],但反应类型间比较差异有统计学意义[F(1,48)=10.526,P=0.002,η2=0.180],事后检验显示Nogo效应峰潜伏期(390.34±4.29)ms较Go效应峰潜伏期[(376.98±5.17)ms]长。
2.2.2 波幅 各基因受试者在不同刺激条件下产生的N2成分波幅比较差异无统计学意义[F(2,48)=1.075,P=0.349,η2=0.043],反应类型间比较差异有统计学意义[F(1,48)=108.08,P=0.000,η2=0.692],事后检验表明Nogo效应N2波幅较大[(-2.75±0.59)μV],Go效应波幅较小[(0.07±0.60)μV](N2波为负向波);不同基因型间与反应类型间交互效应显著[F(2,48)=7.50,P=0.001,η2=0.238],简单效应分析显示Nogo任务中AC型和CC型波幅比较差异有统计学意义(P=0.032);不同基因型受试者Nogo任务波幅均大于Go任务。不同基因型受试者在不同刺激条件下产生的P3成分波幅比较差异无统计学意义[F(2,48)=2.673,P=0.079,η2=0.100];反应类型间效应差异有统计学意义[F(1,48)=14.19,P=0.000,η2=0.228],事后检验表明Nogo效应P3波幅较大[(8.51±0.57)μV],Go效应波幅较小[(7.23±0.56)μV](P3波为正向波);不同基因型间与反应类型间交互效应比较差异无统计学意义[F(2,48)=0.816,P=0.448,η2=0.033]。
2.2.3 N2d面积 中线部位5个电极的N2d面积不同基因型间比较差异有统计学意义[F(2,48)=7.248,P=0.002,η2=0.232] ,事后检验表明CC型N2d面积最大为-336.50±35.17,AC型和AA型的N2d面积分别为-214.65±29.04和-148.14±36.40。中线部位5个电极的P3d面积不同基因型间比较差异无统计学意义[F(2,48)=1.720,P=0.190,η2=0.067]。
3 讨 论
执行功能是指在完成复杂的认知任务时,对各种认知过程进行协调,以保证认知系统以灵活、优化的方式实行特定目标的一般性控制机制;其本质就是对其他认知过程进行控制和调节。执行功能的主要成分包括抑制控制、转换和刷新等,其中抑制控制是执行功能的核心成分[8-9]。前期研究表明TPH基因A218C多态性与愤怒等情绪产生与表达的差异性相关[10-11]。个体愤怒特质与攻击、自杀等行为关系密切,高特质愤怒个体在敌意情境下会表现出更多的攻击倾向,而攻击等与执行功能尤其是抑制控制功能呈负相关[12]。那么TPH 基因A218C多态性对愤怒情绪产生和表达的影响是不是通过影响执行功能而实现的是当前需要解决的问题。
事件相关电位具有较高的时间分辨率和一定的空间分辨率。大量研究表明,Go/Nogo任务可以用来检测抑制控制[13-16]。在Go/Nogo任务中受试者需要对靶刺激作出反应而抑制对非靶刺激的反应冲动。该任务产生2个主要脑电成分,第1个是波峰在200~300 ms潜伏期内的Nogo-N2成分,第2个是波峰在300~500 ms潜伏期内的Nogo-P3成分。这2个ERPs成分都被认为与抑制控制有关。N2波反映了对刺激信息的监测, 包括对新异刺激的察觉和对视觉注意资源的分配等[17]。Nieuwenhuis等[18]报道N2波幅在低频刺激下增大且定位于前扣带回,认为Nogo-N2代表了信息输入及加工过程中干扰信息的监测。Kok等[19]在Stop-Signal任务发现正确的Nogo试次明显比错误的Nogo试次诱发出来的Nogo-P3大,认为前中央部诱发出来的Nogo-P3增大反映了反应抑制过程。尽管两成分的心理过程没有最终确定,但可以认为Nogo-N2和Nogo-P3可能分别代表了与抑制控制有关的2个加工过程——冲突监测[20]和反应抑制[21]。本研究结果显示,不同基因型受试者Go/Nogo任务的行为反应比较差异无统计学意义,这可能是因为本实验Go/Nogo任务比较简单所致。从ERPs数据来看,受试者在Nogo试次的N2及P3波波幅均较大,表明本次研究成功诱发出了Nogo效应。N2波不同基因型间与反应类型间交互效应显著,简单效应分析显示Nogo任务中AC型和CC型波幅比较差异有统计学意义;另外N2d比较差异也有统计学意义,CC型波幅最大,而AA型波幅较小,显示受试者在认知信息加工处理过程中具有不同的脑电活动特征。不同基因型受试者N2d比较差异有统计学意义,N2d是Nogo任务减去Go任务后的差异波,相减后的成分被认为代表了纯粹的抑制控制脑电成分,因此该结果表明不同基因型受试者的抑制控制能力存在不同,CC型最强而AA型最弱。但不同基因型受试者P3成分及差异波的差异均无统计学意义,表明不同TPH A218C基因多态性对大脑后期信息加工和处理过程影响不显著。因此可认为不同基因型受试者对刺激信息的监测存在差异,不同基因型影响对刺激的监控过程具有不同的脑电活动特征。
[1] González-Castro TB, Juárez-Rojop I, López-Narváez ML,et al. Association of TPH-1 and TPH-2 gene polymorphisms with suicidal behavior:a systematic review and meta-analysis[J]. BMC Psychiatry,2014,14:196
[2] Koh KB,Choi EH,Lee YJ,et al. Serotonin-related gene pathways associated with undifferentiated somatoform disorder[J]. Psychiatry Res,2011,189(2):246-250
[3] 侯俊林,詹向红,刘永,等. TPH基因A218C多态性与愤怒启动及控制特质的关系[J]. 中华中医药杂志,2012,27(7):1801-1804
[4] Adler LA,Dirks B,Deas PF,et al. Lisdexamfetamine dimesylate in adults with attention-deficit/ hyperactivity disorder who report clinically significant impairment in executive function:results from a randomized, double-blind, placebo-controlled study[J]. J Clin Psychiatry,2013,74(7):694-702
[5] Yang B,Yang S,Zhao L,et al. Event-related potentials in a Go/Nogo task of abnormal response inhibition in heroin addicts[J]. Sci China C Life Sci, 2009,52(8):780-788[6] 张炳蔚,许晶,赵仑. 晚发性抑郁患者情绪调节机制的ERPs研究[J]. 航天医学与医学工程,2006,19(2):150-152
[7] Gajewski PD,Falkenstein M. Effects of task complexity on ERP components in Go/Nogo tasks[J]. Int J Psychophysiol,2013,87(3):273-278
[8] Selemon LD. A role for synaptic plasticity in the adolescent development of executive function[J]. Transl Psychiatry,2013,3:e238
[9] Chiu YC,Egner T. Inhibition-induced forgetting:when more control leads to less memory[J]. Psychol Sci,2015,26(1):27-38
[10] 侯俊林,詹向红,刘永,等. TPH基因A218C多态性与愤怒启动及控制特质的关系[J]. 中华中医药杂志,2012,27(7):1801-1804
[11] 詹向红,侯俊林,闫秀娟,等. 色氨酸羟化酶A218C多态性与愤怒启动及表达特质的关系[J]. 中华中医药杂志,2013,28(7):2001-2004
[12] Potegal M. Temporal and frontal lobe initiation and regulation of the top-down escalation of anger and aggression[J]. Behav Brain Res,2012,231(2):386-395
[13] Moreno S,Wodniecka Z,Tays W,et al. Inhibitory control in bilinguals and musicians: event related potential (ERP) evidence for experience-specific effects[J]. PLoS One,2014,9(4):e94169
[14] Woltering S,Liu Z,Rokeach A,et al. Neurophysiological differences in inhibitory control between adults with ADHD and their peers[J]. Neuropsychologia,2013,51(10):1888-1895
[15] Covey TJ,Shucard JL,Violanti JM,et al. The effects of exposure to traumatic stressors on inhibitory control in police officers: a dense electrode array study using a Go/NoGo continuous performance task[J]. Int J Psychophysiol,2013,87(3):363-75
[16] Benikos N,Johnstone SJ,Roodenrys SJ. Varying task difficulty in the Go/Nogo task: the effects of inhibitory control, arousal, and perceived effort on ERP components[J]. Int J Psychophysiol,2013,87(3):262-272
[17] Folstein JR,Van Petten C. Influence of cognitive control and mismatch on the N2 component of the ERP:a review[J]. Psychophysiology,2008,45(1):152-170
[18] Nieuwenhuis S,Yeung N,van den Wildenberg W,et al. Electrophysiological correlates of anterior cingulate function in a go/no-go task:effects of response conflict and trial type frequency[J]. Cogn Affect Behav Neurosci,2003,3(1):17-26
[19] Kok A,Ramautar JR,De Ruiter MB,et al. ERP components associated with successful and unsuccessful stopping in a stop-signal task[J]. Psychophysiology,2004,41(1):9-20
[20] Wang S,Hui N,Zhou X,et al. Neural mechanisms underlying conflict monitoring over risky decision alternatives:evidence from ERP in a Go/Nogo task[J]. J Integr Neurosci,2014,13(3):497-508
[21] Cid-Fernandez S1,Lindin M,Diaz F. Effects of amnestic mild cognitive impairment on N2 and P3 Go/NoGo ERP components[J]. J Alzheimers Dis,2014,38(2):295-306
Association study on tryptophan hydroxylase gene A218C polymorphism and inhibitory control: an ERPs study
LIU Yong1,2, ZHAN Xianghong2, HAN Heyun2, WANG Huixia2, YAN Xiujuan2, HOU Junlin2, WANG Youjie2
(1.School of Basic Medicine,Shandong University of TCM,Ji’nan 250300,Shandong,China;2. School of Basic Medicine,He’nan College of TCM,Zhengzhou 450008, He’nan, China)
Objective It is to observe the association on tryptophan hydroxylase gene A218C polymorphism and inhibitory control by event related potentials(ERPs). Methods 51 healthy undergraduates at school were selected as subjects, behavioral data and ERPs data relevant to a visual Go/Nogo task were recorded and analyzed by Neuroscan system. The participants were assigned to 3 groups(AA/AC/CC)by their single nucleotide polymorphism type. Results No significant difference was found in either reaction time or accuracy of Nogo task among different gene type subjects(P>0.05). The N2 Difference Wave (Nogo minus Go)amplitudes showed a significant difference among different gene type subjects. No significant difference was found in the P3 amplitude, N2 component amplitude,latency among different gene type subjects. Conclusion The TPH A218C polymorphism participates in the process of cognitive control, different gene type can effect the conflict monitoring of novel stimuli with different electrical activity features.
tryptophan hydroxylase polymorphism;ligase detection reaction;event related potentials;executive function;inhibitory control
刘永,男,讲师,博士在读,研究方向为情志与衰老及相关疾病的机制研究。
詹向红,E-mail:zxh371@163.com
国家自然科学基金项目(30772686;30973695)
10.3969/j.issn.1008-8849.2015.11.001
R596
A
1008-8849(2015)11-1141-04
2014-12-30
