人外周血巨噬细胞培养及功能鉴定①
2015-02-05林炜明戴爱玲尹会方杨小燕龙岩学院生命科学学院龙岩364000
林炜明 戴爱玲 尹会方 杨小燕 (龙岩学院生命科学学院,龙岩 364000)
人外周血巨噬细胞培养及功能鉴定①
林炜明 戴爱玲 尹会方 杨小燕②(龙岩学院生命科学学院,龙岩 364000)
目的:从人外周血单个核细胞(PBMC)中分离单核细胞,诱导分化成巨噬细胞并鉴定其功能。方法:应用免疫磁珠法从人外周血单个核细胞中分选CD14+单核细胞,分离后的细胞用流式细胞仪检测其纯度,用含有10%人AB血清和10 ng/ml人M-CSF的IMDM培养基体外培养CD14+单核细胞,诱导分化成巨噬细胞,并进行形态特征和吞噬功能鉴定。结果:免疫磁珠法能从外周血中分离到高纯度的CD14+单核细胞,分选前CD14阳性率为10%,分选后CD14阳性率为85.8%。诱导培养7天后巨噬细胞的直径最大可达40~45 μm,大部分细胞呈煎蛋状,能有效地吞噬淋巴瘤Raji细胞。结论:从外周血中分离了高纯度的CD14+单核细胞,诱导形成的巨噬细胞具有吞噬淋巴瘤细胞的功能。
巨噬细胞;磁珠分选;培养;功能鉴定
单核-巨噬细胞系统包括血液中的单核细胞和组织中固定或游走的巨噬细胞,具有吞噬功能。单核细胞来源于骨髓干细胞,在骨髓中经前单核细胞分化发育为单核细胞,然后由骨髓释放入血,经过血液循环便移行到各个组织中,分化成组织中的巨噬细胞。所有巨噬细胞包括炎症位点和稳态下定居于组织中的均由单核细胞衍生而来[1]。在体外培养时,单核细胞在含有血清或巨噬细胞集落刺激因子(M-CSF)培养中分化成巨噬细胞[2]。CD14是一种通过糖基磷脂酰肌醇锚定于细胞膜表面的糖蛋白,分布于单核细胞、巨噬细胞膜表面脂质丰富的区域,而在内皮细胞、上皮细胞等表面则未发现CD14的存在,目前已被广泛用来鉴定单核巨噬细胞[3,4]。本实验通过采集健康成人新鲜外周血,应用免疫磁珠法捕获CD14+单核细胞,经体外培养分化为巨噬细胞,建立高纯度的人外周血来源巨噬细胞分离培养体系,并鉴定其吞噬淋巴瘤细胞的功能,为免疫细胞的后续研究奠定基础。
1 材料与方法
1.1 主要试剂 IMDM、胎牛血清、人AB血清和TrypLE购自 Life Technology公司;人 M-CSF购自eBiosciences公司;Primocin购自 Invivogen公司;人CD14正选试剂盒和人CD14抗体(clone MoP9,APC标记)以及EasySep专用磁极购自Stemcell Technologies公司。
1.2 免疫磁珠法分离单核细胞 采集健康成人新鲜外周抗凝血,用Ficoll密度梯度离心法分离外周血单个核细胞(PBMC),用洗液(含2%FBS的PBS)洗涤,悬浮细胞并计数,PBMC可放在液氮长期保存,解冻后的PBMC可用DNaseⅠ室温孵育15 min后用30 μm的尼龙网过滤后重新计数,2.0×108个PBMC用来CD14正选,加入200 μl EasySep抗体正选试剂盒,用移液器轻轻上下吹打均匀,室温孵育15 min,再加100 μl EasySep纳米磁珠,充分混匀后室温孵育10 min,轻轻混匀后将试管放入专用磁极中静止5 min,将磁极连试管一起拿起,倒出上清部分。用洗液重新混匀后重复2次过程。
1.3 流式细胞术分析单核细胞分离纯度 分别取分选前的PBMC、分选所得的CD14+单核细胞以及分流柱流出的细胞各5 ×105个细胞,加入2.5 μl人CD14-APC抗体(clone MoP9),用抗鼠IgG单克隆抗体做同型对照,4℃避光孵育30 min,洗涤后用洗液悬浮细胞,流式细胞仪检测分选前后细胞CD14的表达情况,以同型对照的细胞作为对照,计算细胞的CD14阳性率。
1.4 巨噬细胞的培养与形态学观察 配置含10%人AB血清和10 ng/ml人M-CSF的IMDM培养液,加入8 ml新鲜培养液于10 cm的细胞培养皿中,每个培养皿中CD14+单核细胞数为5×106个细胞,于37℃、5%CO2培养箱中培养7 d,培养期间不换液。在第1、3、6天时倒置显微镜观察细胞的活力及形态,包括贴壁状态,体积、形态、伪足的变化。
1.5 吞噬Raji细胞实验
1.5.1 CFSE标记淋巴瘤Raji细胞 1.0×106个淋巴瘤Raji细胞悬浮于0.5 μmol/L CFSE荧光染料(PBS稀释)中,室温避光孵育2 min,立即加入FBS使FBS的含量为10%,37℃避光水浴10 min,离心洗涤后悬浮细胞,制备成CFSE标记淋巴瘤Raji细胞。
1.5.2 吞噬功能检测 巨噬细胞培养到第7天时,PBS洗涤,用TrypLE消化15~20 min,收集巨噬细胞,用培养液调整巨噬细胞浓度至1.0×106个/ml,作为效应细胞。调整CFSE标记的Raji细胞浓度调整至2.0×106个/ml,作为靶细胞。各取50 μl效应细胞和靶细胞(效靶比为1∶2)加至96孔板,离心后于37℃、5%CO2培养箱中培养2 h,洗涤后悬浮细胞,每孔加人1 μl抗CD14-APC抗体,4℃避光孵育30 min,流式细胞仪检测吞噬率。
2 结果
2.1 单核细胞分离及纯度鉴定 流式细胞仪检测结果显示(图1),免疫磁珠分选前CD14阳性细胞占PBMC的10%,分选后收获的CD14阳性细胞群中CD14阳性率为85.8%,而CD14阴性细胞群中CD14阳性率为0.3%。表明采用免疫磁珠阳性分选可以获得高纯度的CD14+细胞。
2.2 CD14+单核细胞向巨噬细胞分化 CD14+细胞在10%人AB血清和10 ng/ml人M-CSF的IMDM培养液中培养7 d,期间无需更换培养液,显微镜下观察细胞生长情况,培养24 h后,大部分细胞已经贴壁,细胞体积仍然较小,少量细胞伸出很短的伪足(图2A)。培养到第3天时,细胞体积增大,伪足伸展明显(图2B)。培养到第6天时,伪足没有进一步增加和伸展,细胞贴壁牢固,体积进一步明显增大,较大的细胞直径可达40~45 μm,形状从不规则形逐渐变成椭圆形,大部分细胞呈煎蛋状,少数为长梭形,培养液中悬浮的细胞与第三天时相比无明显区别(图2C)。
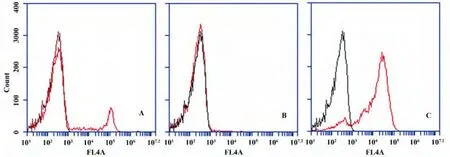
图1 CD14阳性细胞纯度流式检测结果峰图Fig.1 Flow cytometry graph of purity analysis of CD14 positive cellsN
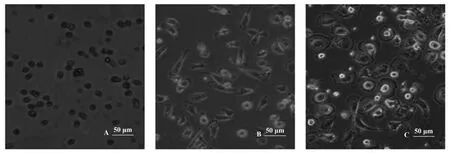
图2 巨噬细胞形态特征Fig.2 Morphological features of macrophages
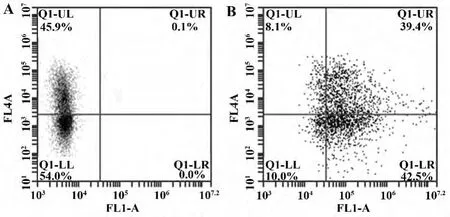
图3 巨噬细胞吞噬功能流式检测结果峰图Fig.3 Flow cytometry graph of phagocytosis function of macrophage
2.3 巨噬细胞吞噬功能 巨噬细胞培养到第7天时,流式细胞仪检测CD14阳性率,CD14+细胞在数量上有部分减少,阳性率为46%。根据细胞的形态[5]及贴壁生长的特性[6],此时培养板中生长的绝大多数是巨噬细胞。效应细胞(巨噬细胞)和靶细胞(CFSE标记的淋巴瘤Raji细胞)混合培养2 h后,用CD14-APC对巨噬细胞进行染色,流式细胞仪检测吞噬率(图3)。结果表明,巨噬细胞与淋巴瘤细胞作用后,82%巨噬细胞(包括CD14阳性和阴性)吞噬了淋巴瘤细胞,83%的CD14+巨噬细胞吞噬了Raji细胞,表明培养的巨噬细胞有很强的吞噬功能。
3 讨论
单核-巨噬细胞是调节免疫应答的主要细胞,具有吞噬和杀伤、递呈抗原和启动免疫应答以及抗肿瘤等功能[2]。研究者可以从外周血中分离单核细胞,诱导成巨噬细胞进行功能研究[3]。免疫磁珠法是近年来细胞分选的重要技术,具有磁性的微颗粒通过结合特定抗体,在液相中能特异性地与相应抗原相结合,依靠磁场的作用力快速地使所需样品得到大大的浓缩[7]。CD14为单核巨噬细胞系统特征性的表面标记,本实验通过人CD14正选试剂盒,应用免疫磁珠法分离单核细胞,CD14阳性细胞率从分选前的10%提高到85.8%,得到了高纯度的单核细胞。在人CD14正选试剂盒中,抗CD14抗体克隆号为BA-8,免疫磁珠分选后,一些抗原位点已被抗体封闭,所以在进行流式仪检测CD14+细胞纯度时,选用了克隆号为MoP9的抗CD14抗体,结果可以看出,该克隆抗体能跟CD14抗原的其他位点结合,较好地反映出细胞表面CD14抗原的表达量。
体外培养的单核细胞具有很强的可塑性,在GM-CSF、IL-4以及肝素刺激下,单核细胞可向树突状细胞分化[8],在M-CSF刺激下可诱导单核细胞向巨噬细胞分化[2],原因是M-CSF可诱导细胞产生活性氧(ROS),进而导致磷酸酶SHP1氧化,氧化的磷酸酶可通过PI3K/AKT信号转导通路促进单核/巨噬细胞的增殖分化[9]。加上含有高浓度同源血清来替代胎牛血清的培养体系则可以成功培养出巨噬细胞[10]。基于这些因素,本实验用10%人AB血清来替代胎牛血清,再加上10 ng/ml M-CSF刺激,成功培养了大量巨噬细胞。细胞培养到第7天时,巨噬细胞牢固贴壁在培养板上,而一些未分化的单核细胞及树突状细胞将脱壁悬浮生长[6],有利于巨噬细胞的进一步纯化。
CD14+细胞经体外培养7 d后,收集巨噬细胞,本实验用TrypLE来替代Trypsin消化15~20 min,TrypLE对细胞损伤小,无需Trypsin抑制剂,更有利于下一步巨噬细胞的功能检测。用流式细胞仪检测巨噬细胞培养第7天时CD14阳性率,表明CD14阳性率依然很高,但也有一大部分细胞不表达CD14分子。从显微镜观察细胞形态来看,绝大部分细胞呈现巨噬细胞形态,与文献报道的形态相一致[5]。Erbel等[4]也研究表明,单核细胞源巨噬细胞培养后CD14分子下调,而白细胞分子CD45RO保持不变。巨噬细胞的吞噬活性是巨噬细胞的重要功能特性,也是巨噬细胞发挥抗肿瘤作用的重要途径。本研究对培养分化得到的巨噬细胞进行吞噬淋巴瘤Raji细胞实验,表明体外培养的巨噬细胞吞噬Raji细胞的功能强,83%的CD14+巨噬细胞吞噬了Raji细胞。但在组织微环境中,由于巨噬细胞受到其他细胞分泌因子的刺激等众多因素的影响,其功能也发生相应变化[11]。体外检测巨噬细胞吞噬Raji细胞的实验方法建立也有助于药物开发,研究人员认为CD47抗体是一种新型抗淋巴瘤药物,巨噬细胞表达Fc受体,识别包被于淋巴瘤细胞上的CD47抗体Fc段,加强了巨噬细胞吞噬淋巴瘤细胞功能[12]。本文从外周血中分离了高纯度的CD14+单核细胞,诱导形成的巨噬细胞具有很好的吞噬淋巴瘤细胞的功能,为进一步研究巨噬细胞生物学作用、新型抗癌药物开发创造了条件。
[1]赵 阳,赵 勇.单核-巨噬细胞起源及发育分化的特征与分子调控[J].中国免疫学杂志,2014,30(1):126-132.
[2]Geissmann F,Manz MG,Jung S,et al.Development of monocytes,macrophages,and dendritic cells[J].Science,2010,327(5966): 656-661.
[3]Cheng SM,Chang SJ,Tsai TN,et al.Differential expression of distinct surface markers in early endothelial progenitor cells and monocyte-derived mocrophages[J].Gene Expr,2013,16(1):15-24.
[4]Erbel C,Rupp G,Helmes CM,et al.An in vitro model to study heterogeneity of human macrophage differentiation and polarization[J].J Vis Exp,2013,76:e50332.
[5]Kang JW,Choi SC,Cho MC,et al.A proinflammatory cytokine interleukin-32β promotes the production of an anti-inflammatory cytokine interleukin-10[J].Immunology,2009,128(1):e532-540.
[6]刘剑雯,曾志勇,陈君敏.人外周血耐受性树突状细胞的诱导培养及其DC-STAMP的表达研究[J].中国免疫学杂志,2013,29(5):474-480.
[7]闻一鸣,徐金亭,向军俭.免疫磁珠富集技术进展[J].中国免疫学杂志,2013,29(1):88-92.
[8]Delirezh N,Majedi L,Rezaei SA,et al.Generation of mature monocyte-derived dendritic cells in the presence of heparin and monocyte conditioned medium:phenotypic and functional comparison[J].Iran Biomed J,2011,15(3):79-84.
[9]Choi HK,Kim TH,Jhon G,et al.Reactive oxygen species regulate M-CSF-induced moncyte/macophage proliferation through SHP1 oxidation[J].Cell Signal,2011,23(10):1633-1639.
[10]Hodrea J,Demény MA,Majai G,et al.Transglutaminase 2 is expressed and active on the surface of human monocye-derived dendritic cells and macrophages[J].Immunol Lett,2010,130(1): 74-81.
[11]吴媛媛,李 龙,沈萍萍.巨噬细胞替代激活及调控[J].中国细胞生物学学报,2011,32(2):197-203.
[12]Chao MP,Alizadeh AA,Tang C,et al.Anti-CD47 antibody synergizes with rituximab to promote phagocytosis and eradicate nonhodgkin lymphoma[J].Cell,2010,142(5):699-713.
[收稿2014-08-20 修回2014-09-10]
(编辑 倪 鹏)
Culture and functional identification of macrophages from human peripheral blood
LIN Wei-Ming,DAI Ai-Ling,Yin Hui-Fang,YANG Xiao-Yan.College of Life Sciences of Longyan University,Longyan 364000,China
Objective:To isolate monocytes from human peripheral blood mononuclear cells(PBMC),induce macrophages,and identify the function of macrophages.MethodsMonocytes were isolated from PBMC using magnetic activated cell sorting(MACS)anti-CD14 microbead.Sorted CD14+and CD14-cells were checked by flow cytometer to evaluate the efficiency of sorting.The sorted CD14+cells were cultured in IMDM media with 10%human AB serum and 10 ng/ml M-CSF for 7 days to generate macrophages,which were identified by morphological features and phagocytosis function.ResultsA high purity of monocytes was obtained by MACS anti-CD14 microbead.The percentage of CD14+cells was 10%and 85.8%before and after sorting,respectively.The macrophages were approximately 40-45 μm in maximum diameter and had the fried egg colony morphological features after 7 days culture.The lymphoma (Raji)cells were efficiently engulfed by macrophages.ConclusionThe high purity of CD14+monocytes is isolated from PBMC and monocyte-derived macrophages efficiently engulfed lymphoma cells.
Macrophages;Magnetic activated cell sorting;Culture;Functional identification
R292.12
A
1000-484X(2015)01-0086-04
10.3969/j.issn.1000-484X.2015.01.018
①本文受福建省教育厅JK类项目(No.JK2011053)、福建省科技计划重点项目(2013N0026)资助。
②福建省预防兽医学与生物技术高校重点实验室(龙岩学院),龙岩364000。
林炜明(1976年-),男,博士,副教授,主要从事动物免疫学方面研究,E-mail:wmlin925@126.com。
·征稿征订·
