不同寄主来源的马铃薯Y病毒群体遗传结构的比较分析
2015-02-04常飞邹文超高芳銮沈建国詹家绥
常飞, 邹文超, 高芳銮, 沈建国, 詹家绥
不同寄主来源的马铃薯Y病毒群体遗传结构的比较分析
常飞1, 邹文超1, 高芳銮1, 沈建国2, 詹家绥1
1. 福建省植物病毒学重点实验室, 福建农林大学植物病毒研究所, 福州 350002;2. 福建出入境检验检疫局检验检疫技术中心, 福州 350001
文章以马铃薯Y病毒(, PVY)和基因为分子标记,比较分析烟草和马铃薯两个寄主的PVY遗传多样性和群体分化,并评估突变、选择、基因流等遗传力所起的作用。通过和基因计算获得的烟草和马铃薯群体分化指数ST分别为0.116和0.120,且统计检验差异显著,表明烟草和马铃薯寄主的PVY之间中度分化。变异分析结果显示,烟草分离物和基因的核苷酸序列一致性分别为85.2%~100%和76.5%~100%,而马铃薯分离物的和基因的核苷酸序列一致性分别为95.7%~100%和93.0%~100%,表明烟草PVY变异程度高于马铃薯。同时,基因内检测到大量的净化选择位点,表明该基因大部分位点的变异为有害突变,在进化过程中被剔除。此外,基因内还检测到两个显著正向选择位点,表明这两个位点的变异为有益突变,有利于病毒的生存竞争。在基因中未检测到显著的选择位点,表明该基因上的变异基本不受自然选择影响。通过和基因计算烟草和马铃薯群体间的基因流值分别为1.91和1.83,表明这两个群体间存在较强的基因交流。以上结果表明,来源于烟草和马铃薯寄主的PVY遗传差异显著,突变、自然选择以及基因流都影响两者的遗传多样性及遗传分化程度。
马铃薯Y病毒;基因;基因; 遗传变异
病原物的群体遗传多样性是体现其对环境适应力的重要指标,高遗传多样性的病原物具有相对强的生存能力和进化优势,能更快地适合新的寄主和生存环境[1]。在寄主、病原物和环境的病害三角关系中,病害的发生、流行、发展是3者相互作用的产物,而病原物本身又是由复杂的、动态结构的个体组成。随着病原物群体结构的时空变化,这种特定的互作关系也必将随之变化。因此,研究PVY功能基因的遗传变异有利于了解植物病毒的发生、流行和监测,对持续性的植病防治具有重要的指导意义。
马铃薯Y病毒(, PVY)在全球各地广泛分布,是造成马铃薯、烟草生产中重要经济损失的病毒之一,近10年来在日本和我国等亚洲地区呈不断上升趋势[2~8]。PVY寄主范围广,侵染种薯后导致马铃薯退化、产量降低,严重时可减产80%以上[9~11]。PVY也可大幅度影响烟草产量和质量[12]。最近几年,烟草PVY在贵州省(包括黔南烟区)大面积流行,并在局部地区造成毁灭性损失[13]。随着农产品贸易的全球化,PVY变异频繁,不断有新的重组分离物产生,并在全球不同地区蔓延[14,15],对马铃薯和烟草生产造成更大危害[16]。
PVY是马铃薯Y病毒科()马铃薯Y病毒属()的代表成员,其病毒粒体为弯曲线状,每个病毒粒体都含有一套完整的基因组[17]。该基因组为正单链 RNA,长约9.7 kb,包含两个开放阅读框(ORF),两端含有非编码区(UTR)。基因组翻译时,大的ORF先生成一个多聚蛋白质(Polyprotein),然后由病毒自身编码的蛋白酶将多聚蛋白质裂解为 P1、HC-Pro、P3 等10个蛋白[17]。小的ORF相对于P3以+2相位移码翻译PIPO蛋白[18],该蛋白的发现改变了过去PVY基因组只编码10个蛋白的认识[19]。通过这两种不同的表达策略,PVY 基因组最终产生一系列成熟的多功能蛋白,使不同基因的遗传变异呈现多样化。
PVY是当前分子植物病理学研究的十大植物病毒之一[20],但对于其群体遗传的相关研究,则是近年来才陆续开展的[5,7]。我国学者对PVY功能基因的分子变异等做了一些基础研究[8,18,21,22],但关于PVY遗传多样性的研究,尤其烟草和马铃薯两个不同寄主来源的PVY遗传变异,迄今仅Tian等[23]对我国山东、河南、安徽等省的 25个PVY烟草分离物,基于基因和基因进行遗传多样性研究,研究结果表明PVY在马铃薯和烟草两种寄主之间频繁扩散。
P3通过多聚蛋白裂解出来的、约43 kDa的非结构蛋白,是中变异最大的蛋白之一,在病毒复制、侵染和抗性及胞间运动中起着重要的作用[24],而PIPO并不单独表达而是以P3N-PIPO融合蛋白的方式表达[19]。目前国内外尚未有基于和基因开展PVY遗传变异研究的报道。为此,本文以PVY分离物的和基因为研究对象,应用群体遗传学的理论,明确作物寄主(烟草和马铃薯)对PVY遗传多样性形成的影响,分析突变、基因重组、自然选择、基因流等遗传力在PVY进化中的作用,旨在为PVY的流行、监测以及防控奠定理论依据。
1 材料和方法
1.1 PVY样品
PVY疑似样品于2011~2012年间随机采自陕西、黑龙江、湖南等省马铃薯主要种植区,经前期透射电镜观察、基因RT-PCR扩增确定为PVY毒源后[8],18份PVY阳性样品保存于–80℃中。
1.2 方法
1.2.1基因扩增与克隆
采用Trizol法从以上18份PVY阳性样本提取总RNA,具体步骤参考试剂盒说明书进行。从提取的总RNA中取出2 μL,用oligo(dT)18作为引物按照东洋纺RT试剂盒的说明书进行反转录得到PVY全基因组的cDNA。采用简并引物P3-F/P3-R[14]、PIPO-F/PIPO-R[19]分别对和基因进行扩增,引物由南京金斯瑞生物技术有限公司合成。和基因的预期目的片段大小分别为1095 bp和235 bp。
PCR扩增采用25 μL反应体系:2×Easytaq SuperMix 12.5 μL,正向引物(10 μmol/L)1 μL,反向引物(10 μmol/L)1 μL,ddH2O 8.5 μL,cDNA 2 μL。PCR反应条件为:94℃预变性5 min;94℃变性 30 s,55℃(50℃)退火30 s,72℃延伸1 min,共35个循环;最后一轮循环后72℃延伸10 min。PCR扩增产物通过1%的琼脂糖凝胶电泳进行检测,鉴定片段大小正确后将纯化的PCR产物连接到pMD19-T克隆载体上,并转化到Trans-T1感受态细胞中,经过蓝白斑筛选,选取白色的单菌落PCR鉴定获得阳性重组质粒,随机选取阳性克隆子委托上海立菲生物技术有限公司测序,通过测序峰图及序列比对分析排除由PCR扩增引起的突变。
1.2.2和基因的序列
测序获得的序列,通过DNAMAN 8(Lynnon, Canada)等软件进行拼接,MEGA5软件[25]中基于密码子(Codons)多重比对,核苷酸翻译及氨基酸序列校正。另外,从GenBank上下载已报道的18个PVY中国分离物(表1),其中16个来自于烟草寄主,2个来自马铃薯寄主(其中CF_YL21为本实验室前期实验获得),加上本研究中的18个分离物,共36个,用以比较来自不同寄主PVY的遗传多样性。
蛋白的跨膜区、保守区等功能结构域分别通过TMHMM在线服务器 (http://www.cbs.dtu.dk/services/TMHMM/)、MEME数据库(http://meme.nbcr.net)和InterProScan在线服务器(http://www.ebi.ac.uk/InterProScan/)进行分析。
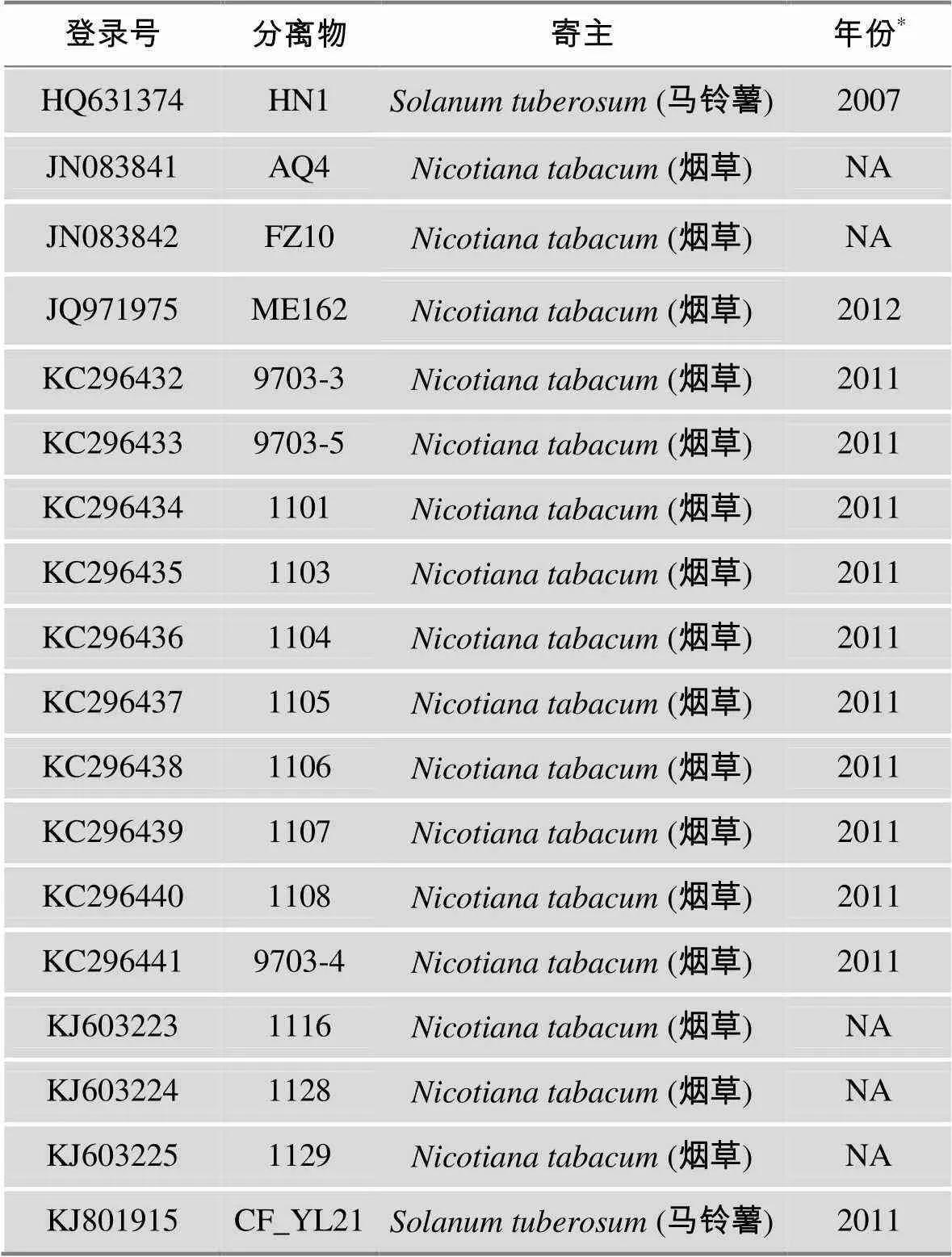
表1 PVY参考序列及其GenBank登录号
注:*NA=未知。
1.2.3 遗传多样性参数评估及群体遗传分化检验
使用DnaSP 5.10[26]计算单倍型多样性(Haplotype diversity,)和核苷酸多样性(Nucleotide diversity, π),Arlequin 3.5[27]计算群体间的ST值,并根据ST值判断群体的分化程度。当ST值介于0~0.05 时,表明群体轻微分化;当ST值介于0.05~0.15时,表明中度分化;当ST值介于0.15~0.25,表明高度分化;当ST值超过0.25时,表明严重分化。群体间的遗传分化显著水平分别采用K检验、检验和nn检验通过排列检验法(1000 permutations)进行 判断。
1.2.4和基因的分子变异
多重比对后的和基因的核苷酸序列使用Bioedit生成序列一致性矩阵,并通过R程序包生成两个基因的序列一致性箱体图(Boxplot)。核苷酸序列的多态性位点、简约信息位点、单态变异位点使用MEGA 5[25]进行统计。
为揭示蛋白中氨基酸变异位点的分布特征,使用Rate4Site[28]分别计算P3和PIPO蛋白的氨基酸保守性分值(Conservation scores)。分值大小与蛋白质保守性成反比,分值越低,表明蛋白在进化上越保守,相反亦然。分析时,先剔除含有插入和缺失的序列,使用MEGA 5[25]的NJ算法基于P3和PIPO蛋白的氨基酸序列分别构建系统发育分育树,将其作为蛋白质保守性分析的初始树。
1.2.5 选择压力分析
基因的选择压力分别采用FEL(Fixed effects likelihood)、IEFL(Internal branches fixed-effects likelihood)、MEME(Mixed effects model of evolution)3种方法通过HyPhy在线服务器(http:// www.datamonkey.org)基于密码子(Codon)水平进行检验。选择方向根据值(N/S,即非同义替换-同义替换速率的比值)大小判断:当>1且模型具显著性差异时,说明为正向选择(Positive selection);当1>>0之间时,则说明是净化选择(Purifying selection);当=1时,则说明是不受选择[29]。
为检验PVY的遗传变异是否具有寄主特异性时,使用BEAST v2.1.3[30]分别对和基因进行贝叶斯分析。分析前,位点模型(Site Model)及相关参数根据jModeltest v2.14[31]计算获得。同时,为确保所有参数的收敛性(有效样本大小ESS>200),MCMC 共运行了1×108代,树后验分布(The posterior distribution of trees)中的样本树(Sample trees)通过BaTS v2.0计算的3个统计参数:关联系数(Association index,)、简约分值(Parsimony score,)和最大单系分支(Maximum monophyletic clade,)。当3者均≤0.05时,说明来自不同寄主的PVY分离物与其寄主来源密切相关,表明其遗传变异具有寄主特异性。
1.2.6 基因流
由于和基因内没有重组,因而采用群体间的值[32]大小来衡量基因流。群体间基因流的方向和数值,则通过Migrate-n 3.6[33]计算,分别采用 20条短链(Short chains)抽样5000 次和5个短链抽样50 000次进行分析。
2 结果与分析
2.1 P3和pipo基因的序列特征
使用简并引物P3-F/P3-R、PIPO-F/PIPO-R分别扩增到的PCR产物与预期的目的片段大小相一致,分别约为1095 bp(图1A)和235 bp(图1B)。18个分离物及阳性对照均成功扩增到目的基因片段,阴性对照(健康马铃薯叶片)和空白对照均未扩增到相应的片段。RT-PCR扩增获得的目的片段克隆、测序后,经DNAMAN、BLAST分析,确定基因核苷酸序列长度为1095 bp(GenBank登录号为KP132956- KP132973),编码365个氨基酸长度的P3蛋白;基因核苷酸序列长度存在差异,CF_JN05、CF_JN08、CF_JN09和CF_JN22 4个分离物的序列长度为222 bp,其余的均为231 bp(GenBank登录号分别为KP132974~KP132991)。该基因的5′端保守基序(Motif)均为G2A7,翻译生成的PIPO蛋白第一个氨基酸为赖氨酸(K),编码72 aa和75 aa两种长度的PIPO蛋白(图2)。
TMHMM2.0预测结果显示,P3蛋白内存在3个典型的跨膜螺旋序列,分别位于第50~72,第85~103和第269~291位aa之间。PIPO蛋白内未检测到跨膜区。
2.2 PVY的遗传多样性及群体分化
36个分离物的基因序列中共发现31种单倍型,其中27种单倍型仅见于单个分离物,其余4种单倍型为多个分离物共有。同样,36个分离物的基因序列中共发现12种单倍型,其中6种单倍型仅见于单个分离物,其余6种单倍型为多个分离物共有。和基因的值均大于0.5、值均高于0.005,表明我国PVY群体遗传多样性高(表2),且烟草寄主上的PVY遗传多样性高于马铃薯寄主。
以和基因为分子标记,来自马铃薯和烟草的PVY群体ST值分别为0.116和0.120,且ST、、nn3种统计检验显著(<0.05)(表3),表明马铃薯和烟草寄主的PVY群体间中度分化,差异显著。
2.3 P3和pipo基因的分子变异
比对后的36条PVY中国分离物基因序列长度为1096 bp,序列比对分析显示,来源于马铃薯寄主的基因核苷酸序列一致性为95.7%~99.7%,平均值为97.6%,而来源于烟草寄主的基因核苷酸序列一致性为85.2%~100%,平均值为96.4%。从图3A中可以看出,相比较于马铃薯群体,烟草群体的基因核苷酸序列变异幅度更大;同样,来源于马铃薯寄主的基因核苷酸序列一致性为93.0%~100%,平均值为97.5%,而来源于烟草寄主的基因核苷酸序列一致性为76.5%~100%,平均值为93.8%。从图3B中也可以看出,烟草群体的基因核苷酸序列变异程度远高于马铃薯群体。
在36条基因核苷酸序列中,其中插入和缺失各1条,提前出现终止密码子3条,共包括222个(20.26%)多态性位点(Polymorphic sites),其中88个简约信息位点(Parsimony informative sites),134个单态位点(Singleton variable sites)。这些变异位点多数位于密码子的第3位点(157个)仅少量位于密码子的第1位点(43个)和第2位点(22个)。翻译后的P3蛋白共65个变异的氨基酸位点,特异性氨基酸变异位点共有17个(图4A),其中来自马铃薯寄主的PVY分离物CF_JN5B(T286A)和CF_JN7B(A75E)各含有1个,CF_YL21(L191F和R300K)和CF_HLJ26 (Q293H和Y220H)各有2个,CF_JN010含有3个,分别为S56A、D152G、E305G;来自烟草寄主的PVY分离物1103分离物有1个(L33V),而ME162则含有7个,分别为N176D、Y196H、T211I、N221D、R230G、F250I和V276I,显示该分离物与其他分离物显著的差异性。
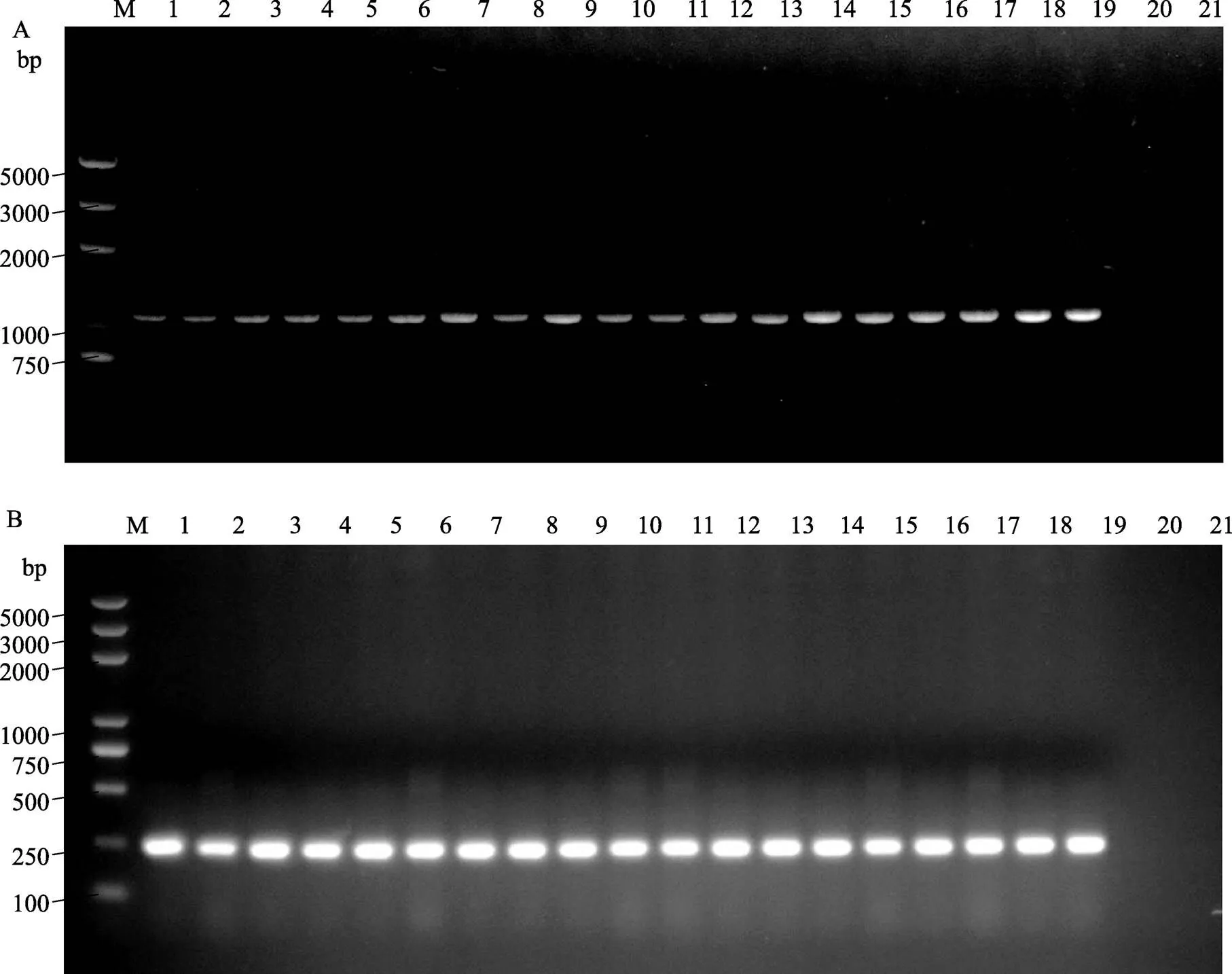
图1 PVY P3和pipo基因的RT-PCR扩增
M:D2000plus DNA分子量标准; 泳道1~18:中国分离物PCR产物; 19~21:阳性对照、阴性对照和空白对照。A:基因;B:基因。

图2 PVYPIPO蛋白的多重序列比对
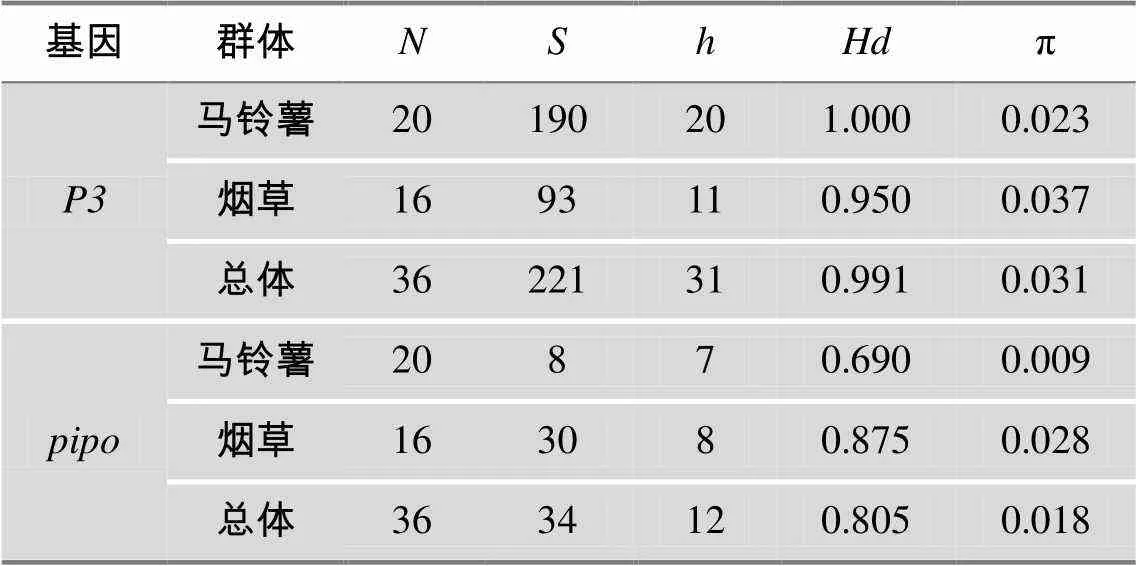
表2 遗传多样性参数统计
<
s序列数;变异位点数;单倍型数;单倍型多样性;核苷酸多样性。
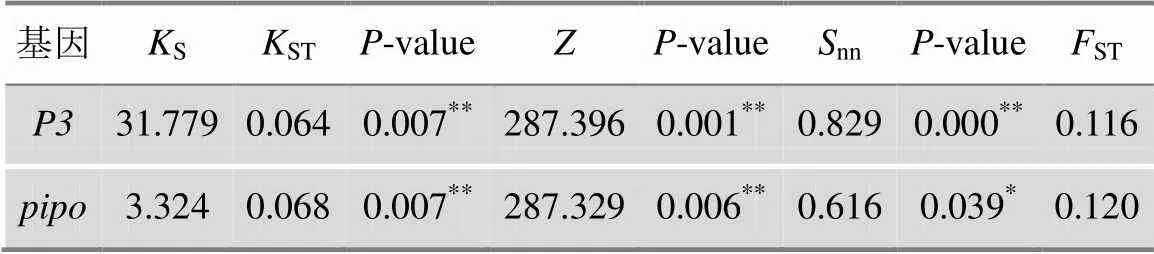
表3 PVY的群体分化检验
S=平均核苷酸差异;ST=群体遗传分化系数;*:差异显著;**:差异极显著。
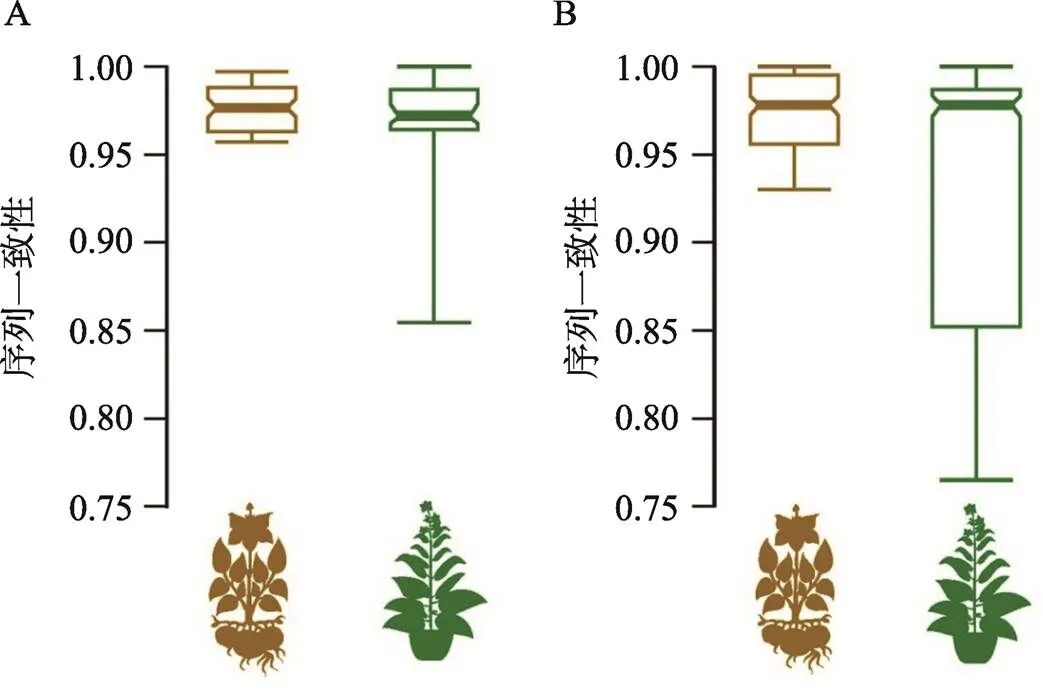
图3 来自不同寄主的P3基因(A)和pipo基因(B)的核苷酸序列一致性分布
在36条基因核苷酸序列中,无碱基插入/缺失现象,所有的核苷酸变异都是碱基置换,共包括40个(17.32%)多态性位点(Polymorphic sites),其中12个简约信息位点(Parsimony informative sites)和28个单态位点(Singleton variable sites)。与基因不同,基因这些变异位点多数位于密码子的第1位点(20个),其次是位于密码子的第3位点(12个),少量位于密码子的第2位点(8个)。翻译后的PIPO蛋白共65个变异的氨基酸位点,特异性氨基酸变异位点共有9个(图4B),其中来自马铃薯寄主的PVY分离物CF_JN22(E12V)和CF_YL21(I21F)各有1个;来自烟草寄主的PVY分离物ME162则含有7个,分别为K5R、S5P、V25A、E31A、E46K、Q50R和G64S,显示出该分离物与其他分离物在氨基酸序列存在着显著的差异。
2.4 选择压力
在马铃薯和烟草群体的基因中,FEL法各检测14个和26个净化选择位点(表4),但仅在马铃薯群体中检测到2个正向选择位点;IFEL法分别检测到4个和1个的净化选择位点,在两个群体中均未检测正向选择位点;而MEME法在两个群体的基因均检测到1个显著的正向选择位点。
寄主的BaTS检验显示,来自马铃薯分离物的基因和来自烟草分离物的基因的、、统计检验呈显著水平(值小于0.05),而来自烟草分离物的基因和来自马铃薯分离物的基因的3个统计检验不显著(表5),说明PVY分离物的寄主特异性不明显,表明PVY的适应性进化仅在一定程度上受寄主驱动。
2.5 基因流
由于基因受选择压力影响,为了排除自然选择对基因流的影响我们采用密码子的第3个位点算基因的基因流。通过基因和基因的基因流参数评估(表6),可知烟草和马铃薯群体间的每个世代的平均基因流值分别为1.91和1.83,均大于1,表明这两个群体之间存在频繁的基因交流。基因由马铃薯遗传迁移至烟草、烟草迁移至马铃薯的的即时基因流分别为747.8和154.9;基因由马铃薯遗传迁移至烟草、烟草迁移至马铃薯的即时基因流分别为380.1和149.4。
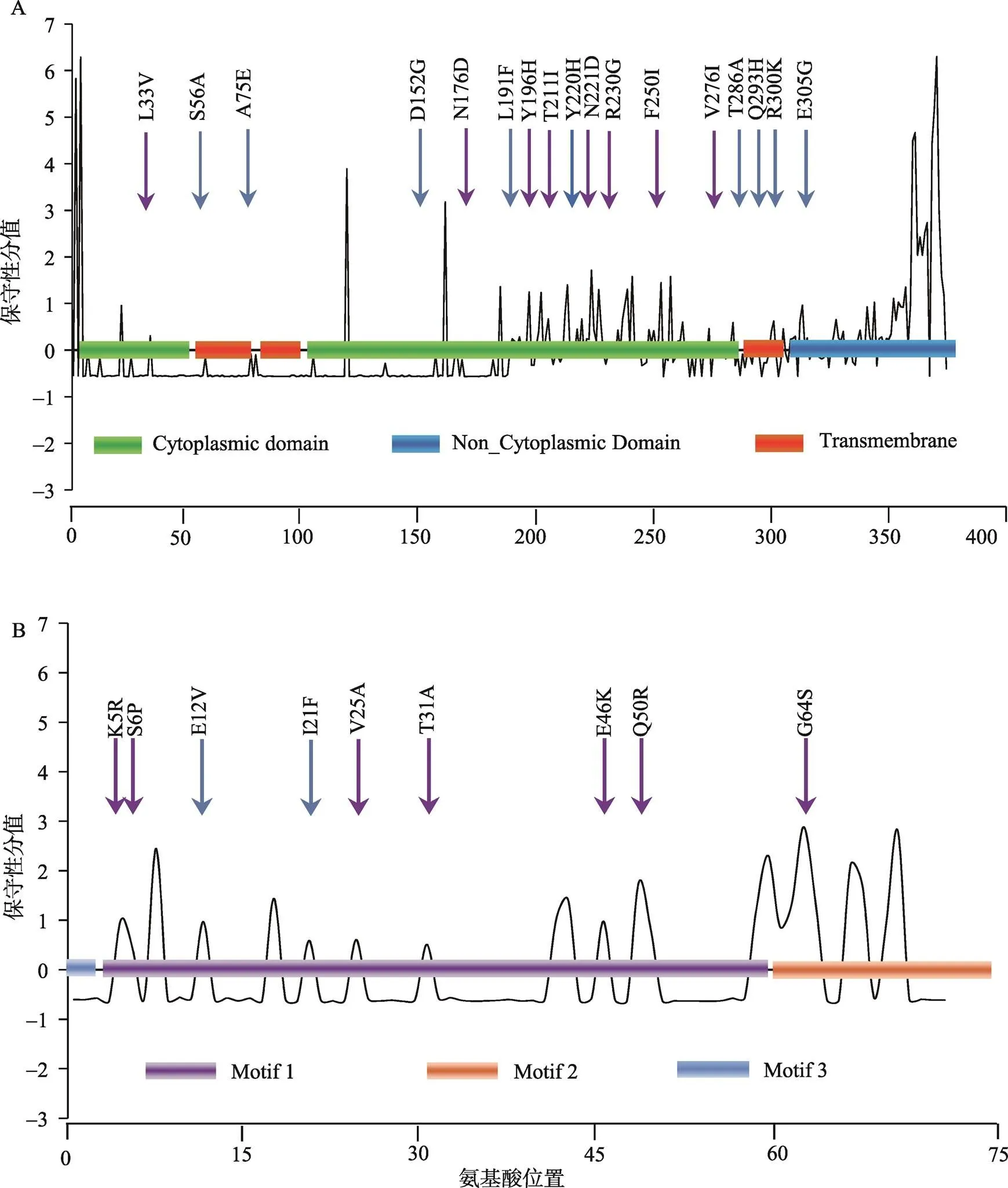
图4 P3和PIPO蛋白中特异氨基酸变异位点的分布
A:P3 蛋白;B:PIPO蛋白。蓝色箭头和紫色箭头分别为马铃薯分离物和烟草分离物。
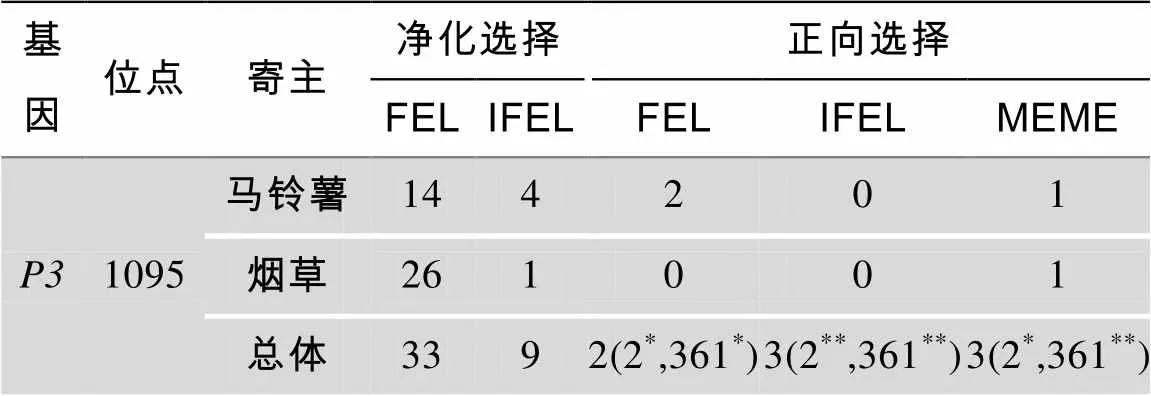
表4 选择压力位点检测
*: 0.05<<0.1; **: 0.01<<0.05。
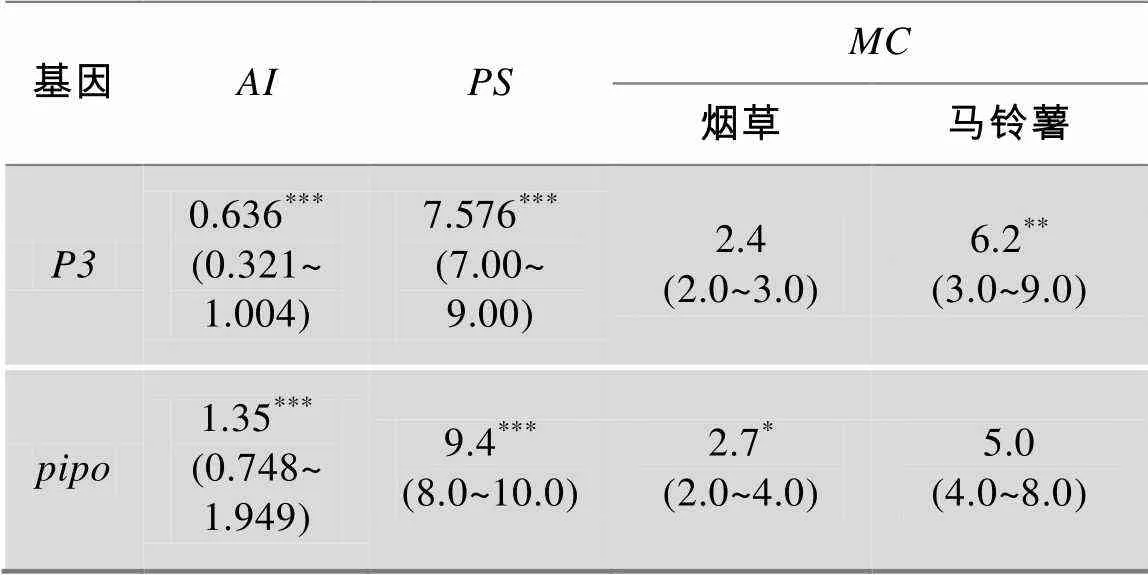
表5 PVY的寄主特异性检验
*: 0.05<<0.1; **: 0.01<<0.05; ***:<0.01。
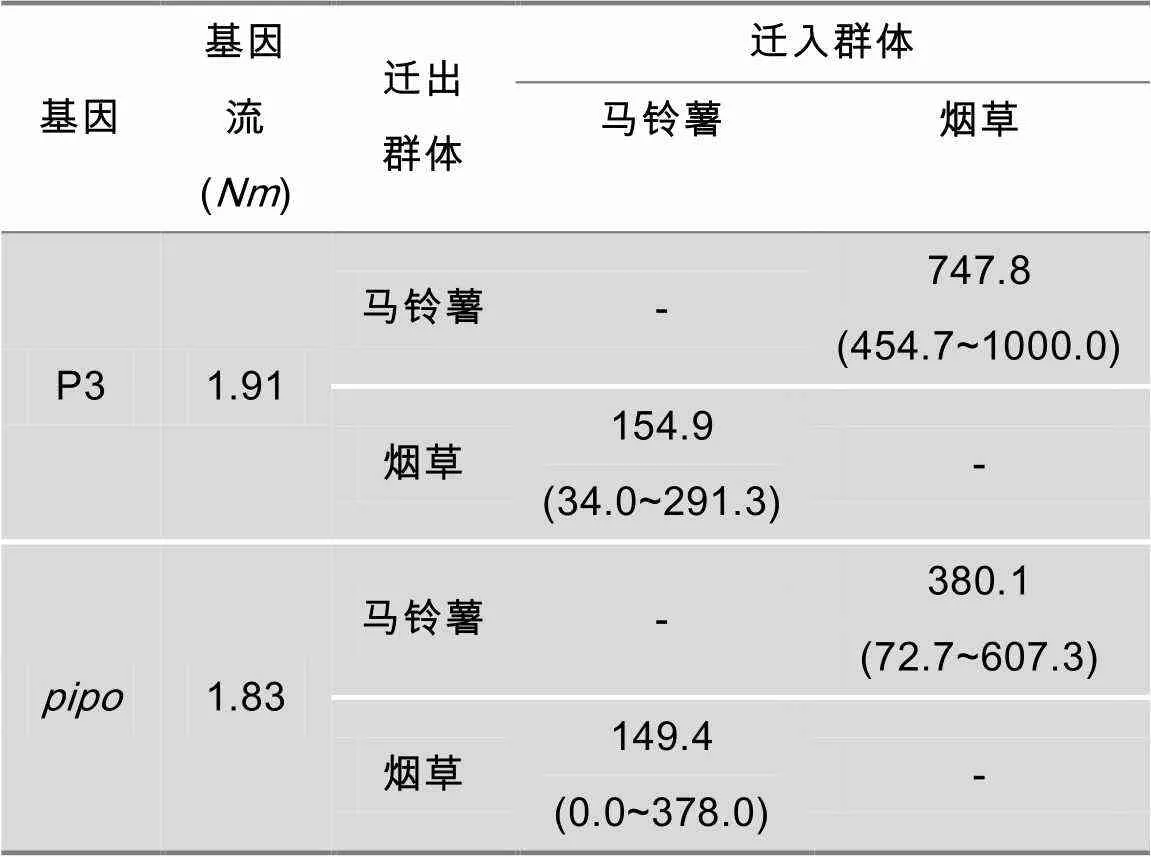
表6 烟草和马铃薯寄主间的PVY遗传迁移值*
*: 每一代的迁移数量。
3 讨论
高度变异是RNA病毒的典型特征之一,这种特征也表现在不同寄主来源的分离物之间,尤其来自烟草寄主的分离物,其和基因核苷酸序列一致性为85.2%~100%和76.5%~100%,基因的核苷酸一致性范围之所以大于基因的可能与我们基因样本的长度变异有关。和基因序列间的核苷酸差异临近或超过了病毒种划分的一致性阈值,即:同一种病毒的全基因组核苷酸序列一致性不低于85%,表明烟草寄主的PVY和基因高度变异,这种高度变异可能与以下几个方面密切相关。
3.1 寄主适应性
病原物承受寄主和环境的双重压力下,通过突变、重组等产生大量变异以快速适应不同的寄主。前人通过对63个马铃薯和4个烟草寄主的PVY分离物基因进行变异分析,结果表明基因的长度变异同时具有寄主特异性和地区特异性[34]。本文通过和基因的BaTS分析(表5)显示烟草和马铃薯寄主的寄主特异性检验均不同时显著,表明PVY中国分离物的适应性进化仅在一定程度上受寄主驱动。
3.2 选择压力
在混合群体(马铃薯和烟草)中,基因的净化选择位点数远高于正向选择位点数,说明PVY的基因中许多位点的突变都是有害的,在进化过程这些变异会被剔除。本文采取3种方法均在基因检测2个显著的正向选择压力位点,表明这些位点的变异有利于该病毒的生存竞争,在进化过程中这些变异会被不断积累。同样,FEL法等3种方法在基因中,均未检测出显著的选择压力位点,说明基因的密码子不受自然选择影响,以中性进化为主,这与高芳銮等[18]的研究结果相一致。
3.3 基因流
马铃薯是PVY的初始寄主,烟草上的PVY除了碱基突变外(图4),通过基因流可以从马铃薯上的PVY中获得大量遗传变异(表6),从而增加了其遗传多样性。基因流的分析结果在一定程度上也解释了Tian等[23]的结果,即:PVY在马铃薯和烟草两种寄主之间频繁扩散,主要源于两种寄主间的基因流并且PVY的基因流主要由马铃薯迁移到烟草。因此表明基因流是缓解烟草和马铃薯寄主PVY遗传分化的主要因素。
前人研究结果表明的基因变异非常大,而分子变异分析结果(图4)显示,同一病毒不同寄主上的基因变异也非常大。究其原因,这可能与其蛋白多功能性有关,因为P3蛋白不但参与的寄主细胞内定位、复制、胞间运动和症状形成[35~38],同时P3蛋白还是寄主抗性的主要决定因子[36,39,40]。正由于这种功能的多样性在病毒的生活史中参与不同的过程和阶段,从而使其变异程度增加。
[1] 祝雯, 詹家绥. 植物病原物的群体遗传学. 遗传, 2012, 34(2): 157–166.[DOI]
[2] Ohshima K, Sako K, Hiraishi C, Nakagawa A, Matsuo K, Ogawa T, Shikata E, Sako N. Potato tuber necrotic ringspot disease occurring in Japan: its association withnecrotic strain., 2000, 84(10): 1109–1115. [DOI]
[3] 孙琦, 张春庆. PVYN与PVYO病毒RT-PCR快速检测体系研究. 中国农业科学, 2005, 38(1): 213–216. [DOI]
[4] Lorenzen J, Nolte P, Martin D, Pasche JS, Gudmestad NC. NE-11 represents a new strain variant class of., 2008, 153(3): 517–525. [DOI]
[5] Ogawa T, Tomitaka Y, Nakagawa A, Ohshima K. Genetic structure of a population ofinducing potato tuber necrotic ringspot disease in Japan; comparison with North American and European populations., 2008, 131(2): 199–212. [DOI]
[6] Hu XX, Nie XZ, He CZ, Xiong XY. Differential pathogenicity of two different recombinant PVYNTNisolates inis likely determined by the coat protein gene., 2011, 8: 207. [DOI]
[7] Ogawa T, Nakagawa A, Hataya T, Ohshima K. The genetic structure of populations ofin Japan; based on the analysis of 20 full genomic sequences., 2012, 160(11–12): 661–673. [DOI]
[8] 高芳銮, 沈建国, 史凤阳, 方治国, 谢联辉, 詹家绥. 中国马铃薯Y病毒的检测鉴定及基因的分子变异. 中国农业科学, 2013, 46(15): 3125–3133. [DOI]
[9] Glais L, Tribodet M, Kerlan C. Genomic variability in(PVY): evidence that PVYNW and PVYNTNvariants are single to multiple recombinants between PVYOand PVYNisolates., 2002, 147(2): 363–378. [DOI]
[10] Nolte P, Whitworth J L, Thornton M K, McIntosh C S. Effect of seedborneon performance of Russet Burbank, Russet Norkotah, and Shepody potato., 2004, 88(3): 248–252. [DOI]
[11] Whitworth J L, Nolte P, McIntosh C, Davidson R. Effect ofon yield of three potato cultivars grown under different nitrogen levels., 2006, 90(1): 73–76. [DOI]
[12] 罗红香, 李余湘, 刘会忠, 徐明勇, 王林玉, 赵中汇, 何玉安, 李章海, 江彤. 贵州黔南烟草马铃薯Y病毒(PVY)株系的血清学鉴定. 中国烟草科学, 2012, 33(5): 60–62. [DOI]
[13] 余春英, 张西仲, 王定福, 李余湘, 罗红香, 蒙祥旭, 曾宪佛. 黔南烟区烟草马铃薯Y病毒病发病原因及防治措施. 安徽农业科学, 2010, 38(10): 5110–5112. [DOI]
[14] Quenouille J, Vassilakos N, Moury B.: a major crop pathogen that has provided major insights into the evolution of viral pathogenicity., 2013, 14(5): 439–452. [DOI]
[15] Gao F, Chang F, Shen J, Shi F, Xie L, Zhan J. Complete genome analysis of a novel recombinant isolate offrom China., 2014, 159(12): 3439–3442. [DOI]
[16] Rahman MS, Akanda AK. Performance of seed potato produced from sprout cutting, stem cutting and conventional tuber against PVY and PLRV.,2009, 34(4): 609–622. [DOI]
[17] King AM, Lefkowitz E, Adams MJ, Carstens EB. Virus taxonomy, ninth report of the international committee on taxonomy of viruses. Amsterdam: Elsevier Academic Press, 2012. [DOI]
[18] 高芳銮, 沈建国, 史凤阳, 常飞, 谢联辉, 詹家绥. 马铃薯Y病毒基因的分子变异及结构特征分析. 遗传, 2013, 35(9): 1125–1134. [DOI]
[19] Chung BYW, Miller WA, Atkins JF, Firth AE. An overlapping essential gene in the., 2008, 105(15): 5897–5902. [DOI]
[20] Scholthof KB, Adkins S, Czosnek H, Palukaitis P, Jacquot E, Hohn T, Hohn B, Saunders K, Candresse T, Ahlquist P, Hemenway C, Foster GD. Top 10 plant viruses in molecular plant pathology., 2011, 12(9): 938–954. [DOI]
[21] 李娜. 马铃薯Y病毒CP基因的分子变异[学位论文]. 保定: 河北农业大学, 2005. [DOI]
[22] 史凤阳, 高芳銮, 沈建国, 常飞, 詹家绥. 马铃薯Y病毒福建分离物基因的分子变异和结构特征. 遗传, 2014, 36(7): 713–722. [DOI]
[23] Tian YP, Liu JL, Zhang CL, Liu YY, Wang B, Li XD, Guo ZK, Valkonen JPT. Genetic diversity ofinfecting tobacco crops in China., 2011, 101(3): 377–387. [DOI]
[24] 崔晓艳, 陈新, 顾和平, 张红梅, 陈华涛, 袁星星. 马铃薯Y病毒属病毒P3和P3-PiPo蛋白功能研究进展. 微生物学通报, 2012, 39(1): 99–105. [DOI]
[25] Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods., 2011, 28(10): 2731–2739. [DOI]
[26] Librado P, Rozas J. DnaSP v5: a software for comprehensive analysis of DNA polymorphism data., 2009, 25(11): 1451–1452. [DOI]
[27] Excoffier L, Lischer HEL. Arlequin suite ver 3. 5: a new series of programs to perform population genetics analyses under Linux and Windows., 2010, 10(3): 564–567. [DOI]
[28] Mayrose I, Graur D, Ben-Tal N, Pupko T. Comparison of site-specific rate-inference methods for protein sequences: empirical Bayesian methods are superior., 2004, 21(9): 1781–1791. [DOI]
[29] Nielsen R. Molecular signatures of natural selection., 2005, 39: 197–218. [DOI]
[30] Bouckaert R, Heled J, Kühnert D, Vaughan T, Wu CH, Xie D, Suchard MA, Rambaut A, Drummond AJ. BEAST 2: a software platform for Bayesian evolutionary analysis., 2014, 10(4): e1003537. [DOI]
[31] Darriba D, Taboada GL, Doallo R, Posada D. jModelTest 2: more models, new heuristics and parallel computing., 2012, 9: 772. [DOI]
[32] Whitlock MC, McCauley DE. Indirect measures of gene flow and migration:ST≠ 1/(4+ 1)., 1999, 82: 117–125. [DOI]
[33] Beerli P. Comparison of Bayesian and maximum-likelihood inference of population genetic parameters., 2006, 22(3): 341–345. [DOI]
[34] Hillung J, Elena SF, Cuevas JM. Intra-specific variability and biological relevance of P3N-PIPO protein length in potyviruses., 2013, 13: 249. [DOI]
[35] Merits A, Guo DY, Järvekülg L, Saarma M. Biochemical and genetic evidence for interactions between potato A-encoded proteins P1 and P3 and proteins of the putative replication complex., 1999, 263(1): 15–22. [DOI]
[36] Johansen IE, Lund OS, Hjulsager CK, Laursen J. Recessive resistance inandpathotype resolved in a gene-for-cistron correspondence between host and virus., 2001, 75(14): 6609–6614. [DOI]
[37] Cui XY, Wei TY, Chowda-Reddy RV, Sun GY, Wang AM. TheP3 protein forms mobile inclusions via the early secretory pathway and traffics along actin microfilaments., 2010, 397(1): 56–63. [DOI]
[38] Lin L, Luo ZP, Yan F, Lu YW, Zheng HY, Chen JP. InteractionbetweenP3 and ribulose-1, 5-bisphosphate carboxylase/oxygenase (RubisCO) of host plants., 2011, 43(1): 90−92. [DOI]
[39] Tan ZY, Gibbs AJ, Tomitaka Y, Sánchez F, Ponz F, Ohshima K. Mutations ingenomes that have adapted to., 2005, 86(2): 501−510. [DOI]
[40] Suehiro N, Natsuaki T, Watanabe T, Okuda S. An important determinant of the ability ofto infectspp. and/oris in its P3 protein., 2004, 85(Pt 7): 2087−2098.[DOI]
(责任编委:岑山)
Comparative analysis of population genetic structure offrom different hosts
Fei Chang1, Wenchao Zou1, Fangluan Gao1, Jianguo Shen2, Jiasui Zhan1
Nucleotide sequences ofandgenes of(PVY) from potato and tobacco were compared to investigate the effect of hosts on the population genetic structure. Meanwhile, mutation, natural selection and gene flow were evaluated to determine evolutionary forces responsible for the population genetic dynamics. The fixation indices of population differentiation (ST) of PVY from tobacco and potato were 0.116 and 0.120, respectively with significant difference, suggesting a moderate genetic differentiation between the two populations. Genetic variation analysis showed that nucleotide identities inandgenes among the viral isolates from tobacco were respectively in the range of 85.2%-100% and 76.5%-100% while that from potato were respectively in the range of 95.7%-100% and 93.0%-100%, indicating higher genetic variation in PVY from tobacco than that from potato. Moreover, purifying selection was detected on the majority of polymorphic sites withingene, suggesting that most of mutations in the gene were harmful and consequently being eliminated by natural selection. Conversely, positive selection was detected on two polymorphic sites, suggesting that these two mutations were beneficial to PVY. Neither purifying nor positive selection was detected ingene, indicating neutral evolution of the gene. The values of gene flow () between PVY populations from tobacco and potato inandgenes were 1.91 and 1.83, respectively, suggesting strong gene flow also contributes significantly to the population genetic dynamics of PVY population. In summary, this study indicates there was a significant genetic variation in PVY hosted by tobacco and potato, and mutation, natural selection and gene flow all contribute to the genetic diversity and population dynamic of the virus.
;gene;gene; genetic variations
2014-11-13;
2015-01-21
福建省自然科学基金项目(编号: 2013J01088)和福建出入境检验检疫局科技项目(编号: FK2007-07)资助
常飞,硕士研究生,专业方向:马铃薯病毒。E-mail: changfei2010@yeah.net邹文超,专业方向:马铃薯病毒。E-mail: lovezoy@126.com常飞和邹文超并列第一作者。
詹家绥,教授,研究方向:病原群体遗传与进化。E-mail: jiasui.zhan@fafu.edu.cn
10.16288/j.yczz.14-396
2015-1-28 15:16:15
http://www.cnki.net/kcms/detail/11.1913.R.20150128.1516.001.html
