HIV-1初始传播病毒Vpr基因遗传变异对诱导G2期阻滞及细胞凋亡的影响
2015-02-04赵建元丁寄葳米泽云周金明魏涛岑山
赵建元,丁寄葳,米泽云,周金明,魏涛,岑山
HIV-1初始传播病毒基因遗传变异对诱导G2期阻滞及细胞凋亡的影响
赵建元1,2,丁寄葳2,米泽云2,周金明2,魏涛1,岑山2
1. 北京联合大学应用文理学院,北京 100192; 2. 中国医学科学院医药生物技术研究所,北京 100050
人免疫缺陷病毒(HIV-1)急性感染过程中,病毒的遗传多样性显著减少,往往只有一株或几株病毒可以建立有效感染,这种病毒被称为初始传播病毒(Transmitted/Founder virus)。病毒蛋白R(Vpr)是HIV-1的辅助蛋白之一,在病毒复制过程中起重要作用。研究初始传播病毒基因遗传变异与生物学特征对于阐明病毒建立感染的关键环节具有重要意义。文章利用流式细胞术分析了C亚型HIV-1初始传播病毒株与慢性感染株MJ4的 Vpr蛋白诱导细胞G2期阻滞和细胞凋亡的能力。结果显示,初始传播病毒ZM246和ZM247的Vpr诱导细胞G2期阻滞和细胞凋亡的能力显著高于慢性感染株MJ4 Vpr。氨基酸序列分析表明,初始传播病毒Vpr在第77、85和94位上存在高频突变。研究结果提示初始传播病毒可能在病毒感染早期,通过基因的遗传突变,提升病毒诱导细胞停滞G2期和细胞凋亡的能力,进而促进病毒在宿主体内的复制和传播。
人免疫缺陷病毒;初始传播病毒;病毒蛋白R();细胞G2期阻滞;细胞凋亡
病毒蛋白R (Viral protein R, Vpr)是人免疫缺陷病毒(HIV-1)基因编码的一个辅助蛋白,由96个氨基酸组成,分子量约14 kDa[1]。Vpr的三级结构含有3个两亲性的α螺旋(17~33,38~50及56~77 aa),这3个α螺旋围绕一个疏水核心,参与了Vpr和各种细胞蛋白能够相互作用[2,3]。寡聚化Vpr是其发挥功能的结构基础[4]。在Vpr C端的第73~96位氨基酸之间含有6个精氨酸,该区域与富含精氨酸蛋白质转导区(Protein transduction domains, PTD)相似,决定了Vpr跨细胞膜脂双层的能力[5~7]。
Vpr在HIV-1复制过程中执行着多种生物学功能,而Vpr功能的丧失将会导致HIV-1感染者疾病进程减慢[8]。Vpr通过与HIV-1的Gag p6相互作用被包装进入病毒颗粒,进而维持病毒逆转录过程的高保真性和促进前整合复合物的入核等[9,10]。此外,Vpr可以导致细胞周期停滞在G2期[11],诱导细胞凋亡[12],影响宿主和HIV-1基因表达等[13,14],是HIV-1发病机制和T细胞感染所必须的蛋白质[2]。
在HIV-1基因组中是高度保守的序列之一,不同毒株间的氨基酸序列相似性高达87%,且其C端都在诱导细胞周期G2/M期停滞及细胞调亡等方面执行重要作用[5]。HIV-1 Vpr的72~83氨基酸是线粒体毒性区域,可导致线粒体膜通透性增加,而73、77及80位氨基酸突变可使该活性丧失[2]。Deniaud等[15]研究也显示,84~96及73、77、80和85位氨基酸是Vpr诱导细胞周期G2停滞的关键性氨基酸。在HIV-1长期无进展者(LTNP)中约80% Vpr蛋白存在R77Q变异[16]。上述Vpr变异株诱导细胞凋亡的作用明显低于野生株,其机制可能与线粒体外膜损伤、激活caspase 9前体及caspase 3相关[17]。
在HIV-1粘膜传播过程中,病毒的遗传多样性是显著减少的,表现出严重的“遗传瓶颈”效应和有限的早期进化。研究发现,只有少数的一株或几株HIV-1病毒可以建立有效感染,这种病毒被称为初始传播病毒(Transmitted/Founder virus)[18]。研究初始传播病毒的生物学和早期进化特征,有助于阐明HIV-1建立感染的关键因素。目前,对初始传播病毒的研究多侧重于包膜蛋白的进化特征[19,20],而在基因变异及其功能变化方面鲜有报道。本研究分析了初始传播病毒Vpr诱导细胞G期阻滞和细胞凋亡的能力,发现初始传播病毒Vpr的活性明显高于同一亚型的慢性感染株MJ4。氨基酸序列分析表明,初始传播病毒Vpr在第77、85和94位上存在高频突变。本研究为阐明初始传播病毒基因变异和进化特征在HIV-1感染过程中的生物学功能奠定了一定的基础。
1 材料和方法
1.1 材料
pZM246F-10和pZM247Fv1为编码C亚型HIV-1初始传播病毒基因组的质粒,由NIH AIDS Reagent Program惠赠。人胚肾上皮细胞293T为本实验室保存。
1.2 方法
1.2.1 氨基酸序列比对及突变位点分析
根据NCBI报道的基因序列,选取C亚型HIV-1初始传播病毒株和慢性感染株(MJ4),利用DNA Star基因分析软件对氨基酸序列进行对比。
1.2.2 表达质粒的构建
以初始传播病毒株ZM246F-10和ZM247Fv1的基因组为模板,利用PCR扩增基因,所用的引物如表1所示。慢性感染株MJ4的基因由苏州金唯智生物科技有限公司合成。将所得到的基因片段分别连接到pcDNA4TM/TO/myc-His B表达载体(Invitrogen公司),得到带有c-myc-标签的Vpr表达质粒pZM246-Vpr、pZM247FV1-Vpr和pMJ4-Vpr,并通过测序验证。
1.2.3 细胞培养及转染
293T细胞培养于含10%胎牛血清(FBS)的DMEM培养基(Gibco公司)中。6孔板每孔接种细胞数为5×105个,培养24 h 后,采用转染试剂 Lipofectamine 2000(Invitrogen公司),按产品说明书方法转染相应的表达质粒。

表1 Vpr基因扩增引物序列
1.2.4 免疫蛋白印记(Western blot)检测Vpr蛋白的表达
将ZM246-Vpr(400 ng和800 ng)、ZM247Fv1- Vpr(600 ng和1200 ng)及MJ4-Vpr(300 ng和600 ng)分别转染293T细胞,48 h收获细胞。加入RIPA冰上裂解30 min,每10 min 涡旋振荡一次。然后,加入20 μL 5×蛋白上样缓冲液,得到细胞总蛋白样品。样品经聚丙烯酰胺蛋白电泳分离和转膜后,先后加入一抗Anti-c-myc(美国Sigma公司,1:3000)或β-actin(英国Abcam公司,1:5000),二抗山羊抗兔或山羊抗小鼠IgG(北京中杉金桥生物技术有限公司,1:5000),进行免疫蛋白印记(Western blot)分析。
1.2.5 流式细胞仪分析细胞周期
用PBS洗涤收集转染后60 h的细胞,重悬于预冷的70%乙醇中于4℃固定24 h以上,加入终浓度为100 μg/mL的RNaseA于37℃消化30 min,将细胞重悬于含50 μg/mL PI(溴化丙锭)的PBS中,常温避光孵育1 h后,利用流式细胞仪(Guava easyCyte 6HT)进行细胞周期分布分析。
1.2.6 流式细胞仪分析细胞凋亡
用PBS洗涤收集转染后72 h的细胞,重悬于含1% FBS(胎牛血清)预冷的PBS中,取100 μL样品于1.5 mL EP管,加入100 μL Guava Nexin Reagent,常温避光孵育20 min后,利用流式细胞仪(Guava easyCyte 6HT) 进行细胞凋亡分析。
2 结果与分析
2.1 初始传播病毒Vpr氨基酸序列比对及突变位点分析
首先根据NCBI报道的基因序列,利用DNA Star基因分析软件,将C亚型HIV-1初始传播病毒Vpr与慢性感染株MJ4 Vpr的氨基酸序列进行了对比,结果如图1A所示。初始传播病毒ZM246毒株的Vpr与MJ4的Vpr氨基酸相似度为89.6%,共发现T19A、I22L、P36R、Y45H、E48D、T59V、Q77H、Q85R、S94N和P96S共10个点突变;而ZM247Fv1-Vpr与MJ4-Vpr氨基酸相似度为88.5%,其中包括I22L、P36R、P37V、E48D、T55A、T59A、I61V、L84I、Q85P、S94G和P96S共计11个点突变。
随后,本研究进一步对HIV-1 C亚型共1287株初始传播病毒的Vpr氨基酸序列进行了系统分析。结果表明,92.3%的慢性感染株Vpr第77位均为Q,而约37%的初始传播病毒毒株发生了Q77H的变异;此外,部分初始传播病毒第85位发生了R85P和R85Q的变异;约35.8%的初始传播病毒第94位发生了S94N的变异(图1B)。当对本实验及文献中常用的初始传播病毒ZM246、ZM247和ZM249单独进行分析时,也得到了类似的结果。鉴于Vpr的C末端,特别是R77、R80等氨基酸残基在诱导细胞周期G2/M期停滞及细胞-凋亡上的重要作用,该序列分析结果提示初始传播病毒的Vpr的生物学活性可能发生了改变。
2.2 初始传播病毒vpr表达质粒的构建
为了进一步明确初始传播病毒Vpr调节细胞周期和细胞凋亡的活性,本研究构建了含c-myc标签的ZM246-Vpr、ZM247Fv1-Vpr及MJ4-Vpr表达质粒,随后将上述3种质粒分别转染293T细胞,并利用Western blot对Vpr表达进行检测。结果显示,上述3种含c-myc标签的Vpr均可表达(图2)。
2.3 初始传播病毒vpr对细胞周期的影响
本研究利用流式细胞术,对瞬时表达不同水平(高剂量和低剂量)Vpr的293T细胞的细胞周期状态进行了测定。结果显示,当低水平表达Vpr时,初始传播病毒ZM246和ZM247Fv1的Vpr诱导细胞G2阻滞的能力均明显高于慢性感染病毒MJ4的Vpr(分别为0.0317和0.043);但高水平表达时三者诱导细胞G2阻滞的能力无显著性差异(分别为0.1168和0.1040)(图3,表2)。研究结果提示初始传播病毒Vpr的基因变异将提高其诱导细胞G2阻滞的能力。
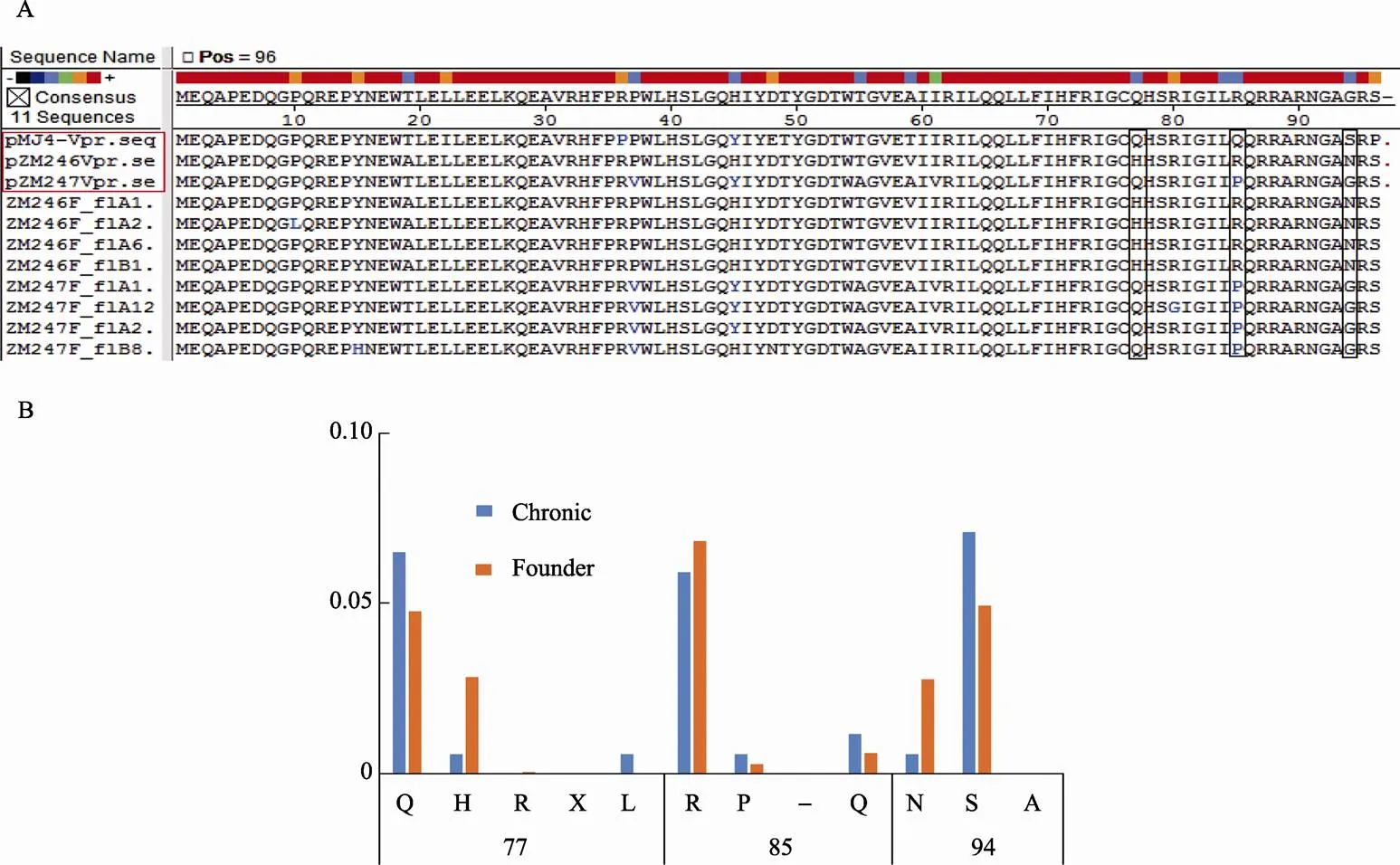
图1 初始传播病毒Vpr及MJ4 Vpr氨基酸序列比对及突变位点分析
A:初始传播病毒Vpr氨基酸序列比对结果(其中红色标出的部分为实验时所用的3株毒株,其余8株为其他初始传播病毒毒株);B:初始传播病毒Vpr突变位点分析。
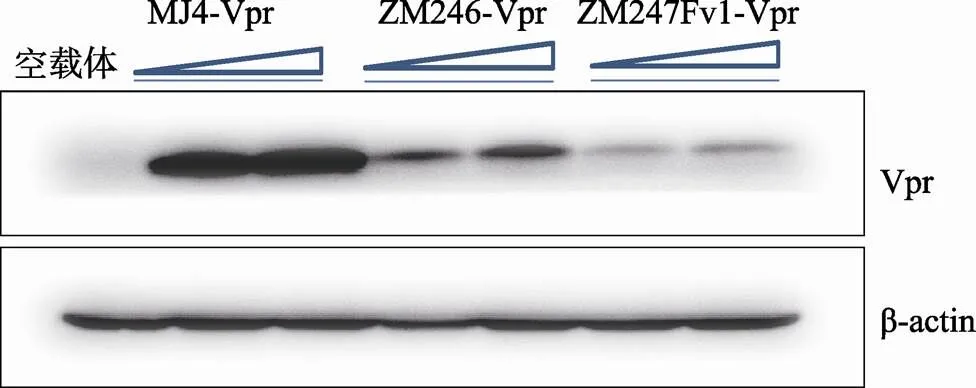
图2 Western blot检测Vpr蛋白的表达
将慢性感染株MJ4 Vpr及初始传播病毒Vpr的表达质粒分别转染293T细胞(5×106/孔),48 h收获细胞并进行Western blot检测。
2.4 初始传播病毒诱导细胞凋亡的作用
本文利用流式细胞术,对瞬时表达不同水平(高剂量和低剂量)Vpr的293T细胞的细胞凋亡水平进行了测定。数据显示:ZM246-Vpr、ZM247Fv1-Vpr与MJ4-Vpr相比,在低浓度时诱导细胞凋亡的能力均显著提高(=0.01和=0.0326);高浓度时,ZM247Fv1-Vpr与MJ4-Vpr的活性显现出显著性差异(=0.0151),而ZM246-Vpr与MJ4-Vpr基本相当(=0.0967)(图4,表3)。
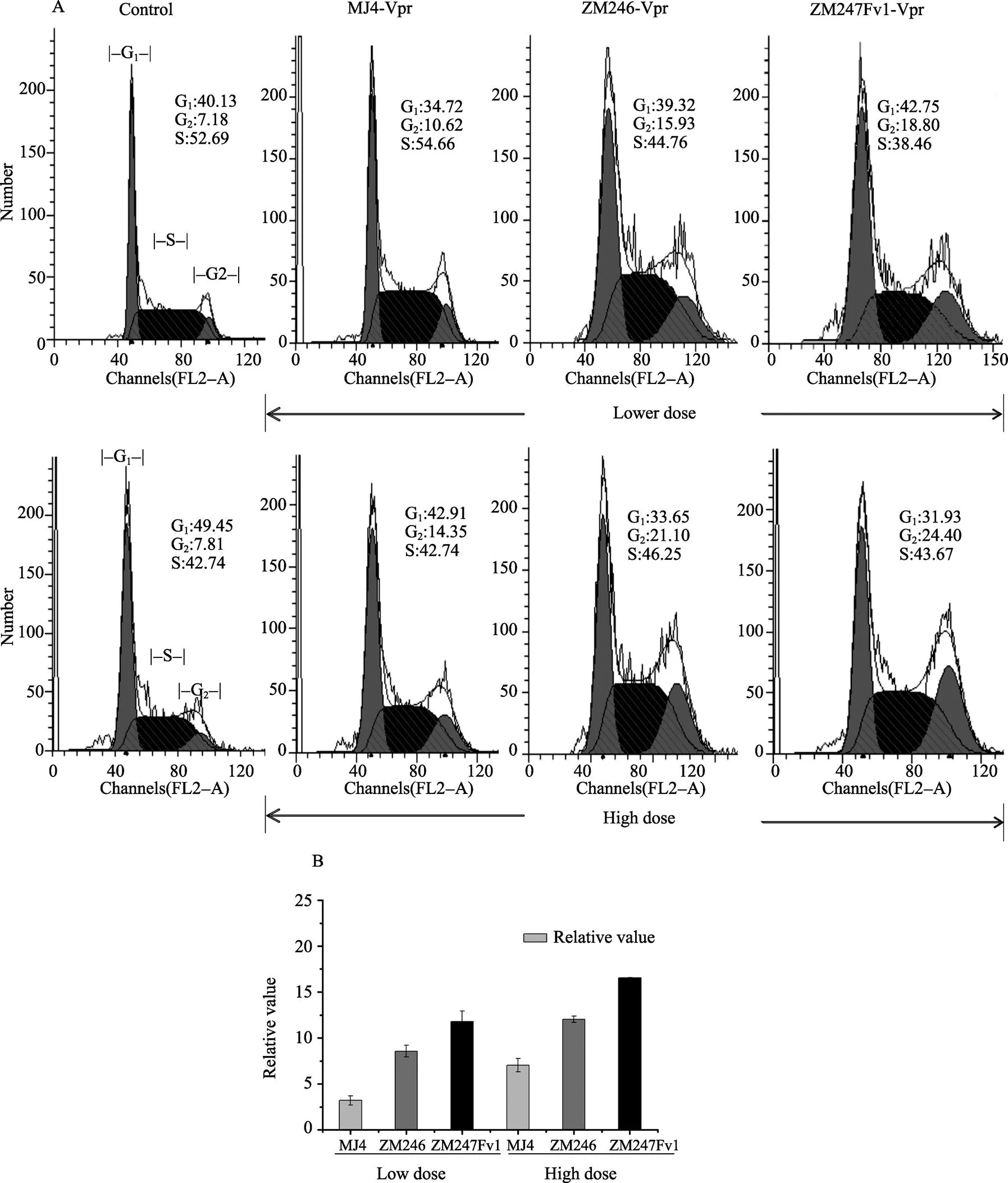
图3 初始传播病毒Vpr诱导细胞G2期阻滞
A:慢性感染株MJ4-Vpr及初始传播病毒Vpr分别转染293T细胞,48 h进行流式细胞仪分析;B:慢性感染株MJ4 Vpr及初始传播病毒 Vpr诱导293T细胞G2期阻滞相对定量结果。实验结果为3次独立实验。
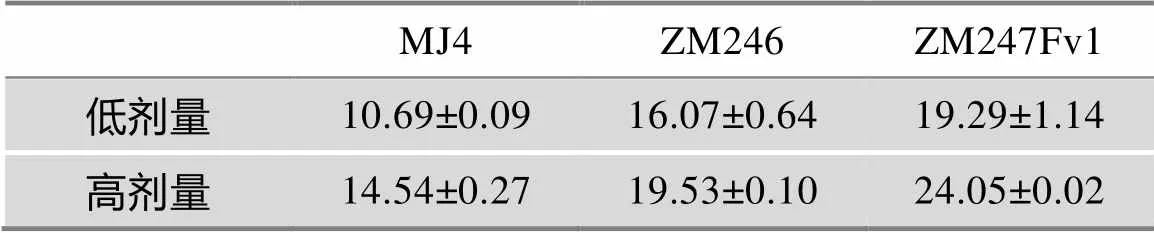
表2 Vpr诱导细胞G2期阻滞的定量化结果
3 讨 论
在HIV-1急性感染期,病毒在传播过程中存在严重的“遗传瓶颈”效应和有限的早期进化。了解初始传播病毒的早期进化和生物学特征,有助于进一步阐明HIV-1在新宿主内成功复制的关键环节,为有效阻断新感染的防治策略发展提供了理论基础。本研究首先对C亚型HIV-1初始传播病毒株和慢性感染株MJ4的 Vpr氨基酸序列进行比对,发现初始传播病毒在影响其诱导细胞周期及细胞凋亡能力的一些关键氨基酸均存在突变。细胞生物学实验表明初始传播病毒Vpr诱导细胞G2期阻滞和细胞凋亡的能力明显高于慢性感染株MJ4 Vpr。上述结果提示,初始传播病毒可能通过其早期进化,提高Vpr的生物学活性,诱导更多的感染细胞停留在G2期,导致大量的CD4T细胞凋亡,为病毒传播创造有利条件。
早期的研究结果显示,HIV-1 Vpr的72~83aa是线粒体毒性区域,73、77及80位氨基酸残基对于诱导细胞凋亡活性中执行重要功能[2]。73、77、80和84~96位氨基酸残基是Vpr诱导细胞周期G2停滞的关键结构域[15]。本研究的序列对比分析发现,初始传播病毒在第77、85和94位氨基酸存在点突变,提示上述氨基酸取代可能是其Vpr诱导细胞周期阻滞和细胞凋亡活性提高的原因。这一设想及其具体的分子机制还有待于进一步实验验证和深入研究。此外,本研究还发现HIV-1Vpr诱导细胞G2阻滞的能力与诱导细胞凋亡的能力呈正相关,提示两者的发生机制可能一致或者存在关联性。
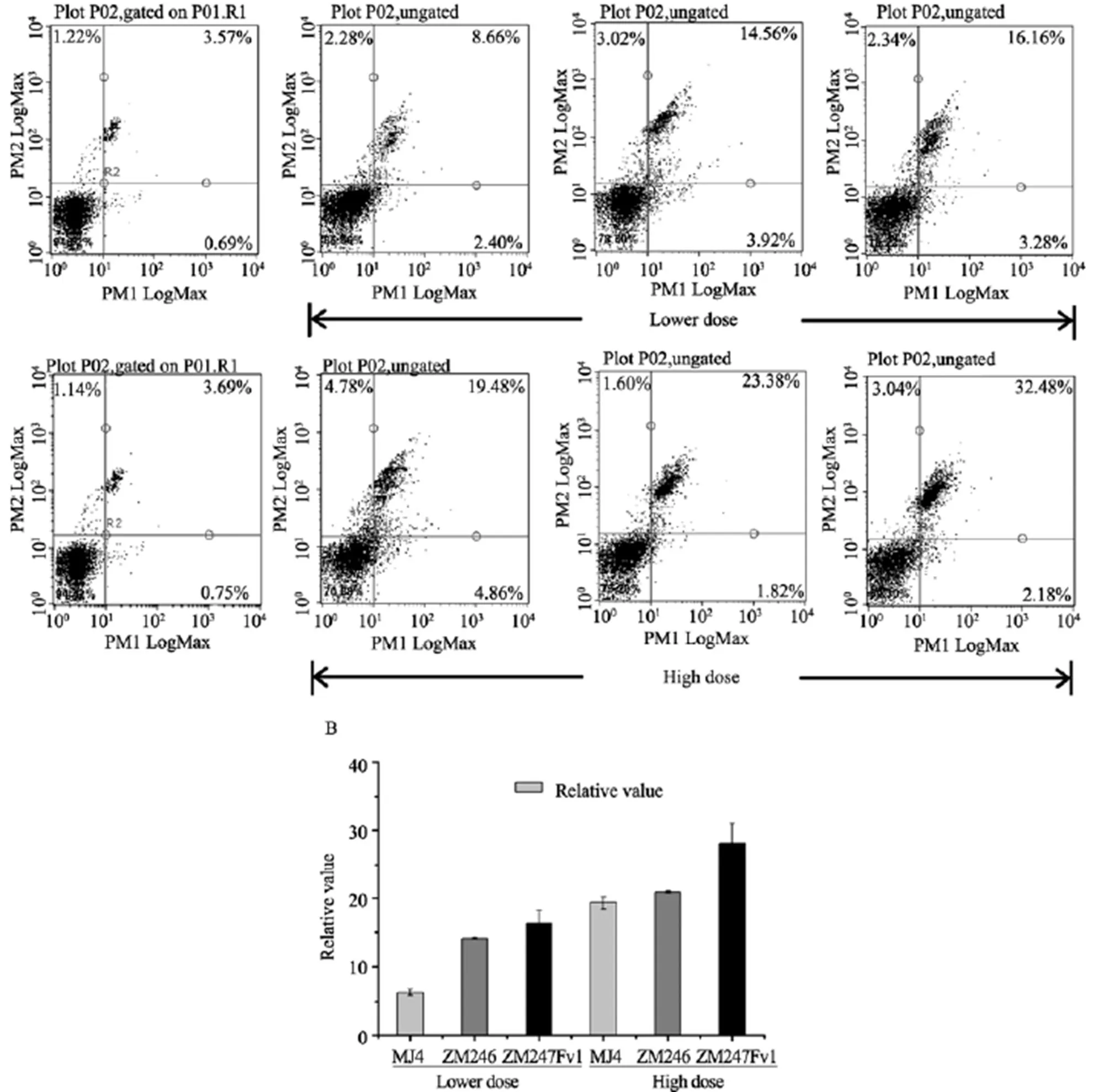
图4 Vpr诱导细胞凋亡结果
A:慢性感染株MJ4-Vpr及初始传播病毒Vpr分别转染293T细胞,72 h进行流式细胞仪分析;B:慢性感染株MJ4 Vpr及初始传播病毒 Vpr诱导293T细胞凋亡相对定量结果。实验结果为3次独立实验。
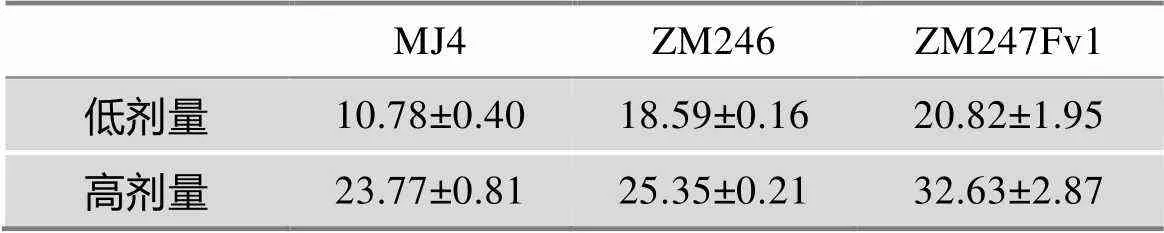
表3 Vpr诱导细胞凋亡的定量化结果
[1] Kamiyama T, Miura T, Takeuchi H. His-Trp cation-π interaction and its structural role in anα-helical dimer of HIV-1 Vpr protein, 2013, 173–174: 8–14.
[2] Guenzel CA, Hérate C, Benichou S. HIV-1 Vpr-a still "enigmatic multitasker", 2014, 5: 127.
[3] Morellet N, Bouaziz S, Petitjean P, Roques BP. NMR structure of the HIV-1 regulatory protein VPR, 2003, 327(1): 215–227.
[4] Zhao LJ, Jian H, Zhu HH. HIV-1 auxiliary regulatory protein Vpr promotes ubiquitination and turnover of Vpr mutants containing the L64P mutation, 2004, 563(1–3): 170–178.
[5] Kichler A, Pages JC, Leborgne C, Druillennec S, Lenoir C, Coulaud D, Delain E, Le Cam E, Roques BP, Danos O. Efficient DNA transfection mediated by the C-terminal domain of human immunodeficiency virus type 1 viral protein R, 2000, 74(12): 5424–5431.
[6] Sherman MP, De Noronha CMC, Williams SA, Greene WC. Insights into the biology of HIV-1 viral protein R, 2002, 21(9): 679–688.
[7] Coeytaux E, Coulaud D, Le Cam E, Danos O, Kichler A. The cationic amphipathic α-helix of HIV-1 viral protein R (Vpr) binds to nucleic acids, permeabilizes membranes, and efficiently transfects cells, 2003, 278(20): 18110–18116.
[8] Hoshino S, Konishi M, Mori M, Shimura M, Nishitani C, Kuroki Y, Koyanagi Y, Kano S, Itabe H, Ishizaka Y. HIV-1 Vpr induces TLR4/MyD88-mediated IL-6 production and reactivates viral production from latency, 2010, 87(6): 1133–1143.
[9] Fassati A, Goff SP. Characterization of intracellular reverse transcription complexes of human immunodeficiency virus type 1, 2001, 75(8): 3626–3635.
[10] Fritz JV, Dujardin D, Godet J, Didier P, De Mey J, Darlix JL, Mély Y, de Rocquigny H. HIV-1 Vpr oligomerization but not that of Gag directs the interaction between Vpr and Gag, 2010, 84(3): 1585–1596.
[11] Wen XY, Duus KM, Friedrich TD, de Noronha CMC. The HIV1 protein Vpr acts to promote G2 cell cycle arrest by engaging a DDB1 and Cullin4A-containing ubiquitin ligase complex using VprBP/DCAF1 as an adaptor, 2007, 282(37): 27046–27057.
[12] Jacotot E, Ravagnan L, Loeffler M, Ferri KF, Vieira HLA, Zamzami N, Costantini P, Druillennec S, Hoebeke J, Briand JP, Irinopoulou T, Daugas E, Susin SA, Cointe D, Xie ZH, Reed JC, Roques BP, Kroemer G. The HIV-1 viral protein R induces apoptosis via a direct effect on the mitochondrial permeability transition pore, 2000, 191(1): 33–46.
[13] Li G, Bukrinsky M, Zhao RY. HIV-1 viral protein R (Vpr) and its interactions with host cell, 2009, 7(2): 178–183.
[14] Le Rouzic E, Benichou S. The Vpr protein from HIV-1: distinct roles along the viral life cycle, 2005, 2(1): 11.
[15] Deniaud A, Brenner C, Kroemer G. Mitochondrial membrane permeabilization by HIV-1 Vpr, 2004, 4(2–3): 223–233.
[16] Wang B, Ge YC, Palasanthiran P, Xiang SH, Ziegler J, Dwyer DE, Randle C, Dowton D, Cunningham A, Saksena NK. Gene defects clustered at the C-terminus of the vpr gene of HIV-1 in long-term nonprogressing mother and child pair:evolution of vpr quasispecies in blood and plasma, 1996, 223(1): 224–232.
[17] Lum JJ, Cohen OJ, Nie ZL, Weaver JG, Gomez TS, Yao XJ, Lynch D, Pilon AA, Hawley N, Kim JE, Chen ZX, Montpetit M, Sanchez-Dardon J, Cohen EA, Badley AD.R77Q is associated with long-term nonprogressive HIV infection and impaired induction of apoptosis, 2003, 111(10): 1547–1554.
[18] Keele BF. Identifying and characterizing recently transmitted viruses, 2010, 5(4): 327–334.
[19] Sagar M, Laeyendecker O, Lee S, Gamiel J, Wawer MJ, Gray RH, Serwadda D, Sewankambo NK, Shepherd JC, Toma J, Huang W, Quinn TC. Selection of HIV variants with signature genotypic characteristics during heterosexual transmission, 2009, 199(4): 580–589.
[20] Salazar-Gonzalez JF, Bailes E, Pham KT, Salazar MG, Guffey MB, Keele BF, Derdeyn CA, Farmer P, Hunter E, Allen S, Manigart O, Mulenga J, Anderson JA, Swanstrom R, Haynes BF, Athreya GS, Korber BTM, Sharp PM, Shaw GM, Hahn BH. Deciphering human immunodeficiency virus type 1 transmission and early envelope diversification by single-genome amplification and sequencing, 2008, 82(8): 3952–3970.
(责任编委: 谢建平)
Genetic variance in the HIV-1 founder virusaffects its ability to induce cell cycle G2arrest and cell apoptosis
Jianyuan Zhao1,2, Jiwei Ding2, Zeyun Mi2, Jinming Zhou2, Tao Wei1, Shan Cen2
In the event of acute infection, only a few HIV-1 viral variants can establish the initial productive clinical infection, and these viral variants are known as transmitted/founder viruses (T/F viruses). As one of the accessory proteins of HIV-1, viral protein R (Vpr) plays an important role in viral replication. Therefore, the characterization of T/F virus Vpr is beneficial to understand how virus replicates in a new host. In this study, flow cytometry was used to analyze the effect of G2arrest and cell apoptosis induced by the T/F virus Vpr and the chronic strain MJ4 Vpr. The results showed that the ability of T/F virus ZM246 Vpr and ZM247 Vpr inducing G2arrest and cell apoptosis are more potent than the MJ4 Vpr. The comparison of protein sequences indicated that the amino acids of 77, 85 and 94 contain high freqency mutations, suggesting that these sites may be involved in inducing G2arrest and cell apoptosis. Taken together, our work suggests that in acute infections, T/F viruses increase the capacity of G2arrest and cell apoptosis and promote viral replication and transmission in a new host by Vpr genetic mutation.
HIV-1; founder virus;; cell G2arrest; cell apoptosis
2015-01-04;
2015-01-29
北京联合大学研究生创新基金(编号:12246994501)和国家基金委-加拿大国立卫生研究院研究基金课题(CIHR)合作基金(编号:81361128017)资助
赵建元,硕士研究生,专业方向:病毒学。E-mail: Zjyuan815@163.com
岑山,博士,研究员,研究方向:病毒学。E-mail: shancen@hotmail.com;魏涛,硕士,教授,研究方向:病毒学。E-mail: weitao@buu.edu.cn
10.16288/j.yczz.15-004
2015-3-18 14:48:45
http://www.cnki.net/kcms/detail/11.1913.R.20150318.1448.001.html
