肺复康合剂对大鼠肺纤维化的抑制作用及相关机制
2015-01-31宋晓冬吕长俊滨州医学院医药研究中心山东烟台264003
赵 敏 李 炯 宋晓冬 吕长俊 (滨州医学院医药研究中心,山东 烟台 264003)
肺复康合剂对大鼠肺纤维化的抑制作用及相关机制
赵 敏 李 炯 宋晓冬 吕长俊 (滨州医学院医药研究中心,山东 烟台 264003)
目的 探讨肺复康合剂对大鼠肺纤维化的抑制作用及相关机制。方法 40只SD雄性大鼠随机分为对照组、模型组、造模+肺复康组、单纯肺复康组。模型组、造模+肺复康组气管灌注博莱霉素(5 mg/kg),而对照组和单纯肺复康组气管灌注同等剂量无菌生理盐水,随后对照组和模型组生理盐水灌胃28 d,造模+肺复康组、单纯肺复康组肺复康合剂灌胃(12 ml/kg)28 d。给药28 d后麻醉处死,计算各组肺系数、肺干重/体重变化,检测肺组织羟脯氨酸(HYP)、一氧化氮(NO)、肺动脉血浆NO2-/NO3-含量、丙二醛(MDA)水平,以及Western印迹法检测诱导型NO合酶(iNOS)、结缔组织生长因子(CTGF)、磷酸化细胞外信号调节激酶(ERK)表达水平。结果 与对照组相比,模型组肺系数、肺干重/体重、HYP、NO、NO2-/NO3-、MDA、iNOS、CTGF、p-ERK 表达均明显增高(P<0.05);与模型组相比,造模+肺复康组肺系数、肺干重/体重、HYP、NO、NO2-/NO3-、MDA、iNOS、CTGF、p-ERK表达水平均明显降低,肺纤维化指标均明显改善;单纯肺复康组与对照组相比,上述指标没有明显变化(P>0.05)。结论 肺复康合剂通过抑制促纤维化因子iNOS、CTGF表达及ERK信号通路,减少博莱霉素所致的应激损伤、病理变化、胶原合成,发挥抑制肺纤维化的药理作用。
肺复康合剂;肺纤维化;诱导型一氧化氮合酶;结缔组织生长因子;磷酸化细胞外信号调节激酶
肺纤维化病理变化以肺成纤维细胞弥漫性增生为主,进行性积聚的基质胶原逐步取代正常肺组织。目前,还没有特效的治疗方法〔1〕。近年来研究表明,在肺纤维化及纤维化多器官损伤中,氧化应激发挥关键性作用〔2〕。在肺纤维化演变过程中,诱导型一氧化氮(NO)合酶(iNOS)表达增多能够加速NO的合成〔3〕。CCN2作为CCN家族成员之一,也称为结缔组织生长因子(CTGF),不仅是纤维化疾病预后的重要评估指标,还为潜在抗纤维化治疗提供新的方向〔4〕。细胞外信号调节激酶(ERK)作为丝裂原活化蛋白激酶(MAPK)家族中的亚族,能够激活多种生长因子及细胞因子。有报道称,博莱霉素(BLM)诱导的肺纤维化模型中,ERK活性明显增高〔5〕。肺复康合剂能够抑制成纤维细胞增殖,抑制肺纤维化,肺复康合剂剂量(1 g/ml)已证实是抑制BLM诱导大鼠肺纤维化的最佳浓度〔6〕,本研究拟观察肺复康合剂对大鼠肺纤维化的抑制作用及其相关机制。
1 材料与方法
1.1 动物、药物与试剂 雄性SD大鼠40只,体重(200±15)g,购自山东绿叶制药有限公司实验动物中心;BLM产自日本华药株式会社高崎制药厂;肺复康合剂由滨州医学院附属医院制剂室提供,黄芪 30 g、丹参30 g、鱼腥草30 g、地龙30 g、川芎10 g、甘草10 g,水煎煮2次,1 h/次,合并煎液,静置沉淀,滤过,浓缩至所需浓度(含生药1 g/ml);羟脯氨酸(HYP)、NO试剂盒购自武汉博士德生物工程股份有限公司、NO2-/NO3-试剂盒及丙二醛(MDA)试剂盒购自南京建成生物有限公司。iNOS(1∶1 000稀释),CTGF(1∶1 000 稀释),ERK1,2(1∶1 000 稀释,兔多克隆抗体)、p-ERK(1∶1 000稀释,小鼠单克隆抗体),购自 Santa Cruz公司;辣根过氧化物酶标记Ⅱ抗(1∶5 000稀释)、硝酸纤维素膜(PVDF),购自北京中山金桥生物有限公司;免疫组化试剂盒(SABC试剂盒)购自武汉博士德生物工程公司。
1.2 分组与造模 根据随机数字法,将40只大鼠分为对照组、模型组、模型+肺复康组、单纯肺复康组,10只/组。水合氯醛麻醉后,仰卧位,逐层切开颈部组织,钝性分离,充分暴露气管,于气管环状软骨间隙穿刺,注入BLM或生理盐水溶液,注射完毕后立即将动物直立旋转,促进药液充分作用于肺部组织,逐层缝合。模型组、造模+肺复康组气管灌注博莱霉素(5 mg/kg),对照组和单纯肺复康组气管灌注同等剂量无菌生理盐水。造模后,对照组和模型组生理盐水灌胃28 d,模型+肺复康组、单纯肺复康组予肺复康合剂(浓度为12 ml/kg)灌胃28 d。
1.3 观察指标及方法
1.3.1 肺系数 大鼠灌胃28 d后,称重作为终末体重,10%水合氯醛麻醉处死(350 mg/kg),取出肺脏组织,称重。肺系数=肺脏重量/终末体重。定量称量0.5 g肺组织匀浆,经氯仿、甲醇(2∶1)混合液、乙醇、丙酮脱水、脱脂后干燥,研磨成粉末,准确称量肺粉,根据肺干湿重比例换算成肺干重。
1.3.2 病理组织观察 动物处死后,取出、修剪肺组织,将部分肺组织固定于10%甲醛磷酸盐缓冲液(PBS),室温7 d,梯度乙醇脱水、石蜡包埋后,切成5 μm厚度切片,苏木精-伊红染色、Masson三联染色,光学显微镜观察肺脏的组织病理学变化。
1.3.3 肺组织HYP、NO水平 动物处死后,将肺组织切块,部分浸入0.9%生理盐水,制备肺组织匀浆,通过相应试剂盒,按照操作说明,检测HYP、NO水平。
1.3.4 肺动脉血浆NO2-/NO3-、MDA含量 各组大鼠在灌注28 d后,10%水合氯醛麻醉(350 mg/kg),取肺动脉血,通过NO2-/NO3-试剂盒、MDA试剂盒,测定肺动脉血浆 NO2-/NO3-、MDA含量。
1.3.5 iNOS、CTGF(CCN2)、p-ERK 表达 动物处死后,将肺组织切块,加入 0.3 ml冰组织裂解液(Tris-HCl,pH7.5,0.5 mol/L,NaCl 0.15 mol/L、EDTA 0.001 mol/L、Aprotinin 2 μg/ml、PMSF 0.001 mol/L),裂解 15 min 组织匀浆,离心15 min(12 000 r/min,4℃),取上清液,-80℃保存。通过酚试剂法检测蛋白浓度。每孔取50 μg总蛋白,加入等体积上样缓冲液,煮沸10 min后,12%聚丙烯酰胺凝胶电泳(浓缩胶50 V、分离胶100 V),4℃恒流60 mA转膜,过夜,5%胎牛血清蛋白(BSA)漂洗液封闭1 h,加入一抗,室温孵育2 h,摇床缓慢摇动,漂洗后加入辣根过氧化物酶标记Ⅱ抗,室温孵育1 h,漂洗后二氨基联苯胺(DAB)显色。凝胶图像分析软件扫描,检测蛋白条带表达水平。
1.4 统计学方法 应用SPSS18.0软件,计量资料以±s表示,两两比较采用单因素方差分析及LSD法检验。
2 结果
2.1 各组肺系数、肺干重/体重比较 与对照组相比,模型组的肺系数、肺干重/体重均明显升高(P<0.05);与模型组相比,造模+肺复康组的肺系数、肺干重/体重均显著降低(P<0.05);而单纯肺复康组与对照组相比,肺系数、肺干重/体重比较差异无统计学意义(P>0.05)。见表1。
表1 各组肺系数、肺干重/体重、HYP、NO、NO2-/NO3-、MDA水平比较(±s)
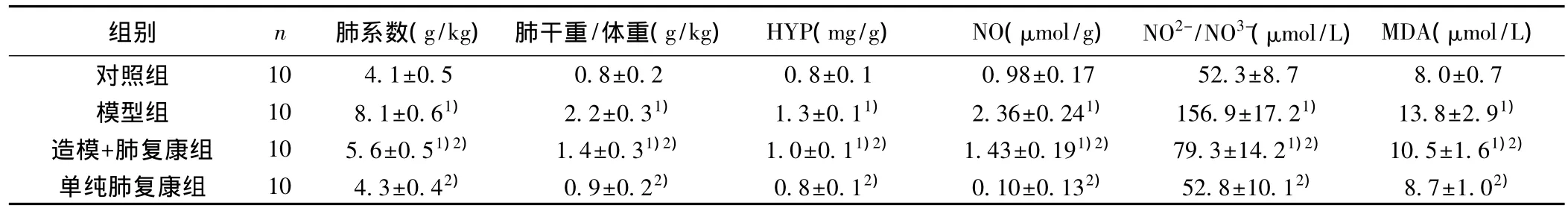
表1 各组肺系数、肺干重/体重、HYP、NO、NO2-/NO3-、MDA水平比较(±s)
与对照组比较:1)P<0.05;与模型组比较:2)P<0.05
组别 n 肺系数(g/kg) 肺干重/体重(g/kg) HYP(mg/g) NO(μmol/g) NO2-/NO3-(μmol/L)MDA(μmol/L)8.0±0.7模型组 10 8.1±0.61) 2.2±0.31) 1.3±0.11) 2.36±0.241) 156.9±17.21) 13.8±2.91)造模+肺复康组 10 5.6±0.51)2) 1.4±0.31)2) 1.0±0.11)2) 1.43±0.191)2) 79.3±14.21)2) 10.5±1.61)2)单纯肺复康组 10 4.3±0.42) 0.9±0.22) 0.8±0.12) 0.10±0.132) 52.8±10.12) 8.7±1.02)对照组 10 4.1±0.5 0.8±0.2 0.8±0.1 0.98±0.17 52.3±8.7
2.2 各组肺组织病理变化 对照组大鼠各时间点肺组织结构正常,肺泡壁无充血、水肿,肺泡腔无出血,未见纤维化组织。模型组大鼠肺组织正常肺泡结构破坏,广泛性肺泡间隔增宽,淋巴细胞、中性粒细胞、成纤维细胞密集性间质浸润。与模型组相比,造模+肺复康组肺组织形态学变化有了明显改善,细胞内浸润明显减少,肺泡间隔明显变窄。而对照组和单纯肺复康组没有发现明显变化(图1)。Masson染色后发现,与对照组相比,模型组出现明显的胶原蛋白沉积、肺形态扭曲。与模型组相比,造模+肺复康组明显抑制胶原蛋白沉积的程度及强度。对照组和单纯肺复康组没有发现明显变化(图2)。
2.3 各组HYP、NO、NO2-/NO3-、MDA水平比较 与正常组相比,模型组 HYP、NO、NO2-/NO3-、MDA 水平均明显升高(P<0.05);与模型组相比,造模+肺复康组 HYP、NO、NO2-/NO3-、MDA水平均显著降低(P<0.05);而单纯肺复康组与对照组相比,上述指标无统计学差异(P>0.05)。见表1。

图1 HE染色后各组组织病理学变化(×400)
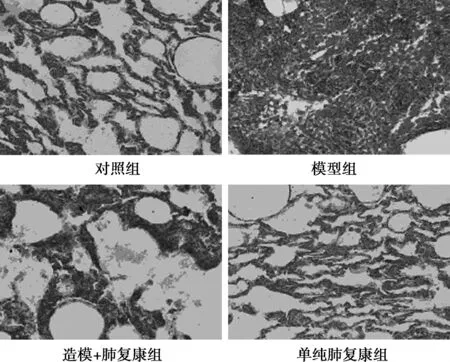
图2 Masson染色后各组组织病理学变化(×400)
2.4 各组iNOS、CTGF、p-ERK蛋白表达比较 与对照组相比,模型组iNOS、CTGF、p-ERK表达水平均明显增高(P<0.05);与模型组相比,造模+肺复康组iNOS、CTGF、p-ERK表达水平均明显降低(P<0.05);对照组与单纯肺复康组相比,iNOS、CTGF、p-ERK表达水平无显著差异(P>0.05)。见图3,表2。

图3 各组iNOS、CTGF、p-ERK等的Western印迹电泳图
表2 各组iNOS、CTGF、p-ERK 的Western印迹结果(±s,n=10)
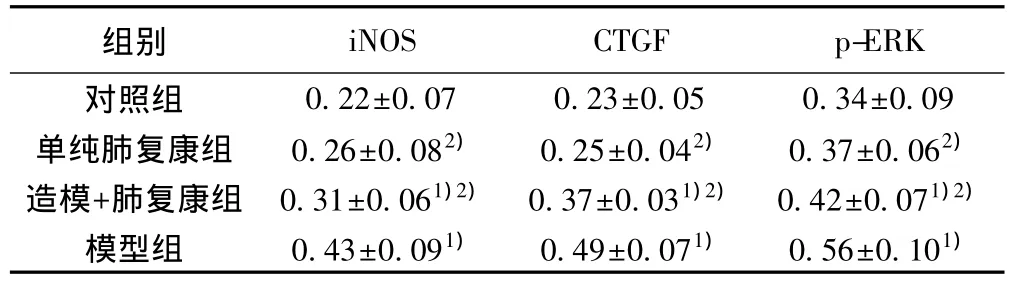
表2 各组iNOS、CTGF、p-ERK 的Western印迹结果(±s,n=10)
组别0.22±0.07 0.23±0.05 0.34±0.09单纯肺复康组 0.26±0.082) 0.25±0.042) 0.37±0.062)造模+肺复康组 0.31±0.061)2) 0.37±0.031)2) 0.42±0.071)2)模型组 0.43±0.091) 0.49±0.071) 0.56±0.101)iNOS CTGF p-ERK对照组
3 讨论
中医认为,肺纤维化多由脾肺气虚、肺肾阴虚、痰浊瘀阻所致,所以,中医治疗以活血化瘀、祛痰除湿为主〔7〕。肺复康合剂以黄芪为主,配以鱼腥草、地龙、丹参等药物,其中黄芪能够提高机体免疫力,减少胶原积聚,具有益气扶正之功效;鱼腥草抑制炎性反应,提高机体免疫功能,具有清热解毒之功效,地龙、丹参能够抑制炎症细胞分泌、胶原合成、血小板聚集,从而抑制肺成纤维细胞增殖,发挥抗炎、活血化瘀之功效。
肺纤维化作为进行性肺组织病变,主要包括细胞外基质过度沉积、片状慢性间质炎症、成纤维细胞增殖、肺泡塌陷等组织病理学变化。HYP作为机体胶原蛋白主要成分,约占氨基酸总量13%,而其他弹性蛋白也含有不同含量的HYP,所以,组织中HYP含量可作为胶原组织代谢的重要指标。本研究结果充分证实肺复康合剂能够通过抑制胶原组织代谢、氧化应激等方式,抑制BLM诱导的肺纤维化水平,并且分子研究结果表明肺复康合剂通过抑制CTGF/ERK通路,发挥抗纤维化作用。
NO2-/NO3-是NO的代谢产物,肺动脉血浆NO2-/NO3-含量的变化能够间接反映肺内NO变化情况。脂质过氧化物MDA含量能够间接反映肺内脂质过氧化程度。本研究结果证实肺复康合剂能够有效抑制肺内NO异常增多,发挥肺复康合剂抑制iNOS活性的作用,有效抑制BLM所致的肺内氧化损伤。
BLM作为糖肽类抗生素被广泛应用于癌症治疗中,但是,BLM的毒副作用也较大,能够破坏肺部结构,引起肺纤维化,因此,BLM也是广泛应用于动物肺纤维化模型的诱导剂〔8〕。气管灌注BLM后,最初7 d肺部组织出现炎症反应增加、细胞凋亡增多等急性肺损伤的病理变化,随后进入代偿阶段,而在28 d左右,细胞外基质过度沉积,形成广泛肺纤维化〔9〕。本研究依据上述理论基础,选择BLM造模后,各处理组灌胃28 d。结果表明肺复康合剂通过抑制胶原合成,发挥抗纤维化作用。
在肺纤维化过程中,有许多转录因子被激活,如核转录因子(NF)-κB、EGR-1等,这些活化的转录因子调控一系列炎症反应相关因子的基因表达,形成瀑布效应。所以,转录因子在肺纤维化发生机制的信号级联中起着重要的枢纽作用。NF-κB作为目前研究最多的转录因子,多种因素可以激活NF-κB。NO作为内源性自由基,由iNOS合成〔10〕。本研究结果表明肺复康合剂通过抑制iNOS蛋白表达,减轻氧化应激反应,发挥抗纤维化作用。在肺纤维化发病过程中,NO合成增多,提高NF-κB与DNA结合力,肺组织磷酸化ERK表达大幅增高,表明肺纤维化发病过程中,ERK信号分子可能与NF-κB激活有关,共同参与肺纤维化的发生、发展。
CTGF作为转化生长因子(TGF)-β的下游调控因子,被认为是肺纤维化进展、预后的标志〔11〕。有报道称,在肺纤维化组织中,CTGF表达增多〔12〕。本研究中,肺复康合剂可能通过下调CTGF蛋白表达,从而发挥抗纤维化功效。
丝裂原活化蛋白激酶(MAPK)/ERK信号转导通路作为与纤维化相关的重要细胞调控通路,参与调控细胞的生长、增殖等活动〔13〕。有报道称,BLM诱导肺纤维化模型中,ERK活性增加〔5〕。有报道称,EGR-1蛋白至少参与30种以上靶基因调控,基因启动子上均有其识别位点GC元件(GCE),是一类参与炎症、细胞生长等病理生物学过程的重要转录因子,对TGF-β、TF等基因具有强烈的转录活化作用。本研究结果表明BLM通过激活ERK,诱导EGR-1激活,继而引起肺纤维化过程,而肺复康合剂通过抑制ERK磷酸化水平,阻断ERK信号转导通路,发挥抗纤维化功效。
综上所述,肺复康合剂通过抑制促纤维化因子iNOS表达及ERK信号通路,减少BLM所致的应激损伤、病理变化、胶原合成,发挥抑制肺纤维化的药理作用。
1 Kim D.Acute exacerbations in patients with idiopathic pulmonary fibrosis〔J〕.Respir Res,2013;14(1):86.
2 Daniil ZD,Papageorgiou E,Koutsokera A,et al.Serum levels of oxidative stress as a marker of disease severity in idiopathic pulmonary fibrosis〔J〕.Pulm Pharmacol Ther,2008;21(1):26-31.
3 Kalayarasan S,Sriram N,Sudhandiran G.Diallyl sulfide attenuates bleomycin-induced pulmonary fibrosis:critical role of iNOS,NF-kappaB,TNF-alpha and IL-1beta〔J〕.Life Sci,2008;82(23-24):1142-53.
4 Jiang C,Huang H,Liu J,et al.Fasudil,a rho-kinase inhibitor,attenuates bleomycin-induced pulmonary fibrosis in mice〔J〕.Int J Mol Sci,2012;13(7):8293-307.
5 Galuppo M,Esposito E,Mazzon E,et al.MEK inhibition suppresses the development of lung fibrosis in the bleomycin model〔J〕.Naunyn-Schmiedebergs Arch Pharmacol,2011;384(1):21-37.
6 刘孟安,姜学连,刘志学,等.肺复康合剂对肺纤维化大鼠血清变化的影响〔J〕.中国中医急症,2008;17(12):1730-1.
7 刘孟安,姜学连,赵松林,等.肺复康合剂对肺纤维化大鼠病理变化的影响〔J〕.中国中医急症,2009;18(1):87-9.
8 Wan YY,Tian GY,Guo HS,et al.Endostatin,an angiogenesis inhibitor,ameliorates bleomycin-induced pulmonary fibrosis in rats〔J〕.Respir Res,2013;14(1):56.
9 Mouratis MA,Aidinis V.Modeling pulmonary fibrosis with bleomycin〔J〕.Curr Opin Pulm Med,2011;17(5):355-61.
10 Tsutsui M,Shimokawa H,Otsuji Y,et al.Pathophysiological relevance of NO signaling in the cardiovascular system:novel insight from mice lacking all NO synthases〔J〕.Pharmacol Ther,2010;128(3):499-508.
11 Phanish MK,Winn SK,Dockrell ME.Connective tissue growth factor-(CTGF,CCN2)-A marker,mediator and therapeutic target for renal fibrosis〔J〕.Nephron Exp Nephrol,2010;114(3):83-92.
12 Tannheimer SL,Wright CD,Salmon M.Combination of roflumilast with a beta-2 adrenergic receptor agonist inhibits proinflammatory and profibrotic mediator release from human lung fibroblasts〔J〕.Respir Res,2012;13(1):28-33.
13 Rodrigues-Díez R,Lavoz C,Rayego-Mateos S,et al.Statins inhibit angiotensin Ⅱ/Smad pathway and related vascular fibrosis,by a TGF-β-independent process〔J〕.PLoS One,2010;5(11):e14145.
The inhibition role and related mechanism of Feifukang mistura on rat pulmonic fibrosis
ZHAO Min,LI Jiong,SONG Xiao-Dong,et al.
Binzhou Medical University Medicine& Pharmacy Research Center,Yantai 264003,Shandong,China
40 male SD rats were randomized into control,model,model+Feifukang,Single Feifukang groups.The rats in model and model+Feifukang groups were given intratracheal injection of bleomycin(1 mg/kg),and the rats in control and single Feifukang groups were given intratracheal injection of normal saline alone as the equivalent dose.The rats were treated Feifukang mistura(12 ml/kg intragastrically)for 28 d in model+Feifukang and single Feifukang groups.The lung coefficient,lung dry weight/body weight,hydroxyproline(HYP),nitric oxide(NO)of lung tissues,and NO2-/NO3-,malondialdehyde(MDA)of pulmonary artery plasma in all groups were measured.The expressions of nitric oxide synthase(iNOS),connective tissue growth factor(CTGF)and phosphorylation extracellular regulated protein kinase(p-ERK)were detected by Western blot in all groups.ResultsCompared with that of control group,the lung coefficient,lung dry weight/body weight,the levels of HYP,NO,NO2-/NO3-,MDA were obviously increased,and the expression levels of iNOS,CTGF and p-ERK were significantly increased in model group(P<0.05);Compared with those of model group,the lung coefficient,lung dry weight/body weight,the levels of HYP,NO,NO2-/NO3-,MDA were obviously decreased,and the expression levels of iNOS,CTGF and p-ERK were significantly decreased in model+Feifukang group,the indexes of pulmonary fibrosis were significantly improved(P<0.05).The above parameters between the single Feifukang and the control groups were obviously changed(P>0.05).ConclusionsFeifukang mistura inhibits the bleomycin-induced oxidative stress,histological alterations and collagen depositions and plays the pharmacological effects of anti-pulmonary fibrosis via the inhibition of the pro-fibrotic cytokine iNOS,CTGF expressions and the ERK pathway.
Feifukang mistura;Pulmonic fibrosis;iNOS;CTGF;ERK
R56
A
1005-9202(2015)09-2342-04;
10.3969/j.issn.1005-9202.2015.09.015< class="emphasis_bold">【Abstract】 Objective
Objective To study the inhibition role and related mechanism of Feifukang mistura on rat pulmonic fibrosis.Methods
国家自然科学基金(81273957);山东省自然科学基金(ZR2013HM051);滨州医学院科技重点计划(BY2012KJZD10)
吕长俊(1963-),男,教授,博士,主要从事间质性肺疾病的诊断及治疗研究。
赵 敏(1979-),女,硕士,主要从事呼吸疾病研究。
〔2014-09-16修回〕
(编辑 袁左鸣)
