南极夏季南设得兰岛海域浮游动物群落垂直分布
2015-01-29杨光李超伦张永山刘群
杨光 李超伦 张永山 刘群
(1中国科学院海洋研究所海洋生态与环境科学重点实验室,山东青岛266071;2中国科学院海洋研究所胶州湾海洋生态系统研究站,山东青岛266071)
0 引言
浮游动物自身游泳能力较弱,随波逐流,生活史周期短,人为干扰相对较少,因此其种群变动主要与环境变化密切相关,是研究全球变化对海洋生态系统的影响与反馈的理想指示物种[1]。
独特的地理位置和环境特征使得南极地区对全球变化有快速、重要的反馈。传统的南大洋浮游动物调查一般局限于200 m水深至表层水体的样品取样[2-3],而水下遥控摄像系统发现南极大磷虾(Euphausia superba)等浮游动物可在3 000 m水深进行摄食活动[4],近期英国及澳大利亚科学家的研究显示,南极磷虾能通过摄食活动将海床中高含量的铁带入表层海水,从而对南大洋表层海洋生态系统的物质循环带来深远影响[5]。随着技术的发展及各种新型网具的应用,对南大洋浮游动物群落进行更深水层的调查将逐渐成为新的研究趋势。而浮游动物群落结构的垂直分布研究,将利于我们更好地了解浮游动物在海洋地球化学循环中的作用。
南大洋大西洋扇区是南极海洋生态系统研究较为广泛的区域。1920—1930年间的“Discovery”调查,以及后来的国际间“BIOMASS”(南极海洋生态系统生物量调查)计划均将此区域作为研究的核心区域。位于大西洋扇区的南设得兰群岛海域是南大洋浮游动物关键物种——南极磷虾渔业的主要渔场[6-7]。本文基于中国第28次南极考察南设得兰岛海域4个站位 Multinet网(200μm,0.5 m2)采集的浮游动物样品资料,对浮游动物群落结构及与环境因子关系进行了分析,为今后对此海域浮游动物开展进一步的研究提供基础数据。
1 材料与方法
2012年1月中下旬,在中国第28次南极科学考察期间,对南设得兰岛海域4个站位用Multinet网(200μm,0.5m2)对浮游动物进行了多水层分层拖网(图1,表1),样品置于5%甲醛溶液中进行保存。回实验室后,大型浮游动物进行全样计数,其余个体根据样品量进行1/2—1/32分样后在解剖镜下计数。四种桡足类优势种Calanoides acutus、Calanus propinquus、Metridia gerlachei和Rhincalanus gigas按照桡足幼体期Ⅰ—Ⅵ期进行计数,大磷虾(Euphausia superba)则按照原蚤状幼体(CⅠ—CⅢ)和蚤状幼体(FⅠ—FⅥ)进行计数。

图1 南设得兰岛海域浮游动物Multinet网采站位Fig.1.Stations for Multinet sampling around South Shetland Island

表1 样品采集时间及水层Table 1.Sampling time and strata
浮游动物丰度数据经四次方根转化后,基于Bray-Curtis相似性指数和组平均的方法进行q-型聚类[8]。非度量多维标度(NMDS)对聚类分析进行重复。聚类分出的群组通过相似百分度(SIMPER)来确定对群落划分起关键作用的物种。
指示种分析(IndVal)用于确定各站位分组之间的指示物种[9]。指示种数值IndVal计算为:
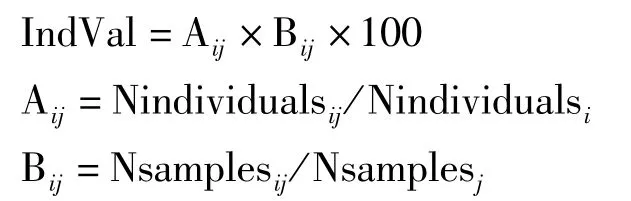
其中Nindividualsij代表种i在组j的平均丰度,Nindividualsi表示种i在所有群组中平均丰度之和。Nsamplesij指组j中出现种i的站位数,而Nsamplesj是组j中的总样本量。IndVal值25%选作指示种节点,代表此种在50%以上的站位出现并且其在此群组相对丰度>50%。
Bio-Env分析用于判断环境因子(采样深度、温度、盐度、叶绿素a)对浮游动物群落划分的解释。相关系数(pw)介于0—1之间,pw=0表示生物与环境数据间无相关性,pw越接近于1,则表示生物数据与环境数据之间具有较大的相关性。
温度和盐度数据用seabird 911型CTD现场测定。叶绿素测定水样采自表层、25 m、50 m、100 m、150 m和200 m,取500 mL水样经GF/F滤膜过滤,用90%丙酮萃取24 h后在Turner Designs Fluorometer,Model 10上测定。叶绿素a数据由国家海洋局第二海洋研究所提供。
所有的多元统计分析借助Primer 6.0完成。
2 结果
2.1 群落结构
浮游动物群落主要由桡足类组成,桡足类对所有站位浮游动物总丰度的贡献可达到90%以上。NMDS分析显示浮游动物可划分为3个群落(图2),群落1由采自上层水体(0—200 m)的样品组成,此群落所处水层平均温度及平均盐度值相对较低,分别为0.22℃和34.68,平均叶绿素浓度相对较高,可达到0.43(表2,图3)。群落1浮游动物平均丰度为31 782.02个·1 000 m-3,其指示种为Calanus propinquus,Oithona similis,Paraeuchaeta antarctica及大磷虾原蚤状幼体CⅠ-Ⅲ期个体,对群落1划分起关键作用的物种还包括桡足类Calanoides acutus、Metridia gerlachei、Rhincalanus gigas、Ctenocalanus citer、Oncaea curvata及箭虫Eukrohnia hamate(表3)。其中站位D3-1表层至50 m样品(2A1)丰度仅有960个·1 000 m-3,与群落1其他样品有些离群(图2)。

图2 浮游动物样品非度量多维标度分析Fig.2.Non-metricmultidimensional scaling of zooplankton samples
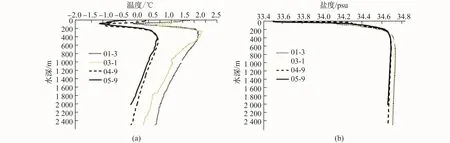
图3 采样站位温度(a)、盐度(b)的垂直分布Fig.3.Depth profiles of temperature(a)and salinity(b)at different stations

表2 群落1,2,3的环境特征Table 2.Environmental variables of community 1,2 and 3
群落2主要由采自中层水体(200—1 000 m)的样品构成,此水层受到高温高盐的绕极深层水涌升影响(图3),温度、盐度较高,分别达到1.05℃和34.68(表 2,图3),群落平均丰度为 22 325.59个·1 000 m-3,其指示种主要包括C.acutus、C.proinquus、M.gerlachei、R.gigas、A.minor、B.bradyi、介形类Alaciaspp.及箭虫E.hamata等(表3);群落3由采自较深层水(1 000—2 000 m)的样品组成,此水体相对稳定,呈现较低的温度和较高的盐度(表2,图 3)。群落 3平均丰度最低,为 989.27个·1 000 m-3,其指示种为深水桡足类B.bradyi,对群落划分起关键作用的物种还包括C.acutus、M.gerlachei、A.minor、C.citer、O.similis、O.curvata及E.hamata(表3)。
2.2 优势物种种群垂直结构
南极大磷虾种群主要分布在0—200 m水体,且以原蚤状幼体CⅠ—Ⅲ期个体为主,而蚤状幼体及未成体主要分布在200 m以深的区域(图4a);桡足类C.acutus种群主要集中在200—500 m水体,且以后期桡足幼体CⅣ—Ⅴ期和雌体为主,早期桡足幼体主要集中在表层0—100 m水体(图4b);C.proinquus种群主要集中在100—500 m水体,早期桡足幼体占种群丰度80%以上(图4c);M.gerlachei种群主要分布在200—1 000 m中层水体,种群中80%以上为后期桡足幼体CⅣ—Ⅴ期和雌体(图4d);R.gigas种群主要分布在200—500 m水体,且以雌体为主(图4e)。

表3 各群落物种组成及丰度Table 3.Average densities ofeach community(ind·1 000m-3)

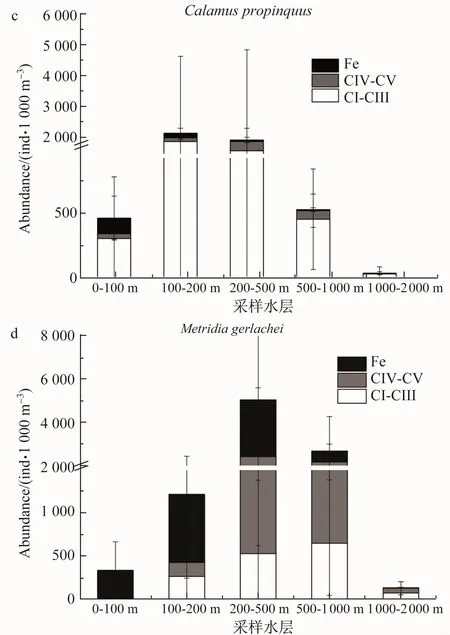
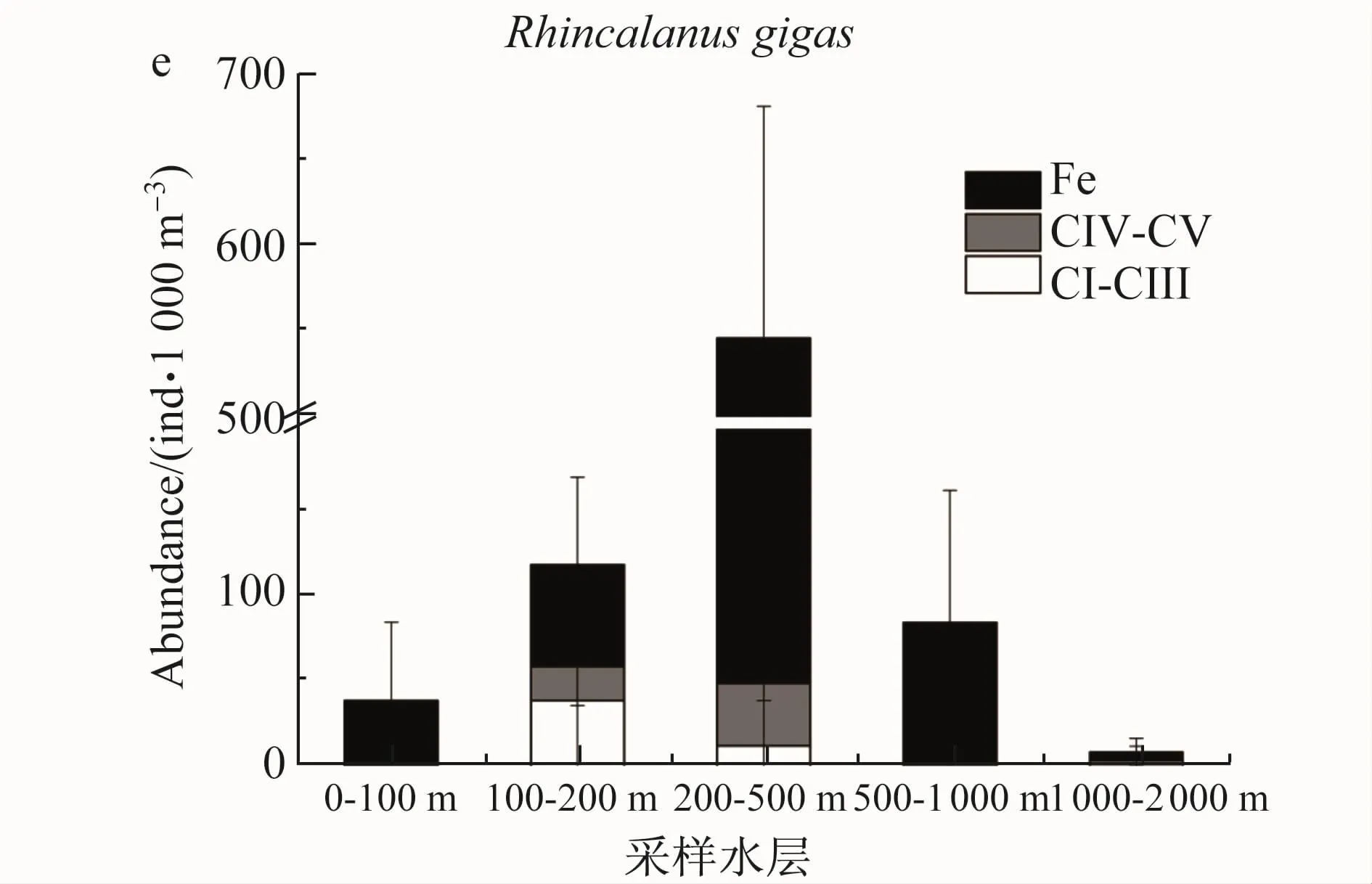
图4 (a)Euphausia superba;(b)Calanoides acutus;(c)Calanus propinquus;(d)Metridia gerlachei及(e)Rhincalanus gigas的种群垂直结构Fig.4.Vertical distribution and population structure of Euphausia superba(a),Calanoides acutus(b),Calanus propinquus(c),Metridia gerlachei(d)and Rhincalanus gigas(e)
2.3 群落与环境因子之间关系
群落与环境因子相关的Bio-Env分析显示叶绿素a和盐度分别是对群落聚类起关键影响的单因子,相关系数pw分别为0.61和0.52,水深、盐度和叶绿素a组合则最好地解释了群落的划分,相关系数pw可达到0.77(表4)。

表4 Bio-Env分析结果Table 4.Results of Bio-Env analysis
3 讨论
与以往在南设得兰岛海域的研究结果相比,浮游动物在物种组成上有很大的相似性[3],桡足类和磷虾对浮游动物群落总丰度的贡献可达到90%以上。其中小型桡足类包括O.similis、C.citer、O.curvata几乎是所有站位的优势物种(表3)。随着南大洋浮游动物调查拖网网目的精细化,小型桡足类在生态系统的作用将越来越受到人们重视[10-11]。
站位D1-3、D3-1温度高于站位 D4-9和 D5-9(图3),但本研究4个采样站位温度、盐度的水深垂向结构模式相似:即表层至200 m逐渐降低,200—500 m受到绕极深层水涌升的影响温度逐渐增高,500 m以深主要是高盐的深层水(图3)。4个站位浮游动物群落结构无明显的区域差异,而是呈现显著的水深特异性:群落1主要由采自上层水体的样品构成,群落2主要包括采自200—1 000 m的中层水的样品,而群落3由1 000 m以深的样品组成(图2)。Simper分析显示相对于采自中层水的群落2和较深层水的群落3,群落1具有更高的内部不相似性(图2,表3)。这可能是因为夏季南大洋上层水体受到更多的冰-海-气相互作用[12],与深层水中的浮游动物相比,处于表层水体的物种对环境影响更为敏感,从而呈现更大的不相似性。这也从侧面反映南大洋生态调查较为普遍的0—200 m垂直拖网样品是研究浮游动物群落年际变动及对环境变化响应的良好材料[13-14]。
本研究中磷虾与桡足类种群水平分布上呈现一定的垂直隔离。E.superba种群主要聚集在0—200 m水体,而南大洋四种典型的中型桡足类C.acutus、C.propinquus、M.gerlachei及R.gigas则主要聚集于200—1 000 m水体(图4)。作为南大洋浮游动物群落的重要组成类群,桡足类和磷虾的垂直隔离将利于其避免种间饵料竞争,从而更好地适应南大洋环境[15]。
E.superba夏季种群补充时,受精卵下沉至深水孵化,然后无节幼体逐渐向上迁移,到达饵料丰富的真光层时幼体正好发育至可摄食的原蚤状幼体CⅠ期。这种发育模式可提高E.superba孵化率和幼体存活率[16]。本研究中,E.superba种群主要集中在0—200 m水体,以原蚤状幼体CⅠ—Ⅲ期为主(图4a),更高发育期蚤状幼体后期FⅣ—Ⅵ及未成体分布在较深层200—1 000 m水体中(图4a)。E.superba受精卵中脂类储存高达50%,发育至原蚤状幼体CⅠ期时脂类储存降到最低[17]。原蚤状幼体期对饵料依赖性较强,而蚤状幼体及未成体通过饵料摄食体内脂类贮存更为丰富[17]。E.superba种群的垂直分布结构有利于其自身避免种内竞争,从而更好地维持种群生物量。
南大洋桡足类采取不同的生活史策略来应对高度变化的饵料环境[18]。做为南大洋大中型桡足类的优势物种,C.acutus、C.propinquus、M.gerlachei及R.gigas具有一定的季节性垂直移动行为[18]。夏季多数桡足类种群集中在初级生产力较高的表层水体摄食获取能量从而完成种群补充[13]。与以往研究结果相似,本研究中这4种桡足类均有70%以上的种群分布在500 m以上水体,并且0—200 m均有大量的早期桡足幼体CⅠ—Ⅲ(图4)。C.acutus是南大洋典型的植食种,其在夏季浮游植物爆发时大量摄食并以蜡脂的形式储存能量,冬季由后期CⅣ—Ⅴ桡足幼体和雌体占主导的种群于深水中以滞育的形式进行越冬[19-20]。本研究中C.acutus部分后期桡足幼体和雌体种群已经提前进入深水区(图4b),是否是因为深水区种群已经储存了足够的能量还是其他的原因需要我们进一步进行研究(图4e)。C.propinquus是典型的机会主义摄食物种,整个生活史过程(甚至是冬季)处于活跃状态[21],其主要的能量贮存形式三脂酰甘油需要C.propinquus不断进行摄食[22]。本研究中大量的早期桡足幼体说明C.propinquus相对其他桡足类物种,具有延长的繁殖期[23]。M.gerlachei被普遍认为是中层水物种[24],与以往观点一致,本研究中M.gerlachei主要分布在200—1 000 m水体(图4d)。
南大洋桡足类同时具有一定的昼夜垂直移动行为[25-26],而我们本研究采样时间跨度较大,可能会对结果有一定的影响。Atkinson等[25]对South Georgia海区0—200 m水体浮游动物昼夜垂直移动进行了研究,而对200 m水体以深样品未进行分析。而Flores等[26]认为南大洋夏季浮游动物昼夜垂直移动对群落垂直结构的影响可忽略。在今后的浮游动物群落垂直结构研究中,我们需尽可能地统一时间,并增加昼夜连续站观测,从而对不同取样时间数据进行校正。
以往南大洋浮游动物研究显示温度及饵料(叶绿素a)很好地解释了浮游动物群落种群的分布模式[3,13]。Bio-Env分析显示叶绿素a和盐度是影响南设得兰岛海域浮游动物群落垂直分布的关键影响因子(表4)。群落1所处0—200 m水体相对较低的盐度(表2,图2)可指示夏季融冰作用,夏季海冰融化形成的稳定水体及光照的增强可以同时促进南大洋浮游植物的爆发[25],从而为浮游动物种群补充提供饵料。与影响东南极普里兹湾浮游动物群落结构影响因子一致[13],本研究中叶绿素a及盐度(融冰效应)均可说明上行效应对南设得兰岛海域浮游动物群落垂直分布的影响。
致谢感谢中国第28次南极科学考察雪龙船全体船员对现场样品采集的帮助,感谢国家海洋局第二海洋研究所韩正兵提供叶绿素数据。
1 Hays G C,Rihardson A J,Robinson C.Climate change and marine plankton.Trends in Ecology&Evolution,2005,20(6):337—344.
2 Hunt B PV,Hosie GW.The seasonal succession of zooplankton in the Southern Ocean south of Australia,partⅠ:The seasonal ice zone.Deep Sea Research PartⅠ:Oceanographic Research Papers,2006,53(7):1182—1202.
3 Ward P,Whitehouse M,Shreeve R,etal.Plankton community structure south and westof South Georgia(Southern Ocean):Linkswith production and physical forcing.Deep Sea Research PartⅠ:Oceanographic Research Papers,2007,54(11):1871—1889.
4 Clarke A,Tyler P A.Adult Antarctic krill feeding at abyssal depths.Current Biology,2008,18(4):282—285.
5 Schmidt K,Atkinsion A,Steigenberger S,etal.Seabed foraging by Antarctic krill:Implications for stock assessment,bentho-pelagic coupling,and the vertical transfer of iron.Limnology and Oceanography,2011,56(4):1411—1428.
6 Atkinson A,Whitehouse M J,Priddle J,et al.South Georgia,Antarctica:A productive,coldwater,pelagic ecosystem.Marine Ecology Progress Series,2001,216:279—308.
7 黄洪亮,陈雪忠,冯春雷.南极磷虾资源开发现状分析.渔业现代化,2007,34(1):48—51.
8 Field JG,Clarke K R,Warwick R M.A practical strategy for analyzingmultispecies patterns.Marine Ecology Progress Series,1982,8:37—52.
9 Dufrene M,Legendre P.Species assemblages and indicator species:the need for a flexible asymmetrical approach.Ecological Monographs,1997,67(3):345—366.
10 Atkinson A,Ward P,Hunt B PV,et al.An overview of Southern Ocean zooplankton data:abundance,biomass,feeding and functional relationships.CCAMLR Science,2012,19:171—218.
11 Makabe R,Tanimura A,Fukuchi M.Comparison ofmesh size effects on mesozooplankton collection efficiency in the Southern Ocean.Journal of Plankton Research,2012,34(5):432—436.
12 Williams G D,Nicol S,Aoki S,et al.Surface oceanography of BROKE-West,along the Antarctic margin of the south-west Indian Ocean(30—80°E).Deep Sea Research PartⅡ:Topical Studies in Oceanography,2010,57(9-10):738—757.
13 Yang G,LiC L,Sun S.Inter-annual variation of summer zooplankton community structure in Prydz Bay,Antarctica,from 1999 to2006.Polar Biology,2011,34(6):921—932.
14 Swadling K M,Penot F,Vallet C,et al.Interannual variability of zooplankton in the Dumont d’Urville sea(139°E—146°E),east Antarctica,2004—2008.Polar Science,2011,5(2):118—133.
15 Atkinson A,Ward P,Hill A,et al.Krill-copepod interactions at South Georgia,Antarctica,Ⅱ.Euphausia superbaas amajor control on copepod abundance.Marine Ecology Progress Series,1999,176:63—79.
16 Siegel V.Distribution and population dynamics ofEuphausia superba:summary of recent findings.Polar Biology,2005,29(1):1—22.
17 Kattner G,Hagen W.Lipid metabolism of the Antarctic euphausiid Euphausia crystallorophias and its ecological implications.Marine Ecology Progress Series,1998,170:203—213.
18 Atkinson A.Life cycle strategies of epipelagic copepods in the Southern Ocean.Journal of Marine Systems,1998,15(1-4):289—311.
19 Voronina NM.The effectof sea ice on the life cyclesofmass species of Antarctic copepods in theWeddell Sea.Oceanology,2003,43(6):832—839.
20 Graeve M,Hagen W,Kattner G.Herbivorous or omnivorous?On the significance of lipid compositions as trophic markers in Antarctic copepods.Deep Sea Research PartⅠ:Oceanographic Research Papers,1994,41(5-6):915—924.
21 Schnack-Schiel SB,Hagen W.Life cycle strategies ofCalanoides acutus,Calanus propinquus,Metridia gerlachei(Copepoda:Calanoida)in the eastern Weddell Sea,Antarctica.ICES Journalof Marine Science,1995,52(3-4):541—548.
22 Pasternak A,Hagen W,Kattner G,et al.Lipid dynamics and feeding of dominant Antarctic calanoid copepods in the eastern Weddell Sea in December.Polar Biology,2009,32(11):1597—1606.
23 Schnack-Schiel SB,Hagen W.Life cycle strategies and seasonal variations in distribution and population structure of four dominant calanoid copepod species in the eastern Weddell Sea,Antarctica.Journal of Plankton Research,1994,16(11):1543—1566.
24 Hopkins T L,Torres J J.The zooplankton community in the vicinity of the ice edge,western Weddell Sea,March 1986.Polar Biology,1988,9(2):79—87.
25 Atkinson A,Ward P,Williams R,et al.Diel verticalmigration and feeding of copepods at an oceanic site near South Georgia.Marine Biology,1992,113(4):583—593.
26 Flores H,Hunt B PV,Kruse S,et al.Seasonal changes in the vertical distribution and community structure of Antarcticmacrozooplankton andmicronekton.Deep Sea Research PartⅠ:Oceanographic Research Papers,2014,84:127—141.
