乌索酸的研究进展及分析检测方法
2015-01-29刘红星黄初升韦柳斌
陆 倩,刘红星,黄初升,韦柳斌
(1.广西师范学院化学与材料科学学院,广西 南宁 530001;2. 广西科技大学医学院,广西 柳州 545006)
乌索酸(ursolie acid,UA)又名熊果酸、乌苏酸,是一种五环三萜类化合物,以游离形式或与糖结合成苷的形式分布于约7个科46个属62种天然植物中。乌索酸具有特殊的气味,分子式为C30H48O3,结构式见图1,分子量为456.68,熔点285~288℃。易溶于二氧六环、吡啶,在无水乙醇中得大而有光泽的棱晶,而在稀乙醇中得细得像毛似的针晶;溶于甲醇、乙醇、丁醇、丁酮,略溶于丙酮,微溶于苯、氯仿、乙醚,不溶于水和石油醚。乌索酸具有多种生物学效应,如镇静安定、保肝、抗炎抗菌、降血脂、抗氧化[1-5],另外,还能增强免疫力,对艾滋病病毒具有抑制作用[6]。乌索酸作为主要化学成分,在不同的应用品中如化妆品、保健品、药品等,对其含量、纯度等的要求各不相同,因此,分析测定乌索酸的方法及手段种类繁多,表现出的测定能力各有不同。本文对乌索酸的研究进展及检测方法综述如下。
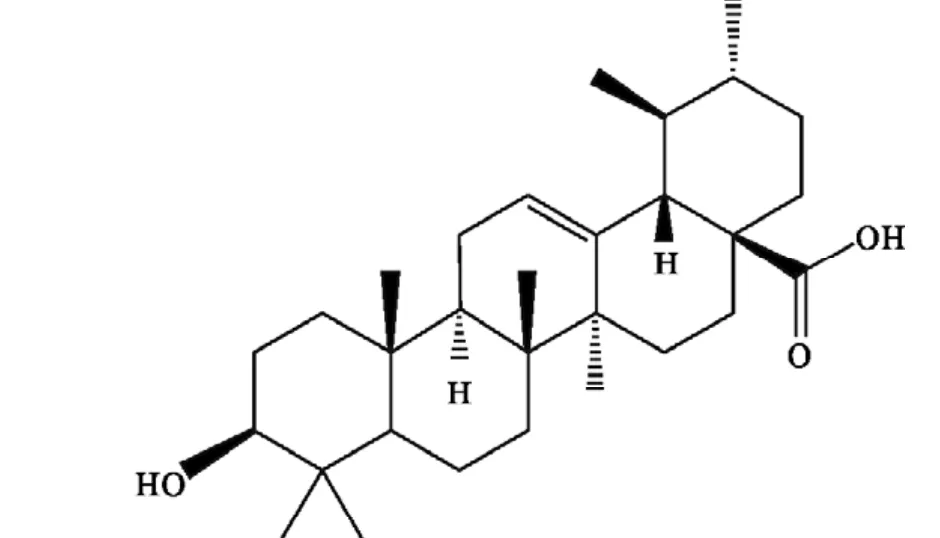
图1 乌苏酸结构式
1 研究进展
1.1 提取分离
现代药理研究中,熊果酸的提取采用溶剂萃取法居多,同时也有热回流提取法、超声波辅助法、超临界萃取法、酶法等。分离多采用柱层析法(如大孔树脂、硅胶、反相C18、葡聚糖凝胶),近年来,(半)制备型高效液相[7]等现代分离方法也逐渐成为热门选择。
李金强等人[8]用70%丙酮冷浸提取淡黄香茶菜地下部分,再用乙酸乙酯、正丁醇萃取,选取乙酸乙酯萃取物用硅胶、葡聚糖凝胶、大孔树脂等多种柱色谱技术进行分离纯化,分离鉴定11个化合物,其中有2个为乌索酸类化合物。林江萧等人[9]采用95%乙醇热回流法从枇杷叶中提取熊果酸衍生物科罗索酸,并通过大孔树脂富集纯化、硅胶柱层析及制备色谱纯化得到不同纯度的科罗索酸样品。陈亮等人[10]以常见树种女贞作为试验材料,采用纤维素酶法提取女贞中的熊果酸,用分光光度法通过正交试验确定提取熊果酸的最佳条件,并进一步探讨在金叶女贞不同部位中熊果酸含量的差异。韩伟等人[11]对微波辅助超声提取枇杷叶熊果酸过程的主要参数进行了优化。罗容珍等人[12]采用微波-超声波协同作用的方法对熊果酸的提取工艺进行了研究。
1.2 活性研究
王博龙[13]通过实验观察乌索酸对人HSC凋亡及TGFB1mRNA表达的影响,以探索其在抗肝纤维化方面的作用。吴斌等人[14]以Jurkat细胞为例,张婷等人[15]以人单核细胞白血病细胞株THP-1为例,探讨乌索酸对细胞的诱导凋亡作用及其分子机制。郝耀梅等人[16]将中空纤维溶剂棒微萃取法结合HPLC同时快速地测定齐墩果酸和熊果酸与牛血清白蛋白和人血清白蛋白的蛋白结合率。王宏婷等人[17]以MDA-MB-231细胞为研究对象,研究27-O-(E)香豆酰基-乌索酸细胞凋亡的诱导作用。陆云华等人[18]用薄膜分散法以乌索酸样品为原料制备乌索酸豆磷脂纳米粒,优选配方工艺,测试理化性质,为乌索酸抗肿瘤药物的研究开发奠定了基础。
1.3 衍生物合成
由于UA的脂溶性和水溶性都比较差,不容易穿透生物膜,限制了其在药理学方面的一些应用,此外,含有羧基的药物一般对胃肠道具有较大的刺激性,并且羧基在人体内新陈代谢过程中常常不稳定。近几年,熊果酸衍生物的合成多是对C3、C17、C28,也有一些在 C2[19-21]、C23[22]位。
孟艳秋等人[23]对熊果酸3位和28位进行改造,合成了16个熊果酸的衍生物(其中11个化合物为首次报道的化合物),并对其进行了体外抗肿瘤活性的筛选。结果表明,熊果酸3位羟基氧化、28位羧基成酯不能提高抗肿瘤活性,但28位羧基所连接胺的结构对抑制活性有较大的影响。
1.4 结构修饰
白锴凯等人对熊果酸的C28位进行修饰[24],并进一步对其进行PEG改性,合成了7个熊果酸系列衍生物。结果发现,所得化合物在水溶性得到较大改善的同时,其抗癌活性与熊果酸相当或者更强。对C3、C28位进行修饰[25],合成了11个具有不同电负性基团的熊果酸系列衍生物。抗癌活性结果为:熊果酸衍生物的水溶性较熊果酸有明显改善;荷负电基团的熊果酸衍生物抑癌活性远低于熊果酸,而负载正电性基团显著提高了熊果酸的体外抗癌活性。对熊果酸C3、C17进行化学修饰[26],合成携有伯氨基的衍生物,并进一步采用具有不同脂溶性的氨基酸进行化学改性,制备了8个氨基酸改性熊果酸衍生物。体外抗癌实验表明,这些衍生物对胃癌细胞BGC-823和AGS的抑制能力明显强于熊果酸母核。
赵龙铉等人[27]对C28位进行结构修饰及C3位引入氨基酸,共设计合成了10种熊果酸氨基酸衍生物。抑菌活性结果表明,当UA连接脂肪族的氨基酸时,其活性与连接芳香族的氨基酸相比,活性更高。
王慧[28]先对UA分子上的C3位-OH进行氧化,然后对C17位-COOH进行酯化,得到5种熊果酸皂苷和7种3-羰基熊果酸酯。实验证明,如果在熊果酸C3位联接糖,通过增加羟基的数目,改善其亲水性,以增强其抗肿瘤活性的方法对人骨髓瘤U266细胞可能是行不通的,随着化合物中羟基数量的增多,化合物的抗肿瘤活性反而有可能下降。如果在熊果酸C28进行酯化,适当增加C28位烷基侧链的长度,有助于改善其对某些细胞的抑制活性。朱美玲等人[29]对3位进行改造,合成了3个熊果酸的衍生物。熊果酸经过氧化和腙化后并未能改善抑制LTEP-α-2肺癌细胞的活性,但是,肟化后其活性明显增高。
1.5 定性定量分析
比较熊果酸各种分析方法可看出,HPLC法应用最多最广泛,与多种方法结合(如质谱、柱前荧光)能达到更好的检测效果。近年来,对于熊果酸定性定量分析多采用HPLC法。
邹盛勤等人[30]采用高效液相色谱法分离紫苏子和白苏子中乌索酸和齐墩果酸,并进行定性鉴别和定量分析。肖禹安等人[31]采用高效液相色谱质谱联用法,对枣霜的化学组成进行了定性定量分析,从枣霜中发现了18种三萜酸类成分,鉴定了其中的15种,3种为乌索酸型。肖彩虹等人[32]用HPLC法测定岗梅中熊果酸和齐墩果酸的含量。李洪权等人[33]采用RP-HPLC法对水线草中熊果酸和齐墩果酸进行含量测定,制订了水线草含量测定项中熊果酸和齐墩果酸的含量标准。袁恩光等[34]利用DBCETS作为荧光标记试剂,结合HPLC-FLD测定石榴中4种三萜酸,建立了三萜酸的快速、高灵敏HPLC检测方法。
2 乌索酸的检测方法
2.1 高效液相色谱法(HPLC)
HPLC 是最常见的分析方法,具有分离效率高、选择性好、检测灵敏度高、操作自动化、应用范围广等优点,但液相分析成本高,仪器价格及日常维护费用较贵,分析时间较长,不能分析在色谱条件下为气体的物质。常用的检测器有紫外波长检测器(UV)、蒸发光散射检测器(ELSD)和荧光检测器(FD)。
梁洁等人[35]采用HPLC法测定了广西产美味猕猴桃根中熊果酸的含量,具体操作为:美味猕猴桃根粗粉经超声提取后测定,选用Thermo Hypersil BDS C18色 谱 柱 (4.6mm×250mm,5μm); 柱 温20℃;流动相为乙腈∶0.1%磷酸水溶液(85∶15);流速1.0mL·min-1;G-1313A可变波长检测器,二极管阵列检测器,检测波长210nm,熊果酸的浓度在0.0125~0.1500mg·mL-1时与峰面积呈良好的线性关系,样品的平均回收率为99.35%。周春华等人[36]采用高效液相色谱法测定芍药中齐墩果酸和熊果酸含量,在超声波乙醇提取样品中熊果酸后,色谱柱选用 Lichrospher C18(250mm×4.6mm,5μm),流动相为甲醇∶0.1% 磷酸溶液(85∶15),柱温30℃,流速1mL·min-1,紫外检测器,检测波长210nm。在该色谱条件下,齐墩果酸与熊果酸能有效地洗脱,而且能被同时检测,其中熊果酸在25~100μg·mL-1范围内呈良好的线性关系,平均回收率为98.70%。冯翠兰等人[37]对从鸭脚树叶中提取的熊果酸进行初步研究,用高效液相色谱对熊果酸的含量进行跟踪,检测条件是:色谱柱为UltimateTM XB-C18柱(250mm×4.6mm,5μm);流动相为乙腈∶醋酸(99.6∶0.4),紫外检测器,波长为210nm;柱温为25℃,结果鸭脚树叶中熊果酸的提取率为90.3%,纯度为95.7%。
2.2 气相色谱法(GC)
GC法分离效率高,分析速度快,精密度高,检测限低,检测灵敏度高,选择性好,应用范围广,运行费用较低,仪器不易出故障。不足的是对于挥发性差的样品不适合直接进行测定,需先进行衍生化,也不能分析在高温下不稳定的化合物。
周静等[38]用毛细管气相色谱法测定女贞子中齐墩果酸和熊果酸含量,取女贞子氯仿提取液自然挥发干,甲醇溶解经甲酯化后,进样分析。色谱条件:HP-1毛细管柱(25 cm×0.32 mm,0.52μm),柱温280℃,氮气为载气,氢火焰检测器。分析结果表明,齐墩果酸和熊果酸的线性良好,其中熊果酸的回收率为99.8%±2.1%。所建立的气相色谱法可以作为女贞子药材的质量检测方法。黄建林等[39]建立了测定番石榴叶中熊果酸(UA)的气相色谱-质谱(GC-MS)方法。以双(三甲硅烷)三氟乙酰胺(BSTFA)为衍生化试剂,将UA 制成三甲基硅烷衍生物后,在Dβ-5 MS毛细管柱上进行分离,柱升温程序为:柱初温100℃,恒温保持2min,再以10℃·min-1的速度升温至300℃,保持14min。通过与标准样品对照比较保留时间和质谱确认样品中UA的色谱峰,以峰面积进行定量测定,UA在 4.7~114 μg·mL-1范围内线性良好,回收率为89.4%。
2.3 毛细管电泳法(CE)
毛细管电泳是近几年分析化学中发展最为迅速的领域之一,尤其是高压毛细管电泳(HPCE),兼有高压电泳的高速、高分辨率及HPLC 的高效率等优点。操作简单,分析速度快,分离模式多样化,应用范围广,样品用量少,溶剂消耗低,环境污染小,可对样品进行在线富集,使CE成为一种非常有前景的分析工具,近年来也在乌索酸测定上得到应用。但该方法分离能力较弱,对pH值要求较高,重现性差。
迟道兵等[40]建立了高效毛细管电泳(HPCE)法测定山茱萸中熊果酸含量的方法,其操作为:取样品经索氏提取后,以15mmol·L-1磷酸氢二钠、15mmol·L-1硼 砂(pH 9.22)、10% 甲 醇 的 缓冲体系作为运行电解质溶液,检测波长214nm,分离电压20kV进行分离检测,结果熊果酸在0.57~0.95mg·mL-1范围内线性关系良好,平均加样回收率为97.43%。张锋等[41]采用毛细管电泳高频电导法测定了夏枯草中熊果酸的含量,其方法为:样品经索氏提取后以布洛芬为内标,采用毛细管区带电泳,高频电导检测,未涂层弹性融硅石英毛细管柱(55cm×75μm ID,有效长度 46cm),1.2mmol·L-1三乙胺-HCl(pH=10. 60)、β-环糊精(0.08mmol·L-1)为运行缓冲液,分离电压12.5kV,重力进样10s(高度 20cm),结果熊果酸在 4.3~120.4μg·mL-1范围内线性关系良好,加样回收率为98.2%。
2.4 分光光度法
分光光度法操作简单易行,灵敏度高,成本低廉,常用于乌索酸的定量分析,但该方法的准确度相对不高。
廖晓峰等[42]用5%香草醛冰醋酸、高氯酸显色,以熊果酸纯品为对照,在548nm处对桅子中熊果酸的含量进行测定。实验结果表明,其回收率为98.66%,且在1h内稳定。该方法操作方便,重现性好,可用于桅子质量控制。李国章等[43]建立了湘产3种苦丁茶中熊果酸含量测定的分光光度法,同样是用索氏提取器提取后,加入5%香草醛-冰醋酸、高氯酸显色,在波长548nm处测定吸光度,结果熊果酸在4~20μg·mL-1浓度范围内线性关系良好,加样回收率为98.96%。曾小明[44]、杨艳等人[45]用的也是这种方法。
2.5 薄层扫描法(TLCS)
薄层扫描法对样品的前处理要求较低,费时短,操作简单,结果直观,可同时分离和测定复杂样品,但手动操作时人为影响因素大,重现性不好。
白洁等[46]采用双波长薄层扫描法测定了夏枯草中熊果酸的含量,具体操作为:提取并处理样品后,采用硅胶G板,以环己烷-氯仿-醋酸乙酯(20∶5∶8)为展开剂,用10%硫酸乙醇溶液显色,选用λS=540 nm,λR=700nm进行双波长反射式锯齿扫描,结果熊果酸在0.314~1.570μg范围内线性关系良好,加样回收率为99.3%。罗珍妹等[47]用薄层扫描法测定降脂颗粒中熊果酸含量,在提取并处理样品后,采用硅胶G板,以氯仿-丙酮(9∶1)为展开剂,用10%硫酸乙醇溶液显色,选用λS=520 nm,λR=700 nm,直线式扫描,狭缝宽度6mm×0.2mm,熊果酸点样量在0.538~3.228μg范围内线性关系良好,加样回收率为99.1%。
2.6 其他方法
乌索酸的含量测定除以上几种方法外,文献报道的还有β-环糊精增敏荧光法、近红外光谱法(NIRS)和毛细管胶束电动色谱法(MECC)等,但这些方法往往因为条件限制或准确度不够高等原因,使用率较低。
赵二劳等人[48]利用荧光光谱法探讨了熊果酸与β-环糊精(β-CD)间的超分子相互作用。李蕾蕾等人[49]利用近红外光谱法快速测定枇杷叶中熊果酸的含量。刘海兴等人[50]用毛细管胶束电动色谱法测定夏枯草中2种有效成分,方法是以15mmol·L-1磷酸氢二钠 (Na2HPO4)、15mmol·L-1硼砂 (Na2B4O7)、10mmol·L-1十二烷基硫酸钠 (SDS)、5%乙醇的缓冲溶液作为运行电解质溶液,运行电压为16kV,紫外检测波长为214nm,实验温度为26℃,重力进样时间为5s。熊果酸线性范围为0.57~4.12g·L-1,在20min实现了齐墩果酸和熊果酸的基线分离。邢志霞等人[51]用毛细管胶束电动色谱法测定夏枯草中齐墩果酸、熊果酸含量。
3 小结
综观多种乌索酸的分析检测方法,HPLC因其分析范围广,速度快,分离效能高,常用的检测器类型多,选择性大,是现今在乌索酸的分析检测中最常见、最广泛使用的分析方法之一。相比之下,GC法精密度高,检测限低,但对于含有羟基和羧基的乌索酸要先进行衍生化后才能测定。同时,对组分直接进行定性分析时,必须用已知物或已知数据与相应的色谱峰进行对比,或与其他方法(如质谱、光谱)联用,才能获得直接肯定的结果;定量分析时,也需要用已知物纯样品对检测后输出的信号进行校正。CE尤其是HPCE,具有高速、高分辨、高效率等优点,但可操作性难度大,不适合简捷检测,同时由于毛细管直径小,光路太短,用一些检测方法(如紫外吸收光谱法),灵敏度较低。分光光度法操作简单易行、成本低廉,常用于乌索酸的定量分析,但因三萜类化合物在无水条件下与强酸(硫酸、磷酸、高氯酸)、中等强酸(三氯乙酸)作用,会产生颜色变化或荧光显色条件不稳定。薄层色谱法扫描测定乌索酸的含量,准确度较高,但其所需扫描仪设备价格也较高,而且过程中同样存在点样、展开等步骤,时间长,人为的影响因素也较大。综上所述,HPLC是目前测定乌索酸的最佳选择。
[1] 王鹏,张忠义,吴忠.熊果酸在药用植物中的分布及药理作用[J].中药材,2000,23(11):717.
[2] 肖坤福,郑云法,刘成左,等.熊果酸的研究进展[J].时珍国医国药,2005,16(12):1298.
[3] 孟艳秋,陈瑜,王趱,等.熊果酸的研究进展[J]. 中国新药杂志,2007,16(1):25-28.
[4] 盛艳乐,赵大球,周春华,等.植物熊果酸和齐墩果酸分析的研究进展[J].中国农学通报, 2009,25(23):347-350.
[5] 李华荣,孙鑫.熊果酸含量测定方法研究进展[J].时珍国医国药,2010,21(6):1564-1565.
[6] 杨秀伟,赵静,马超美,等.七叶树皂苷和熊果酸类化合物对HIV-1蛋白酶活性抑制作用的初步研究[J].中国新药杂志,2007,16(5):366-369.
[7] 于丽丽,刘巧,陈丹,等.制备型高效液相色谱法在天然药物分离中的应用[J].中华中医药学刊,2009,27(7):1465-1467.
[8] 李金强,赵明早,张宇. 淡黄香茶菜地下部位化学成分[J].中国实验方剂学杂志,2014,20(24):106-109.
[9] 林江萧,黄娟,袁玲,等.批杷叶中科罗索酸的分离纯化及其抗肿瘤活性研究[J].海峡药学,2014(8):25-28.
[10] 陈亮,夏晓芬,侯忍,等.金叶女贞中熊果酸的提取工艺研究[J].安徽农业科学,2011,39(30):18481-18483.
[11] 韩伟,刘曦,黄伯骏. Box-Behnken响应面法优化枇杷叶熊果酸的提取工艺[J].徐州 工程学院学报:自然科学版,2015,30(1):1-8.
[12] 罗容珍,杜怀明,张利,等.微波-超声波协同辅助夏枯草中熊果酸的提取工艺研究[J].四川理工学院学报:自然科学版,2011,24(11):98-101.
[13] 王博龙.乌索酸对人肝星状细胞凋亡及TGFβ1 mRNA表达的影响[J].中国药理学通报,2010,26(3):417-418.
[14] 吴斌,汪旭,王慧涵,等.乌索酸诱导Jurkat细胞凋亡及其机制的初步研究[J].中国实验血液学杂志,2010,18(1):61-66.
[15] 张婷,沈晶,任天年,等. 乌索酸诱导人单核细胞白血病细胞株THP-1分化的研究[J]. 中国药科大学,2010,41(6):572-576.
[16] Hao Yaomei, Chen Xuan, Hu Shuang, et al. Solvent Bar Microextraction with HPLC for Determination and Protein-Binding Characteristics of Oleanolic Acid and Ursolic Acid[J]. Chromatographia, 2014(77): 359-363.
[17] 王宏婷,王存琴.27-O-(E)香豆酰基-乌索酸通过调控JNK/SAPK通路诱导人乳腺癌细胞MDA-MB-231细胞凋亡[J].中国药学杂志,2015,40(4):722-726.
[18] 陆云华,曹丽萍,李茜,等.薄膜分散法制备乌索酸豆磷脂纳米粒及其理化性质研究[J].时珍国医国药,2015,26(1):104-106.
[19] 中国药科大学.新型五环三萜衍生物、其制备方法及用途:中国,102399254[P].2012-04-04.
[20] 中国药科大学.2-羟基-3-脱氧五环三萜类化合物及其衍生物、其制备方法及用途:中国,101367861[P].2009-02-18.
[21] 中国药科大学.熊果烷型五环三萜氨基酸衍生物、其制备方法及其医药用途:中国,101337984[P].2009-01-07.
[22] 美国帕纳克斯医药公司.新三萜衍生物、其制备方法及其应用:中国,1871251[P].2009-11-29.
[23] 孟艳秋,刘丹,白忠伟,等.熊果酸衍生物的合成及抗肿瘤活性的研究[J].药学学报,2011,46 (5):556-560.
[24] 白锴凯,陈芬玲,郭养浩,等.聚乙二醇缀合熊果酸衍生物的合成及体外抗癌活性[J].中国新药杂志,2012,21(13):1536-1540.
[25] 白锴凯,陈芬玲,郭养浩,等.熊果酸衍生物的合成及对前列腺癌PC-3细胞的抑制活性[J].中国新药杂志,2012,21(22):2667-2673.
[26] 白锴凯,陈芬玲,郑允权,等.氨基酸改性熊果酸衍生物的合成及对胃癌细胞的抑制作用[J].中国药学杂志,2012,47(4):265-369.
[27] 赵龙铉,杨君微,郑昌吉,等.熊果酸衍生物的合成与表征及其抑菌活性研究[J].辽宁师范大学学报:自然科学版 ,2012,35(3):358-363.
[28] 王慧.熊果酸衍生物的合成及其抗肿瘤活性的初步研究[D].成都:四川师范大学,2012.
[29] 朱美玲,葛文中,赵蕊.熊果酸衍生物的合成及其对肺癌细胞活性抑制的研究[J].激光生物学报,2014,23(5):465-471.
[30] 邹盛勤,陈武.RP-HPLC法测定紫苏子、白苏子中乌索酸和齐墩果酸含量[J].粮食与油脂, 2008(2):43-45.
[31] 肖禹安,王红庚,王英平.枣霜化学成分的色谱质谱分析[J].特产研究,2014(4):55-59.
[32] 肖彩虹,余以刚,罗苑苑,等.HPLC法测定岗梅中熊果酸和齐墩果酸的含量[J].中国药房,2015,26(9):1261-1263.
[33] 李洪权,柏玉冰,周亚敏,等.水线草熊果酸和齐墩果酸含量测定[J].中国当代医药,2015,22(8):12-19.
[34] 袁恩光,李国梁,吴宏亮,等.柱前荧光标记法结合HPLC-FLD测定石榴中四种三萜酸[J].天然产物研究与开发,2015,27(2):214-220.
[35] 梁洁,甄汉深,李生茂,等.高效液相色谱法测定广西产美味猕猴桃根中熊果酸的含量[J].时珍国医国药,2009,20(5):1025.
[36] 周春华,吕三三,张 莹,等.高效液相色谱法测定芍药中齐墩果酸和熊果酸含量[J].食品科学,2011,32(16):265-268.
[37] 冯翠兰,潘带卿,刘嫒姬.从鸭脚树叶中提取熊果酸的初步研究[J].科技创新导报,2011(32):4-5.
[38] 周静,刘垣升.气相色谱法测定女贞子中齐墩果酸和熊果酸的含量[J].中国新药与临床杂志, 2003,22(10):596-596.
[39] 黄建林,张展霞. GC-MS同时测定番石榴叶中的齐墩果酸和熊果酸[J].分析测试技术与仪器, 2005,11(3):178.
[40] 迟道兵,陈红红,李助乐,等.高效毛细管电泳测定山茱萸中熊果酸含量的方法探讨[J].食品科技,2008,33(5):222.
[41] 张锋,朱培仪,宋粉云.毛细管电泳高频电导法测定夏枯草中齐墩果酸和熊果酸的含量[J].广东药学院学报,2008,24(2):108.
[42] 廖晓峰,陈正行,李永忠,等.栀子中熊果酸的提取与比色法检测[J].食品工业科技,2005,26 (2):76-78.
[43] 李国章,于华忠,卜晓英,等.分光光度法测定湘产苦丁茶中熊果酸含量[J].光谱实验室,2006,23(2):401.
[44] 曾小明.野生猕猴桃根熊果酸微波萃取工艺的响应面优化[J].食品与机械,2009,25(2):133-136.
[45] 杨艳,任亚梅,周九庆,等.猕猴桃根熊果酸超声波提取工艺的响应面优化[J].食品科学,2014,35(4):44-49.
[46] 白洁,陈翔飞,孙海峰.双波长薄层扫描法测定夏枯草中熊果酸的含量[J].时珍国医国药,2007,18(5):1150.
[47] 罗珍妹,苏建新.薄层扫描法测定降脂颗粒中熊果酸含量[J].中成药,2008,30(7):附12-附13.
[48] 赵二劳,李满秀,刘芳. β-环糊精增敏荧光法测定山楂中熊果酸的研究[J].分析科学学报, 2008,24(3):350.
[49] 李蕾蕾,王海霞,黄洁燕,等.近红外光谱法快速测定枇杷叶中熊果酸的含量[J].中国实验方剂学杂志,2013,19(23):104-108.
[50] 刘海兴,杨更亮.毛细管胶束电动色谱法测定夏枯草中两种有效成分[J].分析化学,2000,28(10):1275.
[51] 邢志霞,崔燕兵,赵喜兰.毛细管胶束电动色谱法测定夏枯草中齐墩果酸、熊果酸含量[J].药品鉴定,2009,16(24):47.
