新型聚合物胶束电动色谱法分离5种植物激素
2015-01-20陈吓俤卢巧梅程锦添张兰
陈吓俤+卢巧梅+程锦添+张兰


摘 要 随着植物激素的滥用及使用不当导致的食品安全问题逐渐增多,加强食品中植物激素的痕量检测显得日益重要。本研究制备了具有两亲性的聚 (甲基丙烯酸苄基酯-甲基丙烯酸)胶束,成功地将5种植物激素分离,建立了一种植物激素痕量检测的聚合物胶束毛细管电动色谱方法,本方法高效、快速、重现性好。经过优化,得到了最佳色谱条件:2 g/L聚合物胶束,50 mmol/L NaOH-H3BO3 缓冲液 (pH 9.2);运行电压 15 kV。采用此方法分析实际样生根粉溶液,成功检测到萘乙酸。
关键词 两亲性聚合物胶束; 毛细管电泳; 植物激素; 生根粉
1 引 言
植物激素包括内源与外源植物激素。其中,外源植物激素是指人们仿照植物激素的化学结构或生理作用,合成具有类似植物激素活性的化学物质。外源植物激素与其它农药一样,也具有一定的毒性[1~3]。市场上有许多水果、蔬菜存在植物激素残留的问题,长期食用会使人体内分泌紊乱,影响人的正常代谢平衡[4]。因此,为促进食品安全和人体健康,加强植物激素的快速痕量检测尤为重要。
目前,检测植物激素的常用方法有高效液相色谱法(HPLC)和气相色谱法(GC) 等。HPLC法高效、灵敏度高,但是需要消耗大量有机试剂,成本高;GC法专一性强,但是需要对各个样品硅烷化、酰化或酯化等衍生化处理[5~7]。毛细管电泳(Capillary electrophoresis,CE) 具有微量、高效和快速等优点,适用于食品中植物激素残留的快速检测[8~11]。关于聚合物胶束的研究很多,主要集中在药物控释放方面,如王永中等[12]制备了紫杉醇Pluronic P105聚合物胶束,显著增溶药物PTX,逆转其耐药性。王磐等[13]制备了两亲性嵌段共聚物,实验表明, 其在生理环境下具有较好的缓释作用。但是,将两亲性聚合物胶束应用到毛细管电泳的报导较少。聚合物胶束毛细管电泳是以聚合物胶束为假固定相 (Pseudo stationary phase,PSP) 的一种 CE 分离模式[14,15]。其中,两亲性聚合物胶束电泳与一般的胶束电泳相比,同时具备亲水性和疏水性,选择性与分辨率更高,焦耳热更小,基线噪声更小,胶束更稳定,临界胶束浓度(Critical micelle concentration,CMC)更低[16],对痕量植物激素能更高效、快速检测的特点。
本研究制备了甲基丙烯酸苄基酯 (Benzyl methacrylate,BMA)-甲基丙烯酸 (Methacrylic acid,MAA) 两亲性聚合物胶束, 并将其应用于毛细管电泳,通过优化色谱分离条件,建立了一种简单快速且适用于实际样中植物激素测定的新方法,为食品中植物激素残留检测提供技术参考。
2 实验部分
2.1 仪器与试剂
毛细管电泳仪(Agilent公司);PHS-3D型pH计(上海三信仪表厂);HGC-24 A氮吹仪(厦门精艺兴业科技有限公司);BS124S型电子分析天平(德国赛多利斯科学仪器有限公司)。
单体MAA、BMA(Alfa Aesar公司);偶氮二异丁腈(化学纯),NaOH(分析纯),均购自天津市福晨化学试剂厂;激动素(Kinetin, KT)、脱落酸(Abscisic acid, ABA)、吲哚丁酸(Indolebutyric acid, IBA)、萘乙酸(Naphthylacetic acid, NAA)和水杨酸(Salicylic acid, SA),均购自百灵威化学试剂公司。甲醇、乙醚、1, 4-二氧六环(色谱纯),硼酸,HCl(分析纯),均购自国药集团上海化学试剂有限公司。实验用水经Milli-Q净化。
2.2 缓冲溶液、标准溶液及生根粉溶液的制备
准确称取1.4991 g AIBN 溶于90 mL 1,4-二氧六环中,加入单体0.1848 mol BMA、0.1232 mol MAA (6∶4),氮吹30 min,60 ℃恒温水浴搅拌24 h,冷却,乙醚沉淀。沉淀物溶于1,4-二氧六环,乙醚沉淀,反复两次,真空干燥。将产物溶于NaOH溶液中,搅拌20 min,用H3BO3溶液调pH值,即得聚合物P(BMA-MAA)的H3BO3缓冲溶液。
准确称取KT, ABA, IBA, NAA和SA标准品,用甲醇配成标准液,置4 ℃贮存。实验前用甲醇稀释成所需浓度。
准确称取12.0 mg生根粉,用二次蒸馏水定容至100 mL,超声15 min。实验前用0.22 μm滤膜过滤。
2.3 色谱条件
运行电压: 15 kV;聚合物胶束浓度: 2.0 g/L; pH 9.2、50 mmol/L NaOH-H3BO3缓冲液; 压力进样: 50 kPa/6 s; 检测波长: 214 nm; 毛细管柱: 50 μm×68.0 cm(有效长度59.4 cm); 柱温: 25 ℃。
3 结果与讨论
3.1 分离条件的优化
3.1.1 聚合物浓度的影响 当聚合物浓度增加,溶液电势增大,电渗流增大,利于化合物的分离。由图1可见,聚合物浓度在 0.5或1.0 g/L时,ABA, IBA和NAA未能基
线分离;当增至4.0 g/L时,虽能基线分离,但柱效下降、基线变粗,KT峰形变差。因此,聚合物浓度选择2.0 g/L。
3.1.2 缓冲液 pH 值对分离的影响 pH值可以影响聚合物中MAA、毛细管内壁硅羟基以及溶质羧基、羟基部分的解离,从而影响化合物的分离。考察了缓冲溶液pH值对植物激素分离的影响。由图2可见,pH 9.2时,分离效果最好。
3.1.3 缓冲液浓度对分离的影响 在其它实验条件不变的情况下,考察了Na3BO3浓度为30, 40, 50和60 mmol/L时对植物激素分endprint
离行为的影响。结果表明,缓冲液浓度过高时,各植物激素的分离度下降,出峰时间延长。综合考虑峰形、分离度和分析时间等因素,最终选择Na3BO3浓度为 50 mmol/L。
3.1.4 运行电压的影响 运行电压不仅影响分离度,而且影响出峰时间。考察了运行电压对5种植物激素分离的影响。由图3可见,随着电压的增大,毛细管电渗流也增大,分离时间减少,但是分离度下降。综合考虑峰形和分离度等因素,最终选择15 kV电压为最优电压。
在上述最优条件下,在两亲性聚合物胶束的作用下,5种植物激素得到理想分离(图3), 出峰顺序依次为:激动素、脱落酸、吲哚丁酸、萘乙酸、水杨酸。
3.2 方法的线性范围、检出限和重现性
在最优电泳条件下,对系列浓度递减的5种植物激素混合样进行测定,以电泳谱图的峰面积对各组分的浓度X(mg/L)进行回归分析,得出各组分的线性回归方程,结果见表1。从表1可知,5种植物激素的线性范围为1~100 mg/L,线性关系良好,相关系数R2>0.9919。检出限分别为0.90 mg/L (KT),
在上述最佳条件下,5种植物激素浓度都为64 mg/L 的标准试样连续进样5次,重现性良好。保留时间的相对标准偏差(RSD)小于0.9%,峰面积的RSD小于2.1%。
3.3 生根粉中 NAA 的分析
在上述最佳电泳条件下,按照2.4节方法,将处理过的生根粉溶液连续进样3次,其色谱图如图4所示,所检测的NAA不受干扰。将测得的峰面积代入回归方程计算出生根粉溶液中NAA的含量为70.3 mg/L,由此可得生根粉中NAA的含量为58.6%,在厂家提供的含量范围≥50%之内,说明本方法适用于生根粉中NAA的含量检测。
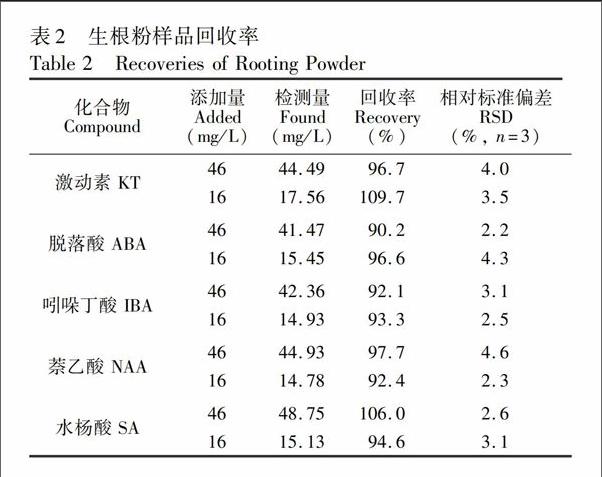
为进一步验证方法的可行性,对实际生根粉样品进行了加标回收实验,结果见表2。在生根粉样品中加入46和16 mg/L的KT, ABA, IBA, NAA,SA混合溶液, 5种植物激素的平均回收率范围为90.2%~109.7%,RSD<4.6%,说明本方法重现性良好。
4 结 论
本研究以疏水的甲基丙烯酸苄基酯和亲水的甲基丙烯酸制备了两亲性聚合物胶束,应用毛细管电泳-紫外检测法,建立了一种聚合物胶束电动色谱测定激动素、脱落酸、吲哚丁酸、萘乙酸和水杨酸的方法,5种植物激素在14 min内实现快速分离。本方法快速、灵敏、重现性好,成功用于实际样生根粉中萘乙酸的检测,因此有望将本方法用于食品中植物激素残留的痕量测定和产品质量分析等方面的研究。
References
1
Jonathan D B W, Neil W P. New Phytologist, 2001, 152(3): 375-407
2 Chanthana S, Mongkon R, Sugunya W, Sunanta W. Talanta , 2011, 85(2): 897-905
3 Chen M L, Huang Y Q, Liu J Q, Yuan B F, Feng Y Q. J. Chromatogr. B, 2011, 879(13-14): 938-944
4 Pan X, Welti R, Wang X. Phytochemistry, 2008, 69(8): 1773-1781
5 Li Y H, Wei F, Dong X Y, Peng J H, Liu S Y, Chen H. Phytochem. Anal., 2011, 22(5): 442-449
6 Renato B, Matteo C, Francesca V, Valentina S. J. Agric. Food. Chem., 2013, 61(46): 10940-10947
7 Lu Q M, Zhang L, Chen T W, Lu M H, Tong P, Chen G N. Rapid Commun. Mass Spectrom., 2008, 22(16): 2565-2572
8 Ge L, Peh C Y C, Yong J W, Tan S N, Hua L. J. Chromatogr. A, 2007, 1159(1-2): 242-249
9 Wang X C, Lin X C,Xie Z H, Giesy J P. J. Chromatogr. A, 2009, 1216(21): 4611-4617
10 Lu M H, Zhang L, Li X, Lu Q M, Chen G N,Cai Z W. Talanta, 2010, 81(4-5): 1655-1661
11 RAO Qin-Xiong, TONG Jing, GUO Ping, LI Hai-Yan, LI Xiao-Wei, DING Shuang-Yang. Chinese J. Anal. Chem., 2009, 37(9): 1341-1344
饶钦雄, 童 敬, 郭 平, 李海燕, 李晓薇, 丁双阳. 分析化学, 2009, 37(9): 1341-1344
12 WANG Yong-Zhong, FANG Xiao-Ling, LI Ya-Juan, ZHANG Zhi-Wen, HAN Li-Mei, SHA Xian-Yi. Acta Pharmaceutica Sinica, 2008, 43(6): 640-646endprint
王永中, 方晓玲, 李雅娟, 张志文, 韩丽妹, 沙先谊. 药学学报, 2008, 43(6): 640-646
13 WANG Pan, ZHAI Cui-Ping, YUAN Jin-Fang, GAO Qing-Yu. Acta Polymerica Sinica, 2011, 12: 1361-1367
王 磐, 翟翠萍, 袁金芳, 高青雨. 高分子学报, 2011, 12: 1361-1367
14 LI Bo-Xiang, ZHENG Min-Min, LU Lan-Xiang, WU Xiao-Ping. Chinese Journal of Chromatography, 2011, 29(8): 798-804
李博祥, 郑敏敏, 卢兰香, 吴晓苹. 色谱, 2011, 29(8): 798-804
15 WANG Ting-Ting, LIANG Zhen, ZHANG Li-Hua, ZHANG Yu-Kui. Chinese Journal of Chromatography, 2010, 28(3): 236-239
王婷婷, 梁 振, 张丽华, 张玉奎. 色谱, 2010, 28(3): 236-239
16 Wang B N, Ni X J, Yu M J, Cao Y H. J. Chromatogr. A, 2012, 1245(6): 190-198
Determination of Plant Hormones by Capillary
Electrophoresis Based on Polymer Micelles
CHEN Xia-Di*1, LU Qiao-Mei2, CHENG Jin-Tian2, ZHANG Lan2
1(Wuyi College/Key Laboratory of Green Chemical Industry Technology of Fujian Province, Wuyishan 354300, China)
2(College of Chemistry and Chemical Engineering, Fuzhou University, Fuzhou 350000, China)
Abstract With the increasing number of food safety problems caused by the abusing and misusing of plant hormones, it will be increasingly important to strengthen the trace detection of plant hormones in foods. In this study, benzyl methacrylate-methyl methacrylate-based amphiphilic polymer micelles were prepared, and a method for trace determination of five plant hormones was established by using these micelles. This method was rapid, sensitive and reproducible. Through optimization, the best experimental conditions were obtained as follows: 2 g/L polymer micelles, 50 mmol/L NaOH-H3BO3 buffer (pH 9.2), 15 kV running voltage. Based on this novel method, naphthalene acetic acid in the solution of rooting powder was determined.
Keywords Amphiphilic polymer micelles; Capillary electrophoresis; Plant hormones; Rooting powder
(Received 10 May 2014; accepted 19 September 2014)
This work was supported by the National Natural Science Foundation of China (No. 21075016)endprint
