低氮胁迫下丛枝菌根真菌对垂穗披碱草的抗氧化系统调控机制
2015-01-20李海英孙永芳许岳飞杨云贵
李海英,孙永芳,许岳飞*,杨云贵*
(1.陕西省畜牧技术推广总站,陕西西安710016;2.西北农林科技大学动物科技学院草业科学系,陕西杨凌712100)
垂穗披碱草(Elymusnutans)作为青藏高原常见的多年生禾本科牧草,具有耐寒、耐旱、品质好和产草量高等特点[1-2],成为青藏高原退化草地改良常用补播草种[3]。由于青藏高原海拔高,气温低等因素限制了有机氮的矿化,导致土壤氨基酸浓度常超过矿质氮(NH4+、NO3-)浓度,许多植物能够在不经矿化的情况下直接吸收、利用环境介质中的有机氮,尤其是氨基酸类[4]。氨基酸可能代表着该区域植物的一个主要氮源。
在自然界中大多数植物主要吸收无机氮,植株体内活性氧自由基的产生和消除通常呈动态平衡状态。但当有机氮作为植物的唯一氮源时,这种动态平衡就会遭到一定程度的损坏,最终引起内含物泄露和植物细胞脱水。丙二醛(MDA)作为植物膜脂过氧化的重要产物之,与细胞上的蛋白质和酶等交联并使其失活,从而导致生物膜的结构与功能遭到破坏,应此,MDA 被认为是判断膜脂过氧化的一个重要指标[5]。为了减轻受到逆境胁迫的伤害,植物主要是通过超氧歧化酶 (SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等抗氧化酶及时转移、清除掉自由基及氧化中间产物[6]。植物和真菌的抗氧化剂可以保护细胞免受活性氧的侵害。
丛枝菌根(Arbuscular mycorrhizal,AM)是一种广泛分布在微生物与高等植物之间的联合共生体,能够扩大根系吸收范围,促进植物对养分和水分的吸收、增加植物群落多样性和提高植物抗逆性[7]。AM 真菌可以促进宿主植物对氮素的吸收,菌丝吸收氮素的形态包括NH4+、NO3-和一些氨基酸[8]。
在自然土壤溶液中发现了多种氨基酸,一般以天冬氨酸、谷氨酸、甘氨酸占优势[9]。因此,本试验选用这三种氨基酸作为有机氮源,并将无机氮NH4+和NO3-作为对照,研究两种垂穗披碱草对这些氮源的吸收状况。在此基础上,通过对2种垂穗披碱草植株根部接种摩西球囊霉(Glomus mosseae)来比较2种垂穗披碱草在低氮胁迫下抗氧化方面的特征,从而为优质高产垂穗披碱草新品种选育及野生种质资源的开发利用提供基础。
1 材料与方法
1.1 试验材料
试验用北京垂穗披碱草(BJ)种子购自北京正道生态科技有限公司,申扎垂穗披碱草(SZ)种子取自西藏自治区申扎县(N 31°06.187′,E 91°41.960′,海拔4 763 m)。供试丛枝菌根真菌为摩西球囊霉(Glomusmosseae)(Nicolson & Gerdemann)Gerdemann &Trappe(菌种编号:BGC XZ02A,国家微生物资源平台编号:1511C0001BGCAM 0014),由中国丛枝菌根真菌种质资源库(BGC)提供。石英砂用水冲洗数次后,于烘箱中160 ℃高温灭菌2h,自然冷却后继续在160 ℃烘2h,放凉备用。
1.2 试验方法
试验分为两个阶段进行:第一阶段,试验选用两种无机态氮(NH4+-N、NO3--N)和三种有机态氮(Asp-N、Glu-N、Gly-N)作为不同的氮源,其它无氮营养元素在Thornton 和Bausenwein[10]配方的基础上再添加0.05 μmol/L 的Na2MoO4,用0.1 mmol/L的KOH 和HCl调节pH 至5.6左右。挑选饱满一致的垂穗披碱草种子,用1%的次氯酸钠溶液浸泡10 min,自来水冲洗数次后,再用无菌蒸馏水冲洗两次,将洗好的种子种植在盛有石英砂的育苗盘内,置于人工气候培养箱内进行发芽。待出苗基本完毕后,选取生长一致的壮苗定苗,并开始浇营养液,每3d浇一次,一个月后收获全株,测定植株生物量。
第二阶段,根据第一阶段的试验结果,本阶段以谷氨酸作为氮源,其它无氮营养元素的配方同试验的第一阶段,设不接种真菌(NF)、接种灭活真菌(IF)和激活真菌(AF)三个处理。将饱满一致种子SZ和BJ在1%的次氯酸钠溶液浸泡10min后用蒸馏水冲洗干净,置于盛有滤纸的培养皿中,并将其放在人工气候培养箱中进行发芽。在转苗前,首先进行接种处理,每千克石英砂中接入15g菌种(大约225个孢子)或高温灭活的菌种,未接种处理者均加等量石英砂。将长势一致的强壮幼苗转入盛有上述石英砂的穴盘内,置于人工模拟气候室内进行培养。每三天浇一次营养液,三个月后进行抗氧化相关指标的测定。
1.3 测定项目
1.3.1 垂穗披碱草地上生物量的测定 取每株植物的地上部分,105 ℃杀青30min,70 ℃烘干至恒重测定其生物量。
1.3.2 叶片电解质渗出率的测定和丙二醛(MDA)含量的测定 将叶片剪成小段,放入洗净试管中,加入去离子水,抽气并静置几分钟后用电导仪测定叶片的电导值C1。再将试管放入沸腾的水浴锅中加热5min,冷却后测量其电导值C2[11]。计算公式如下:电解质渗出率(%)=C1/C2×100%。
1.3.3 叶片丙二醛(MDA)含量的测定 称取0.1 g垂穗披碱草叶片,加入1 mL 的5%三氯乙酸,混匀后加入5mL 的0.5%硫代巴比妥酸,将其置于沸水浴15min后,冷却离心,取其上清液并分别在450nm、532nm 和600nm 的波长下进行比色[11]。计算公式如下:
MDA 含量(nmol·g-1FW)=[6.452(A532-A600)-0.559A450]×Vt/(Vs×FW)
式中:Vt为提取液的总体积;Vs为测定提取液体积;FW 为叶片鲜重(g)。
1.3.4 叶片超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性的测定 酶液提取:取1g左右的叶片,加入9mL的50mmol/L磷酸缓冲液(含有1%聚乙烯吡咯烷酮),再将其在4℃浸提40min,然后在4℃下15 000r/min离心15 min,上清液即为粗酶提取液[12]。SOD 活性采用氮蓝四唑(NBT)法[13]测定,POD 活性采用愈创木酚法[14]进行测定,CAT 活性采用过氧化氢分解法[15]进行测定。
1.4 数据处理
运用Microsoft Excel 2007和SPSS 17.0 软件对试验数据进行统计分析,采用单因素方差分析(One-way ANOVA)和Duncan法比较不同数据组间的差异,图中误差线上不同的小写字母表示不同处理在P<0.05时有显著差异,并利用Sigmaplot 12.0软件作图。
2 结果与分析
2.1 有机氮源的选择
在五种不同氮源条件下,BJ和SZ 的地上生物量如图1所示,两种垂穗披碱草在无机态氮(NH4+-N、NO3
--N)供应条件下的地上生物量明显高于有机态氮(Asp-N、Glu-N、Gly-N),且对两种无机态氮之间的吸收无显著性差异(P>0.05)。SZ对Glu-N的吸收能力明显高于其它两种有机态氮(P<0.05),而BJ对Glu-N 的吸收能力最弱。因此,在后续的试验中选用Glu-N 作为有机氮源来探讨垂穗披碱草对有机态氮的吸收机理。

图1 不同氮源供应下BJ和SZ的地上生物量Fig.1 Above-ground biomass of BJ and SZ with different nitrogen source
2.2 丛枝菌根真菌对垂穗披碱草膜透性及膜脂过氧化的影响
如图2,当有机氮作为氮源时,接种激活的丛枝菌根真菌能降低两种垂穗披碱草的电解质渗出率和丙二醛(MDA)含量。与不接种丛枝菌根真菌或接种未激活的丛枝菌根真菌相比,接种激活丛枝菌根真菌对BJ电解质渗出率的影响不明显(P>0.05),而接种激活丛枝菌根真菌显著降低了SZ电解质渗出率(P<0.05)。在相同处理条件下,BJ电解质渗出率高于SZ电解质渗出率。各处理之间SZ的MDA含量差异不显著(P>0.05),而接种激活丛枝菌根真菌BJ的MDA含量显著低于其它处理组(P<0.05)。
2.3 枝菌根真菌对垂穗披碱草抗氧化酶活性的影响
试验结果如图3所示,接种激活丛枝菌根真菌均降低了两种垂穗披碱草的SOD、CAT 和POD 活性。与未接种丛枝菌根真菌相比,接种丛枝菌根真菌能够显著降低BJ和SZ的SOD 活性(P<0.05)。与未接种丛枝菌根真菌相比,尽管接种丛枝菌根真菌对BJ和SZ 的CAT 活性没有显著性影响(P>0.05),但分别降低了18.7%和28.3%。与未接种丛枝菌根真菌相比,接种丛枝菌根真菌能够显著减低BJ和SZ的POD 活性(P<0.05),而未接种丛枝菌根真菌相和接种未激活的丛枝菌根真菌植株的PODT 活性之间差异不明显(P>0.05)。在相同处理条件下,BJ的SOD、CAT 和POD 活性均高于SZ的SOD、CAT 和POD 活性。
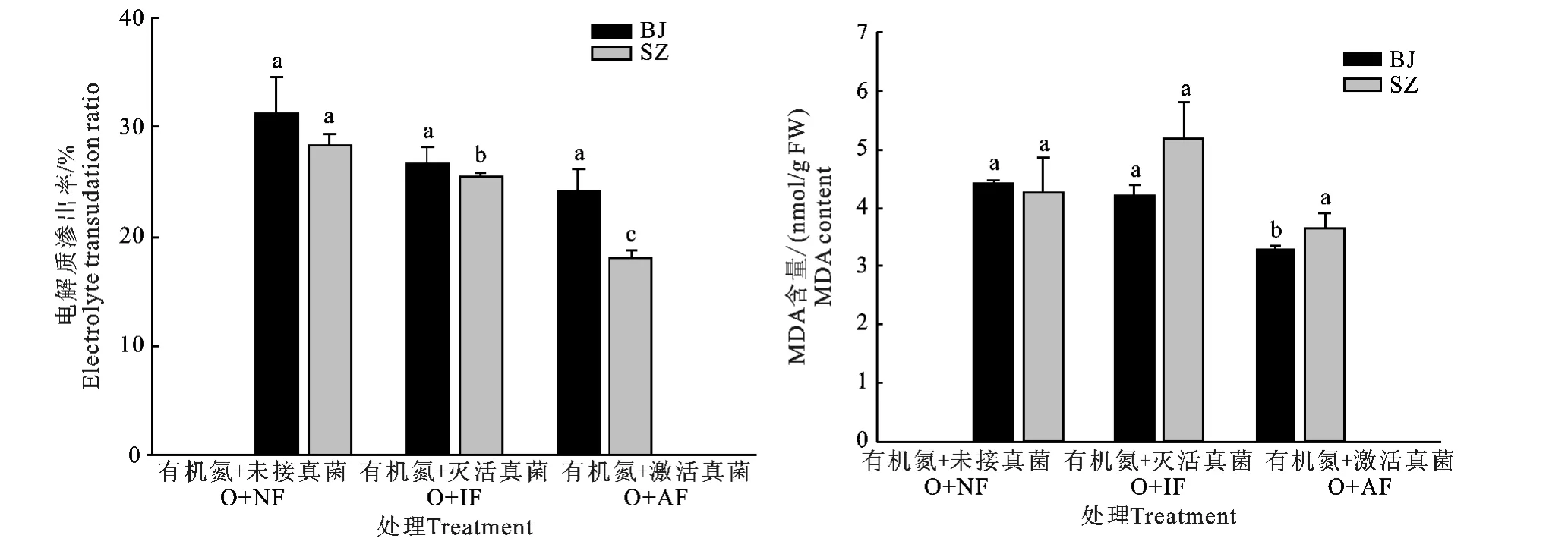
图2 不同处理对BJ和SZ电解质渗出率和MDA 含量的影响Fig.2 Effect of different treatments on electrolyte transudation ratio and MDA contents of BJ and SZ
3 讨论
草地是畜牧的基础,也是是牧区经济发展的重要自然资源,其合理利用能够带来良好的社会效益、经济效益和生态效益[16]。牧草生物量是草地生态系统获取能量的主要体现,对生态系统结构的形成具有十分重要的影响[17],其高低可判断草地状况、演替趋势、生产潜力和载畜能力[18-19]。在本试验中,两种垂穗披碱草的地上生物量在有机氮作为氮源时明显比无机氮低,可能是由于N 源为单一氨基酸时抑制了植物的生长[20],其中以Glu 处理对SZ 的降低幅度最低,这与葛体达等[21]的研究结果一致。当Glu-N 作为氮源时,SZ的地上生物量远高于BJ,可能是申扎长期生活在富含有机质的草原生态系统中[22],已经较好地形成了一套吸收有机氮的机制。
不良环境会诱导植物膜脂过氧化,膜脂过氧化的产物积累,细胞膜透性增加,细胞内含物发生外泄,导致细胞电解质渗出率增加[23]。MDA高低是膜脂过氧化作用的一个重要指标,其含量高低直接反映了植物受害的状况[24]。当单一氨基酸作为植物的氮源时,抑制了植物的生长[20],在缺少氮源的逆境胁迫下,两种垂穗披碱草的电解质渗出率和MDA 含量升高,接种激活的丛枝菌根真菌后,这种伤害有所下降,表明丛枝菌根真菌能够改善植株的电解质渗出率和减低叶片MDA 含量[25]。
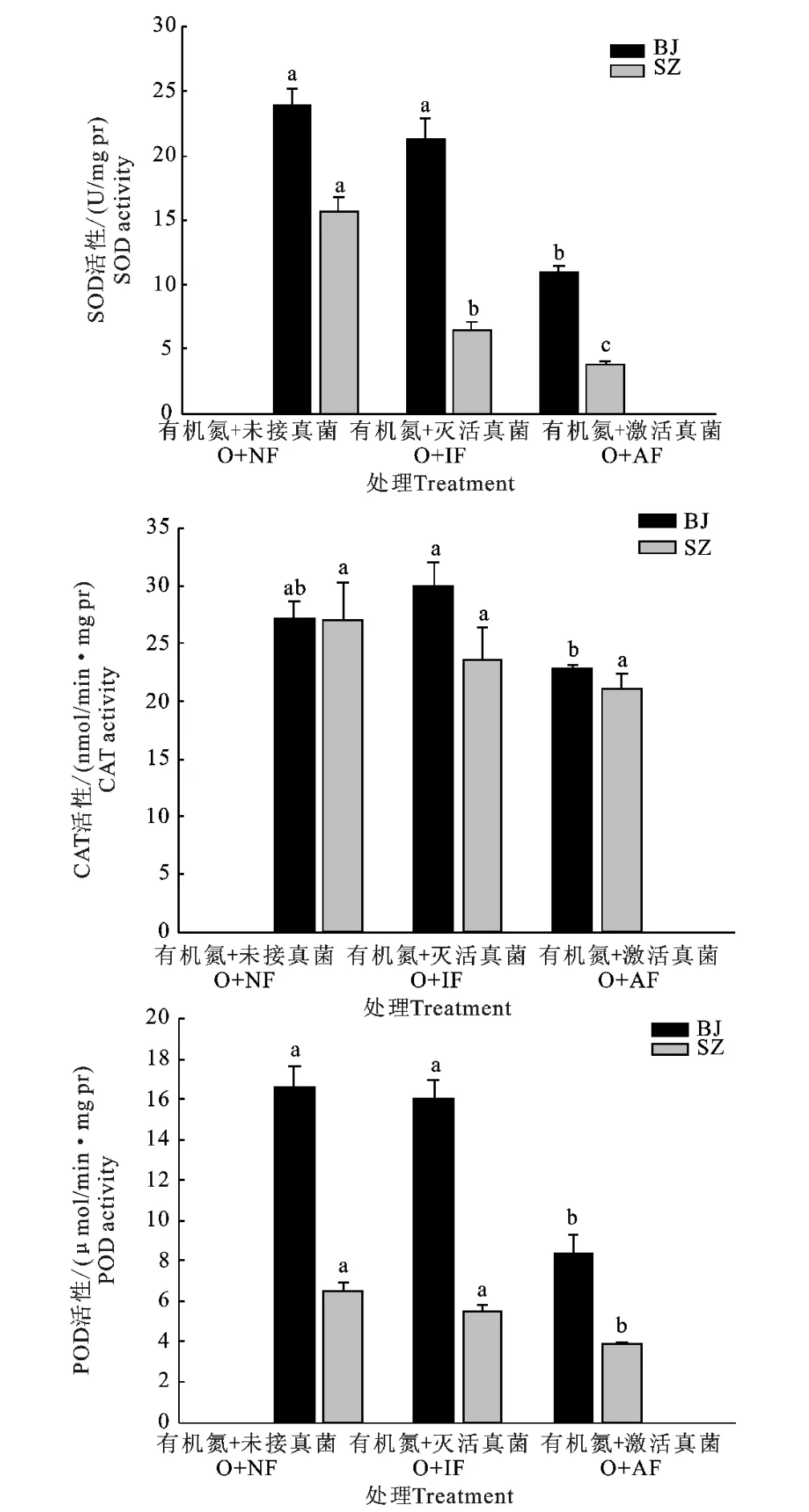
图3 不同处理对BJ和SZ SOD、CAT 和POD 活性的影响Fig.3 Effect of different treatments on activity of SOD,CAT and POD of BJ and SZ
SOD 是植株抗氧化系统的第一道防线,是一种广泛存在于动物、植物和微生物中的金属酶,能清除植物细胞中过量的超氧根阴离子,是防御超氧阴离子自由基对细胞损害的抗氧化酶[26]。POD 在活性氧的清除和抑制膜脂过氧化等植物抗逆性生理方面起重要作用。CAT 是植物在逆境条件下酶促防御系统的关键酶类之一,可以作为植物抵抗不良环境胁迫的一个指标[27]。在有机氮作为氮源条件下,两种垂穗披碱草的SOD、CAT 和POD 活性均比较高,给植株接种激活的丛枝菌根真菌后,这三种酶的活性均降低。这与贺忠群等[28]得出接种丛枝菌根真菌增加了番茄中SOD、CAT 和POD 的活性的结论相矛盾。可能是由于本试验是在接种丛枝菌根真菌三个月后才测定的抗氧化酶活性,丛枝菌根真菌与寄主植物已经形成了良好的共生关系,缓解了植物对单一氨基酸作为氮源时逆境胁迫的伤害。同时,这也与李岳峰[24]的研究结果相吻合,他通过将丛枝菌根真菌接种到绿豆中,测定了不同时间段植物体内的SOD、CAT 和POD 的活性,这三种酶的活性在菌种侵染45d后远大于菌种侵染60d。因此,丛枝菌根真菌对植物具有累加效应,即菌种侵染宿主后,可以长期对其发挥作用。
4 结论
两种垂穗披碱草的地上生物量在有机氮作为氮源时明显比无机氮低,且SZ 对Glu-N 的吸收能力高于其它两种有机态氮。当有机氮作为氮源时,接种激活的丛枝菌根真菌能降低两种垂穗披碱草的电解质渗出率和MDA 含量,降低了两种垂穗披碱草的SOD、CAT 和POD 活性。不接种丛枝菌根真菌与接种灭活的丛枝菌根真菌对垂穗披碱草的影响不大。说明接种丛植菌根能间接减少植物在有机氮条件下的伤害,从而促进植物对有机氮的吸收。
[1]Gu Meng-he,Dong Shi-kui,Wang Tao,et al.Interspecific interactions under fertilization among Elymus nutans,Festuca sinensis and Festuca ovina on the eastern Qinghai-Tibetan plateau[J].Plant Species Biology,2012,27(2):159-163.
[2]陆光平,聂 斌.垂穗披碱草利用价值评价[J].草业科学,2002,19(12):13-15.
[3]张永超,牛得草,韩 潼,等.补播对高寒草甸生产力和植物多样性的影响[J].草业学报,2012,21(2):305-309.
[4]崔晓阳.植物对有机氮源的利用及其在自然生态系统中的意义[J].生态学报,2007,27(8):3 500-3 512.
[5]Banry H,Susanna C.Lipid peroxidation:its mechanism,measurement and significance[J].Ameriean Journal of Clinical Nutrition,1993,57(5):715-724.
[6]Seandalios J G.Oxygen stress and superoxide dismutases[J].Plant Physiology,1993,101(1):7-12.
[7]Rousseau J V D,Sylvia D M,Fox A J.Contribution of ecto-mycorrhiza to the potential nutrient-absorbing surface of pine[J].New Phytologist,1994,128(4):639-644.
[8]Frey B,Hannes S.Acquisition of nitrogen by external hyphae of arbuscular mycorrhizal fungi associated with zea mays L[J].New Phytologist,1993,124(2):221-230.
[9]Raab T K,Lipson D A,Monson R K.Soil amino acid utilization among species of the cyperaceae:plant and soil processes[J].Ecology,1999,80(7):2 408-2 419.
[10]Thornton B,Bausenwein U.Seasonal protease activity in storage tissue of the deciduous grass Molinia caerulea[J].New Phytologist,2000,146(1):75-81.
[11]张志良.植物生理学实验指导[M].第3版.北京:高等教育出版社,1990.
[12]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1):248-254.
[13]Beauchamp C,Fridovich I.Superoxide dismutase:improved assays and an assay applicable to acrylamide gels[J].Analytical Biochemistry,1971,44(1):276-287.
[14]Hammerschmidt R,Nuckles E M,Kuc J.Association of enhanced peroxidase activity with induced systemic resistance of cucumber to Colletotrichum lagenarium[J].Physiological Plant Pathology,1982,20(1):73-82.
[15]Aebi H.Catalase in vitro[J].Methods Enzymol,1984,105:121-126.
[16]夏祖国,李祖祥,苏小冬,等.发展经济型草业推动产业结构调整[J].草业科学,2003,20(9):41-43.
[17]宇万太,于永强.植物地下生物量研究进展[J].应用生态学报,2001,12(6):927-932.
[18]安 渊,李 博,扬 持,等.内蒙古大针茅草原草地生产力及其可持续利用研究Ⅰ、放牧系统植物地上现存量动态研究[J].草业学报,2001,10(2):22-27.
[19]史惠兰,王启基,景增春,等.江河源区人工草地群落特征、多样性及其稳定性分析[J].草业学报,2005,14(3):23-30.
[20]吴良欢,陶勤南.水稻氨基酸态氮营养效应及其机理研究[J].土壤学报,2000,37(4):464-473.
[21]葛体达,黄丹枫,芦 波,等.无机氮和有机氮对水培番茄幼苗碳水化合物积累及氮素吸收的影响[J].应用与环境生物学报,2008,14(5):604-609.
[22]Woodmansee R G,Dodd J L,Bowman R A,et al.Nitrogen budget of a shortgrass prairie ecosystem[J].Oecologia,1978,34(3):363-376.
[23]张呈祥,陈为峰.美人蕉对镉的胁迫反应及积累特性[J].植物生态学报,2012(07):690-696.
[24]李岳峰.丛枝菌根改善旱作水稻/绿豆间作系统中作物生长和氮磷利用的研究[D].南京:南京农业大学,2008.
[25]付淑清,屈庆秋,唐 明,等.施氮和接种AM 真菌对刺槐生长及营养代谢的影响[J].林业科学,2011,47(1):95-100.
[26]马旭俊,朱大海.植物超氧化物歧化酶(SOD)的研究进展[J].遗传,2003,25(2):225-231.
[27]梁艳荣,胡晓红,张颍力,等.植物过氧化物酶生理功能研究进展[J].内蒙古农业大学学报:自然科学版,2003,24(2):110-113.
[28]贺忠群,贺超兴,张志斌.盐胁迫下丛枝菌根真菌对番茄氧自由基清除系统的影响[J].园艺学报,2010,37(S):2 146-2 146.
