湛江高桥红树林湿地底栖动物粒径谱
2015-01-20饶义勇蔡立哲黄聪丽颜露露傅素晶陈昕韡
饶义勇,蔡立哲,2,*,黄聪丽,李 想, 卓 异, 郭 涛,颜露露,傅素晶,陈昕韡
1 厦门大学环境与生态学院,厦门 361102 2 厦门大学滨海湿地生态系统教育部重点实验室,厦门 361102
湛江高桥红树林湿地底栖动物粒径谱
饶义勇1,蔡立哲1,2,*,黄聪丽1,李 想1, 卓 异1, 郭 涛1,颜露露1,傅素晶1,陈昕韡1
1 厦门大学环境与生态学院,厦门 361102 2 厦门大学滨海湿地生态系统教育部重点实验室,厦门 361102
在我国,红树林湿地底栖动物粒径谱研究很少。根据2010 年1月、4月、7月、10月在湛江高桥红树林湿地获得的大型和小型底栖动物数据,构建了底栖动物生物量粒径谱,以期为湛江高桥红树林湿地的生态保护和持续利用提供科学依据。主要研究结果如下: (1)高桥红树林湿地生物量粒径谱基本为3峰模式。第一峰在-2粒级,主要由线虫构成;第二峰在4—12粒级,主要由寡毛类、多毛类和小个体甲壳类构成;第三峰在13—22粒级,主要由大个体腹足类、双壳类和甲壳类构成。(2)木榄、桐花树和无瓣海桑生境在0—4粒级之间出现一个明显的波谷,这个波谷介于线虫和寡毛类之间,是大型与小型底栖动物粒级交汇区。(3)高桥红树林湿地底栖动物正态化生物量粒径谱的斜率大于-1,截距为16.533—18.150。桐花树(Aegicerascorniculatum)和无瓣海桑(Sonneratiaapetala)生境的截距、最小粒级的生物量(BMS)高于木榄(Bruguieragymnorrhiza)和盐地鼠尾粟(Sporobolusvirginicus)生境,说明桐花树和无瓣海桑生境的底栖动物生产力水平较木榄和盐地鼠尾粟生境的高;秋季的截距、BMS较其他季节高,说明秋季的底栖动物生产力水平较其他季节高。
底栖动物;粒径谱;红树林湿地;湛江
粒径谱理论的引入为底栖生态学研究提供了新的方法。与经典的依靠分类阶元进行底栖动物群落特征的描述相比,粒径谱方法可以不依赖分类学知识,避免因分类鉴定不准确而引起的计算误差、更易于操作[1]。随着人们对于海洋生态系统结构和功能认识的加深以及对生态系统准确检测的需要,粒径谱理论的应用领域将更加广泛。
我国对于生物量粒径谱的研究尚处于起步阶段,最早研究的是浮游生物,之后结合东海和黄海生态系统动力学开展了底栖生物粒径谱的研究[2]。华尔等[3]构建了东中国海浅水海域(包括了东海、黄海和渤海)站位底栖动物粒径谱,结果表明:研究海域的底栖动物生物量粒径谱呈现双峰模式,分别是小型底栖动物和大型底栖动物;沉积物中的叶绿素a以及中值粒径对生物量粒径谱有着重要的影响。邓可等[4]和王睿照等[5]利用南黄海典型站位的底栖动物粒径谱计算了底栖动物群落的平均次级生产力和耗氧量。张青田等[6]通过构建底栖动物正态化生物量粒径谱的方式比较了渤海湾、东海、黄海和黄河口的生产量。上述的研究均是基于潮下带底栖动物进行的,关于潮间带底栖动物粒径谱的研究,仅查阅到厦门大学的3篇硕士论文研究了潮间带红树林湿地的底栖动物粒径谱[7- 9]。本研究根据2010 年1月、4月、7月、10月在湛江高桥红树林湿地4种植物生境获得的大型和小型底栖动物数据,构建了湛江高桥红树林湿地底栖动物生物量粒径谱,以期开创我国红树林湿地底栖动物粒径谱研究,为红树林湿地的生态保护和持续利用提供科学依据。
1 材料与方法
1.1 研究区域
广东湛江红树林自然保护区位于广东省湛江市境内,面积 2.03 万hm2,是我国现存红树林面积最大的一个自然保护区,1997年晋升为国家级自然保护区。该保护区地处我国大陆最南端的雷州半岛东、南、西面海岸滩涂带,是北部湾红树林生态系统的重要部分,其中有林面积 12375 hm2,宜林滩涂 7625 hm2, 是中国最有代表性的红树林生态类型。受热带海洋气候的影响,沿海滩涂上分布着较大面积的红树林植被,其中红树植物有 12 科、16 属、17 种,是除海南岛外我国红树植物种类最多的地区。湛江红树林保护区作为我国现存红树林面积最大的一个自然保护区,是广东西南部海岸天然红树林沼泽湿地类型的最好范例,在抗御台风暴潮、减缓潮水流速、保持水土、控制堤岸侵蚀、吸收转化污染物、净化海水等方面发挥着极其重要的生态功能作用。
1.2 采样时间和站位设置
于2010年1月(冬季)、4月(春季)、7月(夏季)、10月(秋季),在广东湛江高桥红树林区进行4个季度底栖动物生态调查。共布设木榄、桐花树、无瓣海桑和盐地鼠尾粟4种植物生境(图1)[20],前3种为红树植物,后1种为禾本科植物。
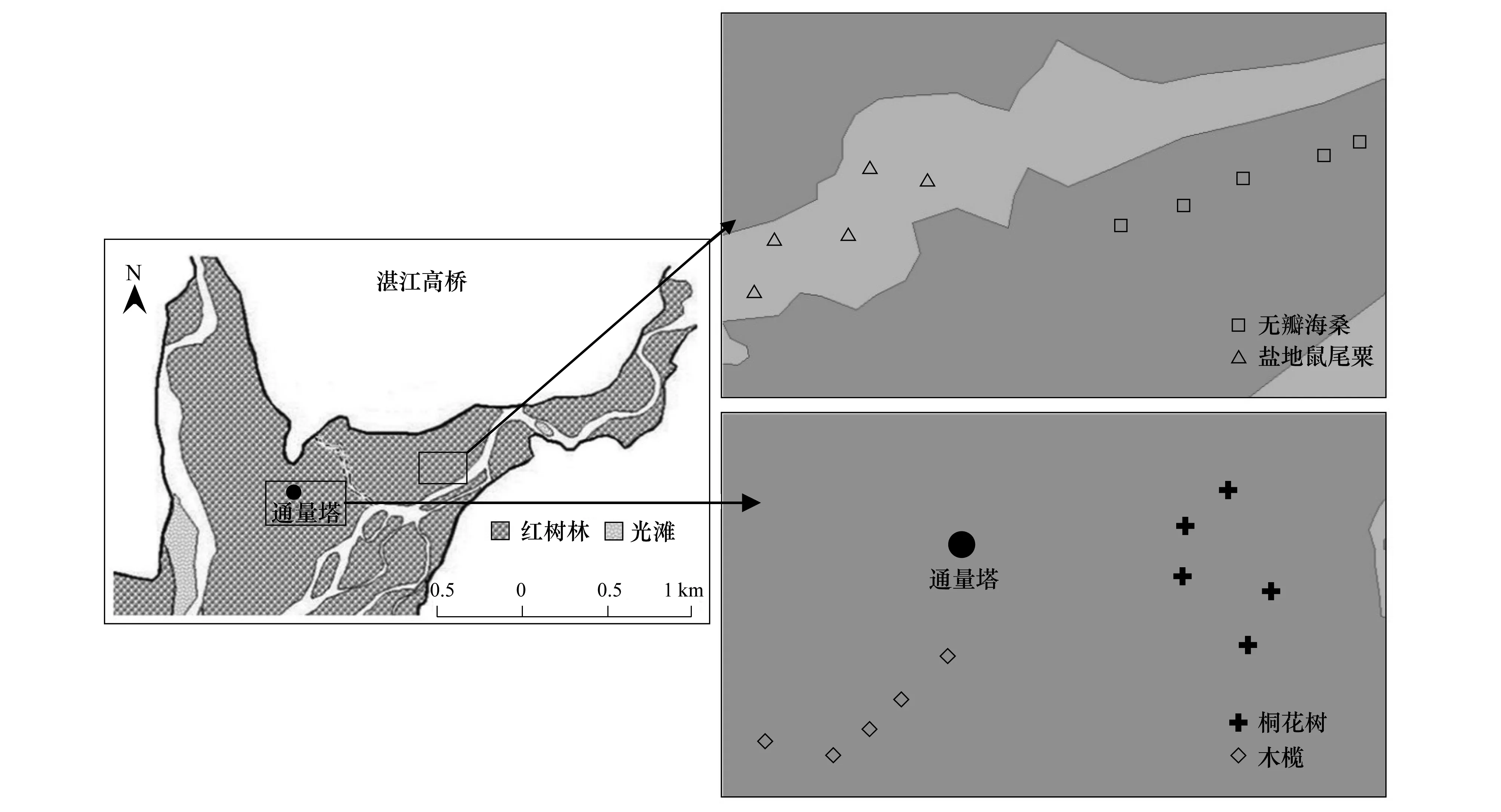
图1 高桥红树林湿地底栖动物取样站示意图[20]Fig.1 Sampling stations of benthic fauna in Gaoqiao mangrove wetlands [20]
1.3 取样及样品处理
1.3.1 小型底栖动物
采用由注射器改造的内径为2.9 cm的采样管取样,取样深度为9 cm。并用5%的中性海水甲醛溶液固定,带回实验室进一步处理。用内径为0.5 mm和0.042 mm孔径的网筛筛选,LudoxTM溶液离心3次,取上清液置于解剖镜下分选,制作永久封片。小型底栖动物在显微镜下测量每个生物体的体长(L,mm) 和最大体宽(W, mm), 并由公式V=C×L×W2, 计算出各个类群个体的体积(V, nL)。式中, 系数C 依类群而不同[10]。体积(nL) 到湿重生物量(μg)的换算系数为1.13, 湿重生物量到干重乘以系数0.25[11]。
1.3.2大型底栖动物
采用25 cm×25 cm样框、挖深30 cm,经0.5 mm孔径网筛分选后,用5%的中性海水甲醛溶液固定后带回实验室。用琥红染色后,在解剖镜下挑选并分类计数。动物标本经吸水纸吸去体表水分后, 用感量为0.1 mg的电子分析天平称重(湿重),再按湿重∶干重=5∶1换算为干重[2]。
1.3.3 底栖动物粒径谱绘制
本文构建了两种类型的生物粒径谱,生物量粒径谱和正态化生物量粒径谱,采用excel进行作图及数据统计。生物量粒径谱(BSS)以log2转换的个体干重生物量(μg 干重/ind)为横坐标划分粒级,以log2转换的单位面积(m2)上对应粒级的干重生物量(μg 干重/m2)为纵坐标,绘制生物量粒径谱。正态化生物量粒径谱(NBSS)以log2转换的个体干重生物量(μg 干重/ind)划分粒级,作为横坐标;每个粒级上单位面积(m2) 总的干重生物量(μg 干重/m2)除以该粒级上个体干重的变化幅度(μg),也经log2转化后,作为纵坐标[12]。对这些点作回归直线,得到正态化粒径谱,同时得到斜率a和截距b。在绘制正态化粒径谱的过程中,包含-2至14共17个粒级,不包括粒级大于14的稀有种。
2 结果
2.1 湛江高桥4种植物生境的底栖动物生物量粒径谱
根据湛江高桥4种植物生境的底栖动物数据构建了生物量粒径谱图形,发现谱型均呈现不规则的锯齿状(图2)。4种植物生境在-2粒级上都拥有较高的生物量,主要由海洋线虫构成。木榄、桐花树和无瓣海桑生境在0—4粒级之间出现一个明显的波谷,这是由于在线虫和寡毛类之间只有少量的小型底栖动物动吻类和海蟎类。盐地鼠尾粟生境在0—4粒级之间没有出现波谷,而在4粒级出现波谷,这是由于盐地鼠尾粟生境的寡毛类动物栖息密度很低。桐花树生境的粒级可以达到22,是由于在该生境采集到个体很大的红树蚬(Geloinacoaxans)。
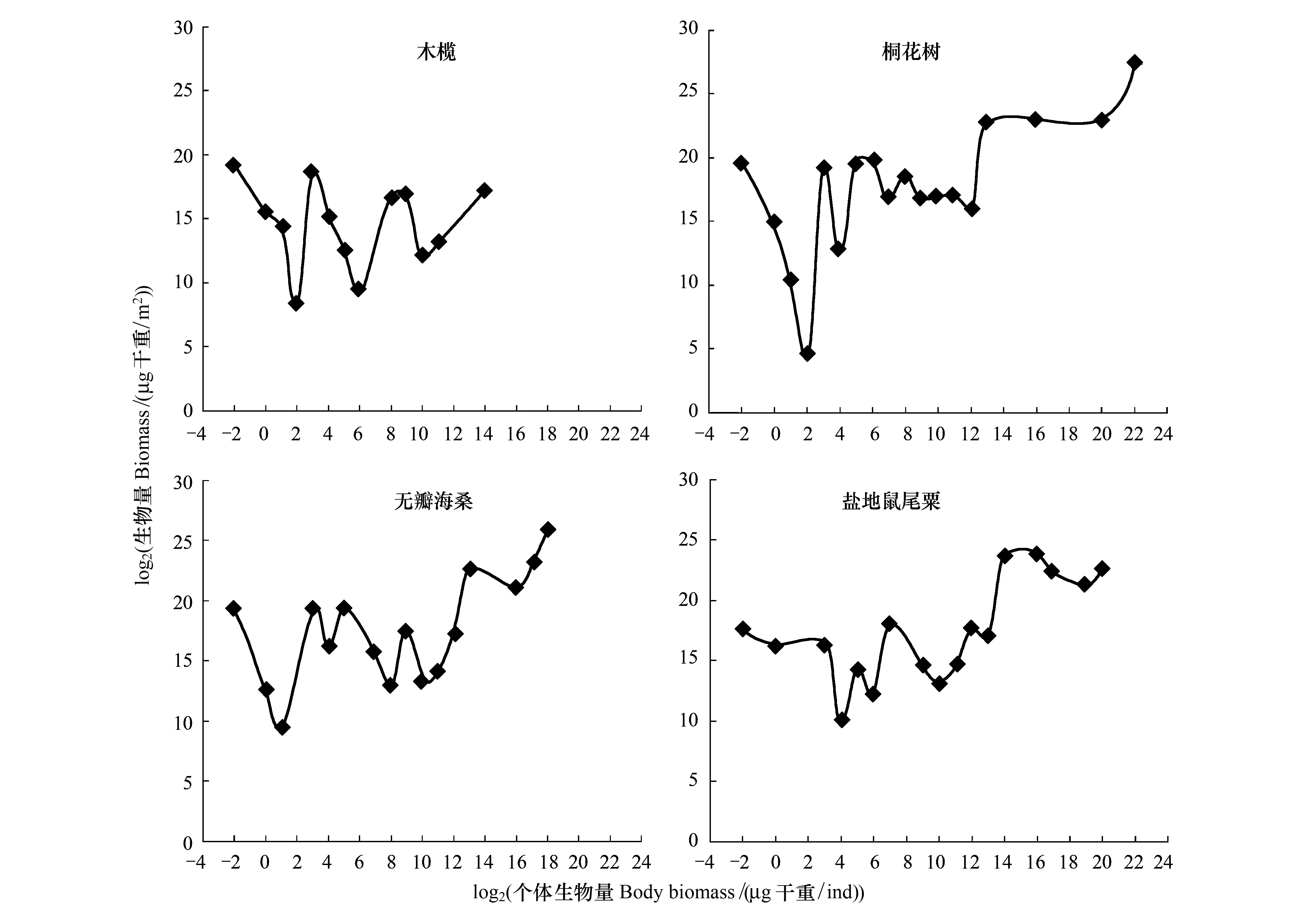
图2 高桥红树林湿地不同生境底栖动物生物量粒径谱Fig.2 Biomass size spectra of benthic fauna in different biotopes in Gaoqiao mangrove wetlands
2.2 湛江高桥不同季节的底栖动物生物量粒径谱
各季节的底栖动物生物量粒径谱图形基本相似(图3),即出现3个峰,第一峰在-2粒级,主要由线虫构成;第二峰在4—12粒级,主要由寡毛类、多毛类和小个体甲壳类构成;第三峰在13—22粒级,主要由大个体腹足类、双壳类和甲壳类构成。此外,在-2—4粒级之间出现一个明显的波谷,与红树林(木榄、桐花树和无瓣海桑)生境的底栖动物粒径谱图形相似。
2.3 湛江高桥不同植物生境的底栖动物正态化粒径谱

图3 湛江高桥红树林湿地4个季节的底栖动物生物量粒径谱Fig.3 Biomass size spectra of benthic fauna in four seasons in Gaoqiao mangrove wetlands
分别对4种植物生境的底栖动物构建了正态化生物量粒径谱图形及回归直线(图4),所有回归结果具有显著意义(P<0.05)。4种植物生境的正态化生物量粒径谱的斜率都大于-1(表1),即随着生物个体的增大,粒级上的生物量也随之增大。4种植物生境的正态化生物量粒径谱,斜率范围在-0.9696—-0.8388,斜率最大的是盐地鼠尾粟生境,最小的是木榄生境;截距范围在16.963—18.078,截距最大的是无瓣海桑生境,最小的是木榄。
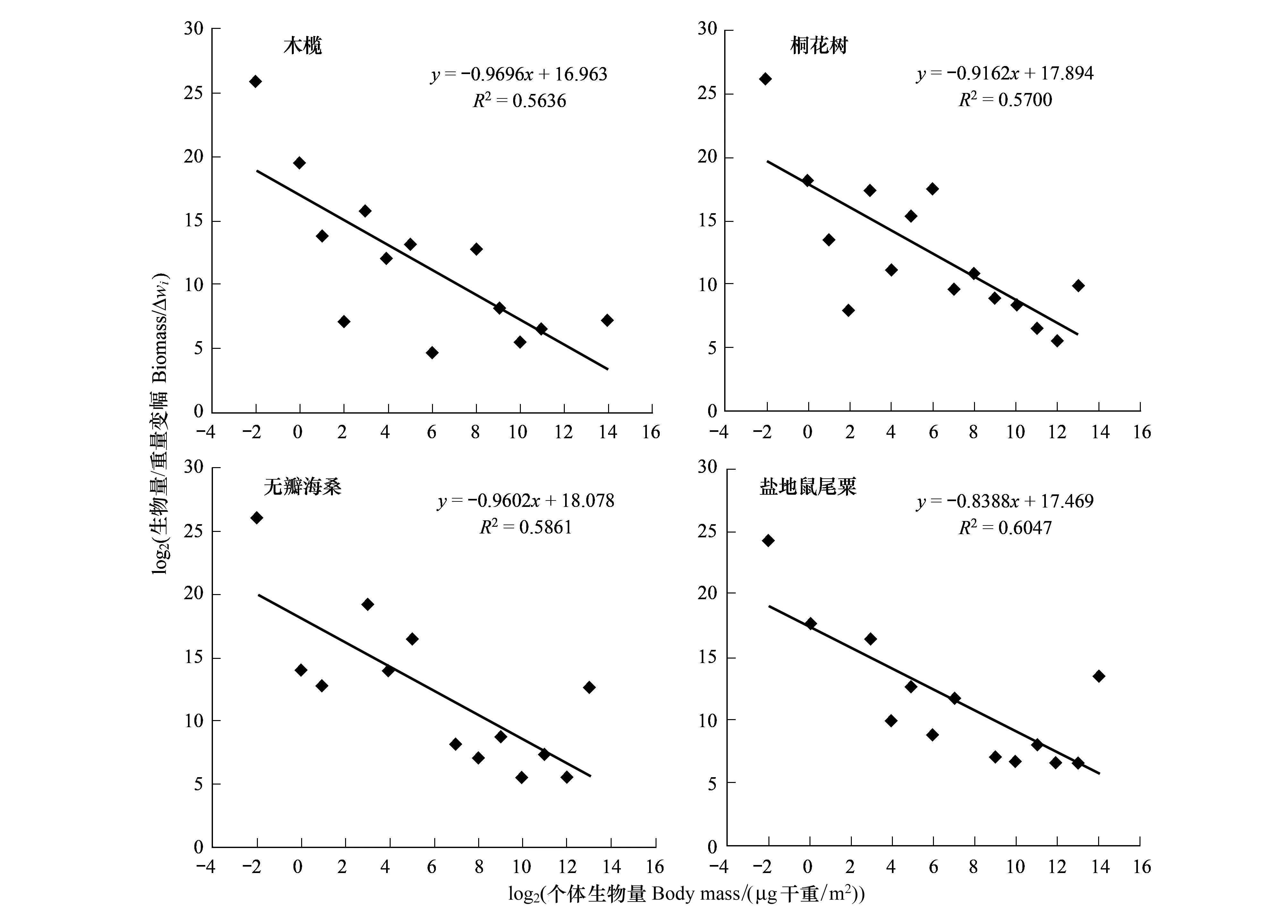
图4 高桥红树林湿地不同生境底栖动物生物量粒径谱Fig.4 Normalized biomass spectra of benthos in different biotopes in Gaoqiao mangrove wetlands
2.4 湛江高桥不同季节的底栖动物正态化粒径谱
分别对4个季节的底栖动物构建了正态化生物量粒径谱图形及回归直线,所有回归结果具有显著意义(P<0.05)。构建的正态化生物量粒径谱的斜率都大于-1。4个季节的正态化生物量粒径谱斜率范围在-0.9152—-0.7625,斜率最大的是冬季,最小的是春季;截距范围在16.533—18.150,截距最大的是秋季,最小的则为春季。位于个体生物量最小对数粒级的为线虫,其生物量明显影响着粒径谱的斜率(图5)。
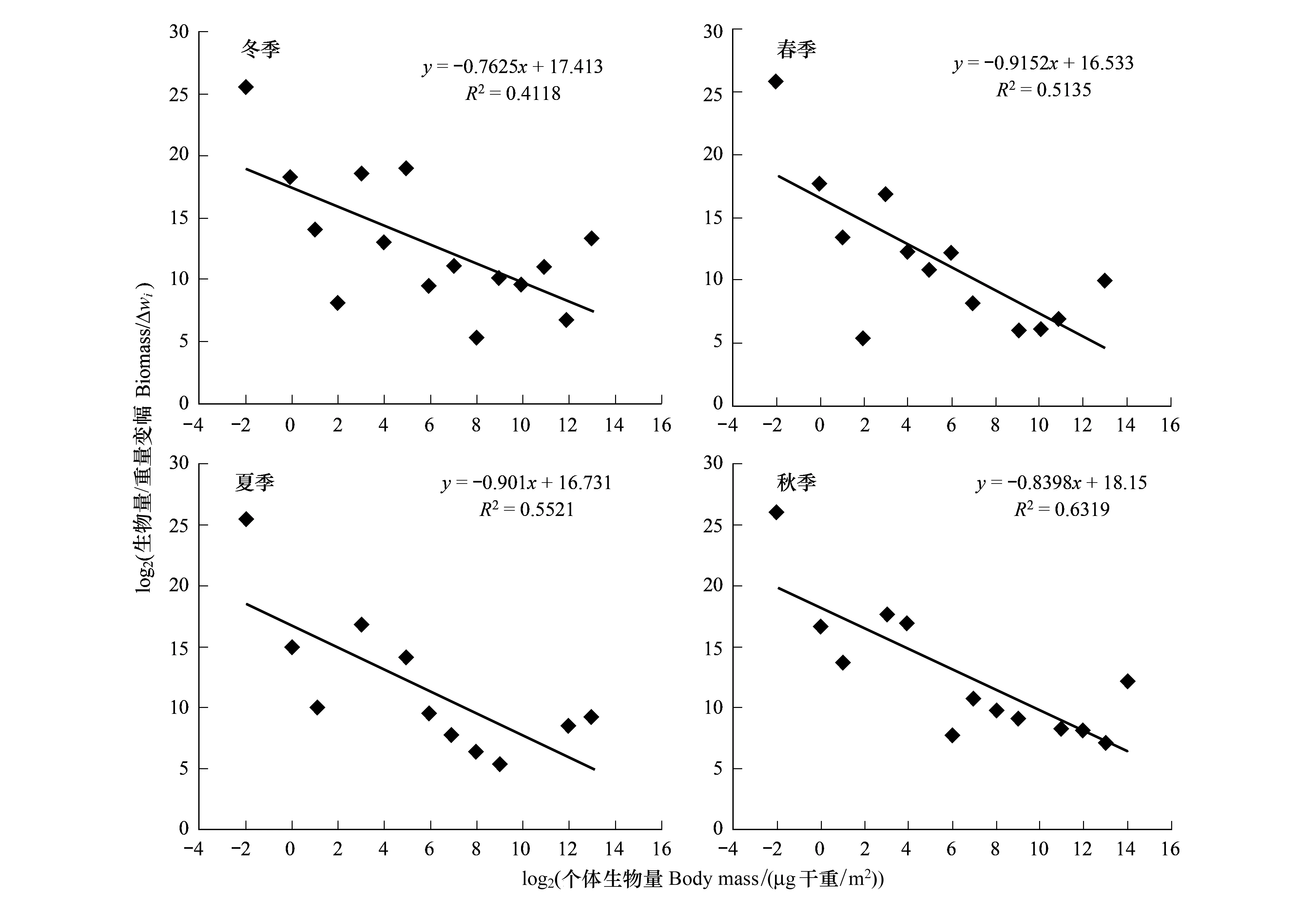
图5 4个季节底栖动物生物量粒径谱Fig.5 Normalized biomass spectra of benthos in four seasons
3 讨论
3.1 高桥红树林湿地底栖动物生物量粒径谱特点
湛江高桥红树林湿地底栖动物生物量粒径谱有2个特点。(1)木榄、桐花树和无棒海桑生境在0—4粒级之间出现一个明显的波谷。(2)出现了3峰模式。但是,高桥红树林湿地底栖动物生物量粒径谱的3峰模式与黄河口邻近海域底栖动物生物量粒径谱3峰模式[1]不同,前者第一峰在-2粒级,后者第一峰在-3—-1粒级,均由自由生活海洋线虫构成[1],由此推测,红树林湿地自由生活海洋线虫个体比潮下带的自由生活线虫个体大。高桥红树林湿地底栖动物生物量粒径谱的第二峰和第三峰也与黄河口邻近海域底栖动物生物量粒径谱第二峰和第三峰的粒级范围不同,证实了潮间带底栖动物群落组成与潮下带底栖动物群落组成明显差异。
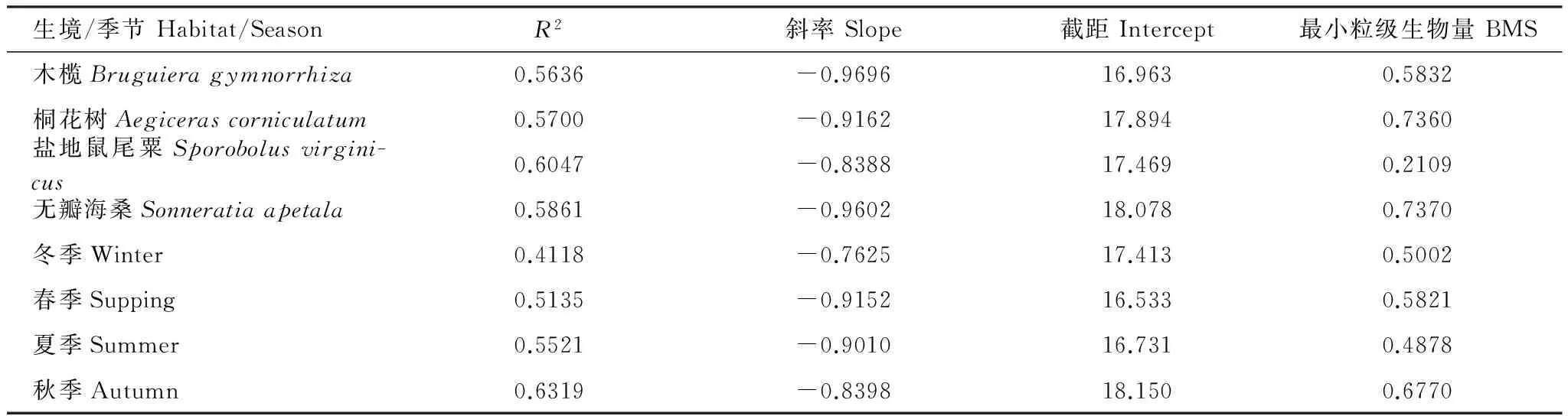
表1 高桥红树林湿地底栖动物正态化生物量粒径谱参数的比较Table 1 Parameter comparison of normalized biomass spectra of benthic fauna in Gaoqiao mangrove wetlands
BMS: 该站位粒径谱中最小粒级的生物量Biomass of Minimum Size
Schwinghamer对加拿大芬迪湾和大西洋沿岸内湾的底栖生物群落构建的粒径谱图形显示,小型和大型底栖动物分别形成波峰,通常成为双峰模式,并在交汇处形成波谷[13]。黄河口邻近海域底栖动物生物量粒径谱粒级1—8是除海洋线虫意外的其他小型底栖动物类群和一些小个体大型底栖动物,且在它们的交汇处(粒级1—3)形成波谷[1]。而Drags和Duplisea的研究结果显示,生物量粒径谱结果并不服从双峰模式,并且也没有明显的大型-小型底栖动物波谷的出现[14-15]。本研究中,小型与大型底栖动物交汇区(粒级0—4)也形成波谷。Marina等认为波峰、波谷的出现并不是一个保守的现象,主要是取决于特殊物种的存在,不能简单的归于底质粒径和栖息环境的差异[16]。本研究中,波峰所对应的粒级上出现的动物一般具有高的栖息密度的特点,例如,在无瓣海桑生境中,由于宽身闭口蟹(Cleistostomadilatatum)拥有高的栖息密度,使其在粒级13处形成一波峰;在盐地鼠尾粟生境中,由于蜾蠃蜚(Crophiumsp.)拥有高的栖息密度,使其在粒级7处形成一波峰。由此而知,特殊物种的存在对生物量粒径谱图形产生了十分重要的影响。但是笔者认为,正是由于栖息环境的差异(例如有机质含量 、溶解氧浓度、底质粒径等因素),才产生了各生境中物种、优势种的差异。此外,各季节的底栖动物生物量粒径谱图形相似,说明了季节的差异对粒径谱结构的影响并不大。
3.2 高桥红树林湿地正态化生物量粒径谱参数的生态特征
正态化生物量粒径谱中有几个参数:R2、斜率、截距、BMS,便于生态系统之间的比较。Sprules等提议用正态化生物量粒径谱的斜率和截距作为水生生态系统结构的定量指标[12]。正态化生物量粒径谱的斜率能够用来描述生态系统中生物量的变化趋势。当斜率为-1,生物量不随生物个体的变化而变化;当斜率大于-1,生物量随着生物个体的增大而增加;当斜率小于-1,生物量随着生物个体的增大反而减小。湛江高桥红树林湿地不同植物生境、不同季节的底栖动物正态化生物量粒径谱的斜率都大于-1,说明生物量随着生物个体的增大而增加。正态化生物量粒径谱的截距可用来描述生态系统的特征,反映生产力的水平,截距的差异反映了不同生态系统营养循环、利用以及生产力水平的差异。截距值大,生产力水平也高;截距值小,生产力水平低[17]。然而,Rice等认为描述正态化粒径谱利用中值粒级高度要比利用斜率更为理想,因为中值粒级高度能够消除正态化生物量粒径谱中斜率与截距经验关系所产生的影响[18-19]。此外,最小粒级的生物量(BMS)同样能够描述生态系统的特征。BMS越高,斜率值越小,生产力水平越高(截距值越大)。对湛江高桥不同植物生境、不同季节的正态化生物量粒径谱截距、BMS进行比较,可以发现,在桐花树和无瓣海桑生境的截距、 BMS高于木榄和盐地鼠尾粟生境,这说明桐花树和无瓣海桑生境的生产力水平较高,与大型底栖动物次级生产力的研究一致[20];秋季的截距、BMS高于其他季节,这说明秋季的生产力水平较高,这与大型底栖动物次级生产力的研究结果不一致[20],推测是由于在大型底栖动物次级生产力计算公式中,双壳类的红树蚬等大个体生物对次级生产力起重大影响作用,而正态化粒级谱则去除了粒级大于14的生物。
在利文斯顿岛(Livingston Island)开展的大型底栖动物群落的生物量粒径谱的研究中,Salinas发现沿水深的梯度,正态化生物量粒径谱的斜率有所变化,在水深小于100m的站位,斜率大于-1(a=-0.76),截距值为7.79,正态化生物量粒径谱曲线比较平缓[21]。王睿照等研究南黄海典型站位的斜率a大于-1,截距为13.6—14.4[2],而邓可等研究南黄海典型站位的斜率大于-1,截距13.202—14.807[4]。林秀春对湄洲湾贝类养殖滩涂的底栖动物进行相关研究,正态化粒径谱的斜率大于-1,截距为13.141—17.542[3]。周细平对同安湾人工种植红树林底栖动物进行了研究,斜率大于-1,截距为13.382—20.608[8]。曹婧对漳江口红树林底栖动物进行了研究,斜率大于-1,截距为13.992—16.494[9]。本研究结果显示,湛江高桥红树林湿地各植物生境的斜率大于-1,截距为16.963—18.078,与其他红树林湿地的结果接近。从红树林湿地与潮下带底栖动物正态化生物量粒径谱的斜率和截距比较可以看出,无论是红树林湿地或潮下带,斜率均大于-1;截距红树林湿地略高于潮下带,体现了红树林湿地高生产力的特点。
目前,底栖动物生物量粒径谱的相关研究不多,且各研究间存在着一定的差异,例如,生物量计算方法不同、粒级划分依据不同等。这就使得与底栖动物生物量粒径谱相关的各研究之间缺乏可比性, 也阻碍了生物量粒径谱成为有效的指示方法[3]。因此,制定统一的基础研究方法以增强各研究之间的可比性显得十分重要。
[1] 华尔, 张志南. 黄河口邻近海域底栖动物粒径谱研究. 中国海洋大学学报: 自然科学版, 2009, 39(5): 971- 978.
[2] 林岿璇, 张志南, 王睿照. 东、黄海典型站位底栖动物粒径谱研究. 生态学报, 2004, 24(2): 241- 245.
[3] Hua E, Zhang Z N, Richard M. Pattern of benthic biomass size spectra from shallow waters in the East China Seas. Marine Biology, 2013, 160(7): 1723- 1736.
[4] 邓可, 张志南, 黄勇, 于子山. 南黄海典型站位底栖动物粒径谱及其应用. 中国海洋大学学报: 自然科学版, 2005, 35(6): 1005- 1010.
[5] 王睿照. 南黄海典型海域底栖动物粒径谱研究 [D]. 青岛: 中国海洋大学, 2003.
[6] 张青田, 胡桂坤. 渤海湾近岸底栖动物的生物量粒径谱研究. 天津师范大学学报, 2013, 33(2): 81- 84.
[7] 林秀春. 湄洲湾灵川贝类养殖滩涂底栖动物生态和粒径谱研究 [D]. 厦门: 厦门大学, 2006.
[8] 周细平. 同安湾人工种植红树林对底栖动物生态效应研究[D]. 厦门: 厦门大学, 2007.
[9] 曹婧. 福建漳江口红树林和盐沼湿地小型底栖动物的研究 [D]. 厦门: 厦门大学, 2012.
[10] Higgins R P, Thiel H. Introduction to the Study of Meiofauna. Washington D C: Smithsonian Institute Press, 1988: 1- 488.
[11] Robert J F, Warwick R M. Energetics // Higgins R P, Thiel H. Introduction to the Study of Meiofauna. Washington D. C.: Smithsonian Institution Press, 1988: 181- 196.
[12] Sprules W G, Munawar M. Plankton size spectra in relation to ecosystem productivity, size, and perturbation. Canadian Journal of Fisheries and Aquatic Sciences, 1986, 43(9): 1789- 1794.
[13] Schwinghamer P. Characteristic Size distributions of integral benthic Communities. Canadian Journal of Fisheries and Aquatic Sciences, 1981, 38(10): 1255- 1263.
[14] Drags A, Radziejewska T, Warzocha J. Biomass size spectra of near-shore shallow-water benthic communities in the Gulf of Gdansk Southern Baltic Sea. Marine Ecology, 1998, 19(3): 209- 228.
[15] Duplisea D E. Benthic organism biomass size-spectra in the Baltic Sea in relation to the sediment environment. Limnology and Oceanography, 2000, 45(3): 558- 568.
[16] Dolbeth M, Raffaelli D, Pardal M. Patterns in estuarine macrofauna body size distributions: The role of habitat and disturbance impact. Journal of Sea Research, 2014, 85: 404- 412.
[17] Boudreau P R, Dickie L M. Biomass spectra of aquatic ecosystems in relation to fishes yield. Canadian Journal of Fisheries and Aquatic sciences, 1992, 49(1): 1528- 1538.
[18] Rice J, Gislason H. Patterns of change in the size spectra of numbers and diversity of the North Sea fish assemblage, as reflected in surveys and models. ICES Journal of Marine Science, 1996, 53: 1214- 1225.
[19] Daan N, Gislason H, Pope J G, Rice J. Changes in the North Sea fish community: evidence of indirect effects of fishing. ICES Journal of Marine Science 2005, 62: 177- 188.
[20] 蔡立哲, 许鹏, 傅素晶, 彭欣, 曹婧, 陈昕韡, 吴辰, 刘莎. 湛江高桥红树林和盐沼湿地的大型底栖动物次级生产力. 应用生态学报, 2012, 23(4): 965- 971.
[21] Saiz-Salinas J I, Ramos A. Biomass size-spectra of macrobenthic assemblages along water depth in Antarctica. Marine Ecology Progress Series, 1999, 178:221- 227.
Size spectrum of benthic fauna in Zhanjiang Gaoqiao Mangrove Wetlands, China
RAO Yiyong1, CAI Lizhe1,2,*, HUANG Congli1, LI Xiang1, ZHUO Yi1, GUO Tao1, YAN Lulu1, FU Sujing1, CHEN Xinwei1
1CollegeoftheEnvironment&Ecology,XiamenUniversity,Xiamen361102,China
2KeyLaboratoryoftheCoastalandWetlandEcosystems(XiamenUniversity),MinistryofEducation,Xiamen361102,China
The biomass size spectrum (BSS) theory was introduced by Sheldon et al. in 1972 to describe the features of marine pelagic ecosystems. Schwinghamer was the first to extend this concept to benthic assemblages. Traditionally, benthic communities are described by structural variables, such as abundance, species composition, and biodiversity indices. Analysis of the distribution of biomass by size is an ataxonomic approach to studying the structures and functions of the benthic communities. The introduction of the BSS theory provides a new method for benthic ecology research. Compared to taxonomic approaches for studying the structures and functions of benthic communities, the BSS theory is easier to operate, in which calculation errors caused by inaccurate taxonomic identification may be avoided. Because of the urgent need to understand the structures and functions of marine ecosystems, and to accurately detect the ecological systems, the fields of application for the BSS theory will become more extensive. In China, most studies on the size spectrum of zoobenthos have been conducted in the subtidal zone, with only a few studies having been conducted in the intertidal zone. In addition, no studies have been conducted in mangrove swamps. To provide a scientific basis for the ecological protection and sustainable use of the Gaoqiao Mangrove Wetlands, the BSS of the benthic fauna in this area was constructed from macrofaunal and meiofaunal samples collected in January, April, July, and October 2010. The main results showed that the BSS of the benthic fauna in Gaoqiao Mangrove Wetlands exhibits 3 peaks. The first peak appeared at a grain size of -2, and comprised nematodes. The second peak appeared at grain sizes of 4—12, and comprised oligochaetes, polychaetes, and small-bodied crustaceans. The third peak appeared at grain sizes of 13—22, and comprised large-bodied gastropods, bivalves, and crustaceans. ForAegicerascorniculatum,SonneratiaapetalaandBruguieragymnorrhizabiotopes, there was a trough at grain sizes 0—4, which was the intersection grain size between macrofauna and meiofauna. The slope values of the normalized biomass size spectra (NBSS) were greater than -1, while the intercepts ranged from 16.533 to 18.150. The intercepts and the biomass of minimum size (BMS) forA.corniculatumandS.apetalabiotopes were higher than those inB.gymnorrhizaandSporobolusvirginicusbiotopes. This result indicated that zoobenthic productivity in theA.corniculatum, andS.apetalabiotopes were higher than that in theB.gymnorrhizaandS.virginicusbiotopes. The intercept and BMS in fall were higher than those in other seasons, indicating that zoobenthic productivity was higher in fall compared to the other seasons.
benthic fauna; size spectrum; mangrove wetland; Zhanjiang
国家自然科学基金(41176089,41376113)
2014- 02- 16;
日期:2015- 04- 14
10.5846/stxb201402160265
*通讯作者Corresponding author.E-mail: cailizhe@xmu.edu.cn
饶义勇,蔡立哲,黄聪丽,李想,卓异,郭涛,颜露露,傅素晶,陈昕韡.湛江高桥红树林湿地底栖动物粒径谱.生态学报,2015,35(21):7182- 7189.
Rao Y Y, Cai L Z, Huang C L, Li X, Zhuo Y, Guo T, Yan L L, Fu S J, Chen X W.Size spectrum of benthic fauna in Zhanjiang Gaoqiao Mangrove Wetlands, China.Acta Ecologica Sinica,2015,35(21):7182- 7189.
