全反式维甲酸对腹膜透析相关性腹膜纤维化大鼠转化生长因子β1、结缔组织生长因子、α 平滑肌肌动蛋白表达的影响
2015-01-19李敏芝熊燕移史伟文张莞灵卓华钦
李敏芝 熊燕移 史伟文 张莞灵 卓华钦
广东省东莞市第三人民医院肾内科,广东东莞 523320
腹膜透析(peritoneal dialysis)是一种以人体腹膜为透析膜的透析方案, 操作时需将透析液灌注至腹腔, 并通过腹膜另一侧的毛细血管网交换溶质和水分,最终清除患者体内潴留的代谢产物,同时补充机体所缺乏的相关物质[1]。腹膜透析技术具有操作简便、血流动力学影响小、 残余肾脏功能保护好等优势,但也存在腹膜纤维化等相关并发症。腹膜纤维化是腹膜透析主要并发症之一,也是多数腹膜透析患者退出腹膜透析的主要原因[2]。 全反式维甲酸(all trans retinoic acid,ATRA) 是动物体内维生素A 代谢的中间产物,具有广泛的生理学及药理学效用,为分析该药物在腹膜透析中的抗腹膜纤维化中的作用,本研究选取雄性SD 大鼠进行研究,现报道如下:
1 材料与方法
1.1 实验动物
选择40 只雄性SD 大鼠,周龄6~8 周,体重220~260 g,由山东大学动物实验研究中心提供,动物合格证号:SCKX20140017; 所有大鼠均喂养于室温24℃、安静、光照12 h、湿度45%、自由进食进水的环境中,编号后随机分为对照组、模型组、实验1 组、实验2组,每组各10 只。
1.2 药品与试剂
选用庆华邦制药有限公司生产的ATRA;选用美国Baxter 医疗用品有限公司生产的4.25%腹膜透析液; 选用武汉博士德生物工程有限公司生产的兔抗大鼠转化生长因子-β1(TGF-β1)、结缔组织生长因子(CTGF)以及α 平滑肌肌动蛋白(α-SMA)多克隆抗体;选用美国Sigma 公司生产的二甲亚砜;选用福州迈新生物技术开发有限公司生产的浓缩型DAB 显色剂;选用立陶宛MBI 公司生产的逆转录试剂盒;选用京博大泰克生物基因技术有限公司生产的PCR反应缓冲液。
1.3 方法
1.3.1 造模方法 对照组:腹腔注射生理盐水10 mL/d+5 mL 磷酸盐缓冲液稀释的二甲亚砜;模型组:腹腔注射4.25%腹透液10 mL/d+5 mL 磷酸盐缓冲液稀释的二甲亚砜;实验1 组:腹腔注射4.25%腹透液10 mL/d+ATRA 2 mg/kg;实验2 组:腹腔注射4.25%腹透液10 mL/d+ATRA 5 mg/kg。 所有大鼠均药物干预4 周,期间自由进食、饮水。
1.3.2 检测指标 干预4 周后处死大鼠,处死前1 h 对大鼠进行腹膜平衡实验。 局部麻醉后,向所有大鼠腹腔注入腹透液20 mL,30 min 后打开腹腔,吸取液体,称重,计算超滤量。同时给予大鼠股动脉取血操作,血标本置于-5℃温箱内待用。
避开注射部位取大鼠腹膜及肠系膜组织,一部分标本4%多聚甲醛固定, 一部分置于含1.5 mL Trizol的EP 管内。 选用荷兰威图Seleetra 全自动生化仪检测血液样本中的尿素、葡萄糖浓度及肝细胞生长因子(HGF)、骨形态发生蛋白-7(BMP-7)、白细胞介素-6(IL-6)、血管内皮生长因子(VEGF)表达水平。将多聚甲醛固定的样本常规石蜡包埋, 切片, 脱蜡,H2O2灭活,滴入0.01 mol/L 枸橼酸盐缓冲液,微波加热至沸腾,冷却,洗涤,BSA 封闭,滴入兔抗大鼠脏层腹膜组织中TGF-β1、CTGF 或α-SMA 多克隆抗体一抗,洗涤,山羊抗兔IgG 二抗,洗涤,BAD 显示,封片,镜检,并采用Imageproplus 6.0 软件进行数据提取与处理。1.3.3 观察指标 观察对比四组大鼠的体重变化情况、腹膜功能变化情况[超滤量(UF)、透析液尿素浓度(D)、血浆尿素浓度(Purea)、初始腹透液葡萄糖浓度(D0)、透出液葡萄糖浓度(D1)、计算D/Purea、D1/D0]、TGF-β1、CTGF、α-SMA 的表达变化情况、 各组大鼠血清细胞因子HGF、BMP-7、IL-6、VEGF 的变化情况。
1.4 统计学方法
采用统计软件SPSS 17.0 对数据进行分析,正态分布计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,两两比较采用LSD-t 检验。计数资料以率表示,采用χ2检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 四组实验大鼠的一般情况变化
各组大鼠均正常进食、进水,无实验大鼠死亡,实验1 组和实验2 组大鼠有不同程度的脱毛、 竖毛现象;四组实验大鼠的体重在实验第1 天比较,差异无统计学意义(P >0.05);实验第4 周,模型组大鼠体重最高,组间比较差异有统计学意义(P <0.05)。见表1。
表1 四组大鼠的体重变化情况(g,±s)
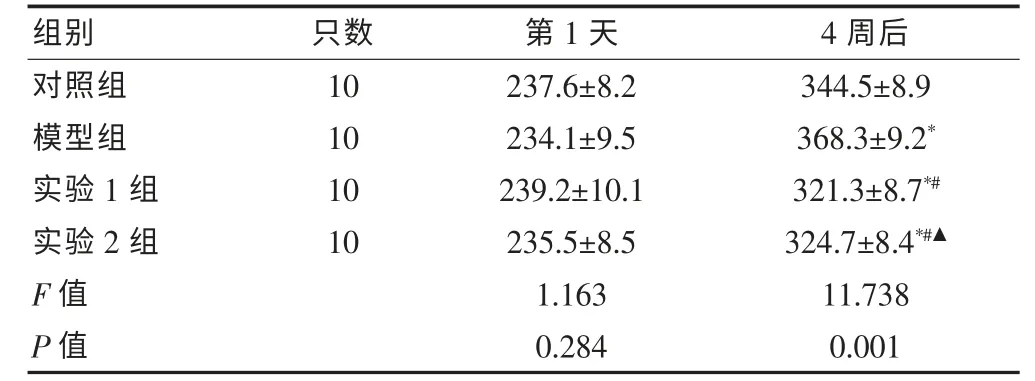
表1 四组大鼠的体重变化情况(g,±s)
注:与对照组比较,*P <0.05;与模型组比较,#P <0.05;与实验1 组比较,▲P <0.05
?
2.2 四组实验大鼠的腹膜功能测定情况
实验第4 周,模型组和实验1 组的腹膜功能指标UF、D/Purea、D1/D0测定值较对照组均有不同程度的下降,差异有统计学意义(P <0.05);实验2 组与对照组比较,差异无统计学意义(P >0.05)。 见表2。
表2 四组实验大鼠的腹膜功能测定情况(±s)

表2 四组实验大鼠的腹膜功能测定情况(±s)
注:与对照组比较,*P <0.05;与模型组比较,#P <0.05;与实验1 组比较,▲P <0.05; UF:超滤量; D:透析液尿素浓度; Purea:血浆尿素浓度; D0:初始腹透液葡萄糖浓度;D1:透出液葡萄糖浓度
组别 只数 UF(mL) D/Purea D1/D0对照组模型组实验1 组实验2 组F 值P 值10 10 10 10 10.4±0.5 4.9±0.8*7.2±1.1*#9.8±1.3#▲18.436 0.001 0.49±0.05 0.76±0.11*0.62±0.08*#0.51±0.04#▲7.066 0.032 0.74±0.09 0.39±0.07*0.63±0.06*#0.71±0.08#▲9.707 0.016
2.3 四组实验大鼠腹膜组织的纤维化细胞因子表达情况
与对照组比较,模型组、实验1 组、实验2 组的脏层腹膜组织中TGF-β1、CTGF、α-SMA 免疫组化检测结果均发生显著的变化,差异有统计学意义(P <0.05);且实验1 组、 实验2 组较模型组的表达水平降低,差异有统计学意义(P <0.05)。 见表3。
表3 四组实验大鼠腹膜组织的纤维化细胞因子表达情况(±s)

表3 四组实验大鼠腹膜组织的纤维化细胞因子表达情况(±s)
注:与对照组比较,*P <0.05;与模型组比较,#P <0.05;与实验1 组比较,▲P <0.05;TGF-β1:转化生长因子-β1;CTGF:结缔组织生长因子;α-SMA:α 平滑肌肌动蛋白
组别 只数 TGF-β1 CTGF α-SMA对照组模型组实验1 组实验2 组F 值P 值10 10 10 10 126.7±18.4 634.9±47.2*388.5±31.9*#226.5±27.3*#▲31.723 0.001 67.8±13.9 498.5±71.3*308.5±59.1*#187.4±46.4*#▲18.749 0.001 83.9±28.5 673.5±182.7*408.2±151.4*#276.3±98.9*#▲10.083 0.005
2.4 四组实验大鼠的血清纤维化细胞因子变化情况
模型组、实验1 组、实验2 组HGF、BMP-7、IL-6、VEGF 表达水平均较对照组显著升高,差异有统计学意义(P <0.05);实验1 组、实验2 组的HGF、BMP-7、IL-6、VEGF 表达水平显著低于模型组, 差异有统计学意义(P <0.05)。 见表4。
表4 四组实验大鼠的血清纤维化细胞因子变化情况(ng/L,±s)

表4 四组实验大鼠的血清纤维化细胞因子变化情况(ng/L,±s)
注:与对照组比较,*P <0.05;与模型组比较,#P <0.05HGF:葡萄糖浓度及肝细胞生长因子;BMP-7:骨形态发生蛋白-7;IL-6:白细胞介素-6;VEGF:血管内皮生长因子
组别 只数 HGF BMP-7 IL-6 VEGF对照组模型组实验1 组实验2 组F 值P 值10 10 10 10 108.4±19.6 276.4±25.1*194.5±17.2*#148.5±16.6*#16.682 0.001 112.8±14.9 348.5±31.7*225.7±23.5*#183.9±27.4*#12.831 0.001 32.6±9.4 108.5±17.3*67.9±13.5*#47.8±14.7*#12.191 0.001 0.18±0.01 0.53±0.09*0.32±0.07*#0.26±0.06*#12.223 0.001
3 讨论
腹膜纤维化多见于腹膜透析中晚期,其病理学表现为腹膜间皮质细胞脱落、微绒毛丧失、细胞外基质沉积、细胞间隙增大、胶原纤维排列紊乱等[3]。 间皮细胞损伤是腹膜纤维化早期病变基础,随着透析时间的延长,透析液内的葡萄糖将进一步抑制间皮细胞的增殖,并同时干扰细胞外基质的代谢,导致腹膜间皮细胞形态改变,最终纤维化。 纤维化的腹膜将无法继续进行腹膜透析,这将影响患者的进一步治疗[4]。 因此,如何有效地降低腹膜纤维化成为腹膜透析治疗工作中的重点。
ATRA 是维甲酸的重要活性形式,可与维甲酸受体相互作用,进而调节、影响胚胎发育,对多种细胞(如肿瘤细胞、平滑肌细胞等)生殖、分化具有重要作用。 此外,ATRA 还具有抗炎及调节细胞外基质合成的功效。 近些年的研究显示,ATRA 在动物模型中具有极高的抗纤维化及细胞增殖能力,并开始应用于治疗成纤维细胞大量增殖相关皮肤疾病的防治中[5]。研究显示,ATRA 可通过调节肾脏组织的TGF-β1表达水平来影响细胞外基质代谢,降低血小板衍生因子水平,增强系膜细胞外基质金属蛋白酶的表达,最终延缓肾小球的硬化[6]。 为分析ATRA 对腹膜透析相关腹膜纤维化的影响, 本研究进行大鼠造模实验发现,模型组和实验1 组的腹膜功能指标UF、D/Purea、D1/D0测定值较对照组均有不同程度的下降, 提示腹膜透析对大鼠腹膜功能具有明显损伤,造模成功。 本研究发现,相比照组,模型组、实验1 组、实验2 组的脏层腹膜组织中TGF-β1、CTGF、α-SMA 免疫组化检测结果均发生显著的变化(P <0.05),实验1 组、实验2组较模型组表达水平更低(P <0.05)。 脏层腹膜组织中TGF-β1 是临床公认的强效致纤维化因子,参与着多种器官的纤维化过程。 TGF-β1主要由巨噬细胞、T淋巴细胞合成,具有多种生理功能,对细胞外基质的形成、血管的生成、炎症以及组织修复等均有重要作用[7]。 动物实验表明,大量注入TGF-β1腺病毒载体后,大鼠将出现明显腹膜增厚、血管新生以及间质细胞增殖情况, 其腹膜功能显著下降, 提示高表达的TGF-β1对腹膜纤维化具有重要作用[8]。CTGF 属于CCN家族的一员,具有促细胞增殖、调节细胞外基质、促细胞黏附及趋化的能力。 CTGF 可介导TGF-β1促纤维化,是腹膜及其他脏器纤维化的重要影响因子[9]。 α-SMA 是真核细胞的骨架蛋白,参与着微丝的构成,是细胞转化为成肌成纤维细胞的标志性蛋白。
本研究中还发现,模型组、实验1 组、实验2 组HGF、BMP-7、IL-6、VEGF 表达水平均较对照组显著升高(P <0.05),实验1 组、实验2 组的HGF、BMP-7、IL-6、VEGF 表达水平显著低于模型组(P <0.05)。HGF 是急性肝损伤动物血浆内的一种蛋白因子,对肝再生具有重要作用[10-11]。 体外实验表明,HGF 可降低、逆转肾间质纤维化、肝纤维化等脏器纤维化进程[12-13]。 BMP-7 是人体间充质细胞分化为骨、软骨、肌腱、韧带的重要诱导蛋白。 IL-6 是炎症因子的一种,可由间皮细胞或浸润的炎症细胞合成, 炎症是纤维化的重要病理诱因之一[14-16]。 VEGF 具有促腹膜血管生成能力, 对腹膜纤维化病理生理过程具有重要促进作用。
综上所述,TGF-β1、CTGF、α-SMA 等细胞因子是腹膜透析相关腹膜纤维化的重要影响因子,而ATRA可通过调节大鼠TGF-β1、CTGF、α-SMA 等细胞因子的表达来抑制腹膜纤维化过程,并维持大鼠腹膜功能。
[1] 贾真,姬丽华,陈景荷,等.转录因子Twist 促进腹膜透析患者腹膜纤维化的作用机制研究[J].解放军医学杂志,2013,38(11):879-884.
[2] 李英楠,张鹂,吕海涛,等.阿托伐他汀对腹膜透析大鼠腹膜纤维化的影响及机制探讨[J].山东医药,2014,1(24):25-27.
[3] 王红,赵占正,申万琴,等.腹膜透析大鼠腹膜组织中HIF-1α 和CTGF 的表达[J].郑州大学学报:医学版,2012, 47(2):205-208.
[4] Karin G,Gerritsen,Hilde P,et al. Renal proximal tubular dysfunction is a major determinant of urinary connective tissue growth factor excretion [J]. Renal Physiology:American Journal of Physiology,2010,298(6):1457-1464.
[5] 孙立霞,马健飞,邓文艳.高糖对大鼠腹膜间皮细胞整合素连接激酶、结缔组织生长因子及α-平滑肌肌动蛋白表达的影响[J].中国血液净化,2013,12(6):323-326.
[6] Cassie M,Fujita N,Huang BL,et al.Hypoxia-inducible factor (HIF)-1α and CCN2 form a regulatory circuit in hypoxic nucleus pulposus cells: CCN2 suppresses HIF-1α level and transcriptional activity [J]. The Journal of Biological Chemistry,2013,288(18):12654-12666.
[7] 夏武,杨宇平,陈永凤,等.维甲酸对转化生长因子β1 诱导的HFL-I 细胞Ⅲ型胶原、STAT3 和PIAS3 表达的影响[J].中国病理生理杂志,2012,28(6):1114-1119.
[8] Lin BR,Chang CC,Chen RJ. Connective tissue growth factor acts as a therapeutic agent and predictor for peritoneal carcinomatosis of colorectal cancer[J].Clinical Cancer Research:Official Journal of the American Association for Cancer Research,2011,17(10):3077-3088.
[9] 黄玉晗.腹膜透析与腹膜纤维化[J].肾脏病与透析肾移植杂志,2014,23(4):382-384.
[10] 韦永光,林沁,潘淼,等.罗格列酮抑制大鼠腹膜透析相关性腹膜纤维化中TGF-β1 和CTGF 的表达[J].中国中西医结合肾病杂志,2014,1(7):583-586.
[11] 赵焱,邓扬,闫弘睿,等.肝细胞生长因子与2 型糖尿病心脏自主神经病变相关性研究[J].中国实验诊断学,2015,19(3):409-411.
[12] 张敏,赵菁莉.中医药防治腹膜纤维化的研究进展[J].现代生物医学进展,2014,14(1):166-168,197.
[13] 王新荣,杨智慧,江平,等.碱性成纤维细胞生长因子和肝细胞生长因子在胃肠癌中的表达及意义[J].中国医学前沿杂志:电子版,2015,7(1):98-100.
[14] 王桂花,赵金文,陈连华,等.全反式维甲酸对腹膜透析大鼠脏层腹膜组织中CTGF 和α-SMA 表达的影响[J].山东医药,2014,54(4):28-30.
[15] 梁秀军,翟泽玲,董文娟,等.胶原性关节炎大鼠炎性细胞因子的动态观察[J].中国实验动物学报,2013,21(3):57-60,后插9.
[16] 高共鸣,农鲁明,周栋,等.白细胞介素-6 通过p38 蛋白调控髓核细胞的增殖和迁移[J].中华实验外科杂志,2015,32(1):117-119.
