脑外伤患者血浆脂联素的检测及临床意义
2015-01-18沈良军杨松斌吕庆伟章国海周晶过宓黄杭斌李赵杨春松
沈良军 杨松斌 吕庆伟 章国海 周晶 过宓 黄杭斌 李赵 杨春松
脑外伤患者血浆脂联素的检测及临床意义
沈良军 杨松斌 吕庆伟 章国海 周晶 过宓 黄杭斌 李赵 杨春松
目的 探讨脑外伤患者血浆脂联素水平的变化规律及与脑外伤严重度的相关性。方法 选取86例重型脑外伤患者和86例健康体检者,分别于入院时、入院后第1、2、3、5、7天和体检时清晨空腹抽取静脉血,ELISA法测定血浆脂联素水平。结果 脑外伤后血浆脂联素水平6h内升高,24h到达高峰,后逐渐下降,入院时、入院后第1、2、3、5、7天的血浆脂联素水平均明显高于健康对照组(均P<0.01);蛛网膜下腔出血、环池消失、中线移位(>5mm)和瞳孔散大患者各个时间点血浆脂联素水平显著高于其对照组(均P<0.01)。入院时格拉斯哥昏迷评分与各个时间点血浆脂联素水平均呈负相关(均P<0.01)。结论 脑外伤后血浆脂联素水平升高,与脑外伤严重度显著相关。
脂联素 脑外伤 严重度
脑外伤(traumatic brain injury,TBI)发生率高,预后差[1]。格拉斯哥昏迷评分(glasgow coma scale,GCS)低、中线明显移位(>5mm)、环池消失、外伤性蛛网膜下腔出血及瞳孔散大与脑外伤不良预后显著相关[2]。脂联素是最初发现由脂肪细胞分泌的一种内源性生物活性多肽或蛋白质,具有抗糖尿病、抗动脉粥样硬化和抗炎作用[3]。外周血高浓度脂联素与肝硬化、类风湿性关节炎、炎症性肠病及系统性红斑狼疮等疾病的发生、发展密切相关,可独立预测心功能衰竭、心肌梗死和肾移植等疾病不良预后[4-5]。脑外伤及脑缺血动物脑皮层脂联素明显聚集[6-7]。外周血高水平脂联素与脑出血及脑梗死的预后相关[8-9]。笔者既往研究发现,入院时高水平血浆脂联素浓度可独立预测脑外伤患者住院期间死亡、外伤后6个月死亡和神经功能恢复不良[10]。笔者进一步检测脑外伤患者血浆脂联素浓度,旨在揭示其变化规律及与脑外伤严重度的关系,现报道如下。
1 对象和方法
1.1 对象 收集2010年1月至2012年7月本科收治的重型脑外伤(GCS<9分)患者86例,男56例,女30例;年龄18~76岁,平均(43.3±13.9)岁;外伤后0.5~6h,平均(3.0±1.2)h入院;车祸57例,砸伤18例,摔伤11例;闭合性颅脑损伤58例,开放性颅脑损伤28例;硬膜外血肿20例,硬膜下血肿34例,脑内多发血肿11例,颅底骨折21例,颅盖骨骨折45例,广泛性脑挫裂伤30例,颅内静脉窦损伤12例,蛛网膜下腔出血51例。入院时GCS评分3~8分,平均(6.0±1.5)分。环池消失28例,瞳孔散大32例,中线移位(>5mm)40例;急诊手术治疗38例。选择同期我院健康体检者86例作为健康对照组,年龄和性别与脑外伤组匹配。所有对象均排除肥胖症、糖尿病、高血压病、高脂血症、既往脑血管性疾病、使用抗凝剂、严重感染、严重心肝肾疾病及严重头部外伤史,脑外伤组同时排除其他部位严重外伤及原发性脑干损伤。
1.2 方法 对照组于体检时,脑外伤组于入院时、入院后第1、2、3、5、7天采集清晨空腹静脉血2ml置EDTAK2管中,室温下1 000g离心15min,收集血浆于-70℃保存待检。采用ELISA法检测血浆脂联素水平,试剂盒购自美国R&D公司,在美国BIO-RAD Coda全自动酶免疫分析仪上按照试剂盒说明书进行检测,并参照试剂盒说明书计算血浆脂联素水平。
1.3 统计学处理 采用SPSS 19.0统计软件。计量资料以表示,组间比较采用t检验,相关性分析采用Pearson相关。
2 结果
2.1 两组患者血浆脂联素水平的比较 脑外伤组患者血浆脂联素水平6h内升高,24h到达高峰,后逐渐下降,入院时、入院后第1、2、3、5、7天血浆脂联素水平依次为(20.5±5.9)、(35.8±8.9)、(29.7±7.5)、(24.9±6.9)、(19.5±5.3)、(15.4±4.2)μg/ml,均明显高于健康对照组(7.7±2.0)μg/ml,差异均有统计学意义(均P<0.01)。
2.1.1 蛛网膜下腔出血患者血浆脂联素水平的变化 入院时、入院后第1、2、3、5、7天,蛛网膜下腔出血患者血浆脂联素水平均显著高于非蛛网膜下腔出血患者(均P<0.01),详见表1。
2.1.2 环池消失患者血浆脂联素水平的变化 入院时、入院后第1、2、3、5、7天,环池消失患者血浆脂联素水平均显著高于非环池消失患者(均P<0.01),详见表2。
2.1.3 中线移位(>5mm)患者血浆脂联素水平的变化 入院时、入院后第1、2、3、5、7天,中线移位(>5mm)患者血浆脂联素水平均显著高于非中线移位(>5mm)患者(均P<0.01),详见表3。
2.1.4 瞳孔散大患者血浆脂联素水平的变化 入院时、入院后第1、2、3、5、7天,瞳孔散大患者血浆脂联素水平均显著高于非瞳孔散大患者(均P<0.01),详见表4。
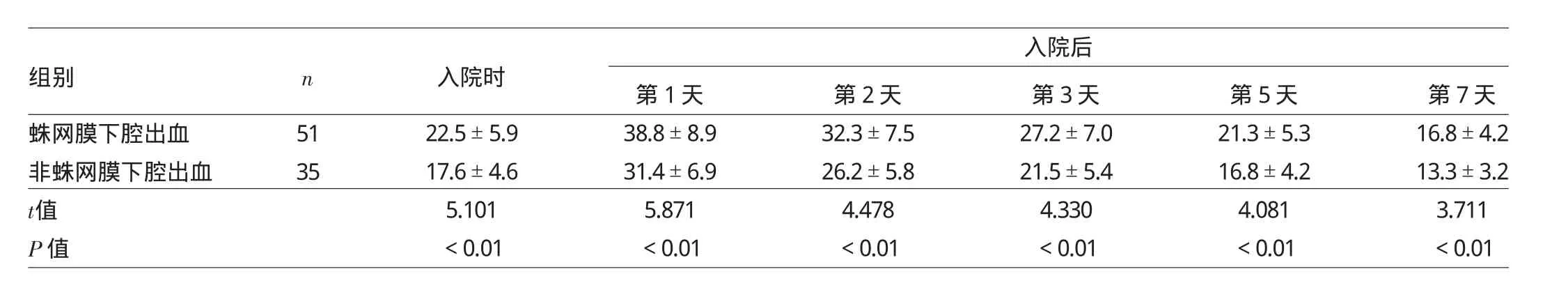
表1 蛛网膜下腔出血患者血浆脂联素水平的变化(μg/m l)

表2 环池消失患者血浆脂联素水平的变化(μg/m l)

表3 中线移位(>5mm)患者血浆脂联素水平的变化(μg/m l)
2.2 入院时GCS评分与血浆脂联素水平的相关分析经Pearson相关分析,入院时GCS评分与入院时、入院后第1、2、3、5、7天血浆脂联素水平均呈负相关性(r= -0.482、-0.572、-0.471、-0.453、-0.429、-0.401,均P<0.01)。

表4 瞳孔散大患者血浆脂联素水平的变化(μg/m l)
3 讨论
脑外伤是一种常见的外伤性疾病,严重患者病死率和致残率较高[1]。GCS评分是目前评价脑外伤预后及用于脑外伤临床危险度分层的重要临床指标。GCS评分越低,脑外伤患者预后越差。有研究证实,外伤性蛛网膜下腔出血、瞳孔散大、环池消失及中线移位(>5mm)均是脑外伤死亡及功能预后不佳的独立危险因素[2]。因此,外伤性蛛网膜下腔出血、瞳孔散大、环池消失及中线移位(>5mm)可衡量脑外伤的严重度,对临床预后也具有重要的预测价值[2]。
脑外伤后继发性脑损伤的病理生理机制复杂,涉及很多方面。炎症反应是脑外伤后继发性脑损伤的重要组成部分。脑外伤后,补体、凝血酶和纤维蛋白降解产物等可诱发一系列炎症反应,从而白介素-6、白介素-10、肿瘤坏死-α等许多炎症因子浓度升高,血脑屏障通透性增加,脑水肿加重,导致神经细胞凋亡,加重脑损伤[11]。
脂联素是近年来发现最初由脂肪细胞分泌的一种蛋白质,属于可溶性防御性胶原家族成员,含244个氨基酸,一级序列分析提示其包含4个功能区:18个氨基酸的信号肽、23个氨基酸组成的氨基端非螺旋功能区,一段22个胶原重复序列和137个氨基酸组成的羧基端,后者参与形成羧基端的球形功能区[12]。脂联素作为一种多肽激素,具有抗炎作用,它与冠心病、高血压病、胰岛素抵抗、高脂血症、2型糖尿病和肥胖等炎症性疾病的发生、发展密切相关[3-5]。
体内外研究证实,脂联素参与脑损伤的病理生理过程。生理状态下,动物脑皮层和垂体可表达丰富的脂联素[13-14],而在脑梗死和脑外伤的动物脑皮层亦有高水平的脂联素mRNA表达[6-7]。人体试验证实,脑梗死患者血浆脂联素水平有不同程度的升高且血浆脂联素水平升高与脑梗死发生密切相关[15],脂联素能改善缺血性脑损伤小鼠神经功能[16-17]。脑梗死和脑出血患者血浆脂联素水平与疾病严重度及临床预后显著相关[8-9]。目前研究提示,脂联素可能作为一种抗炎因子参与脑损伤的炎症反应过程[18]。
笔者既往研究发现,脑外伤患者入院时血浆脂联素水平显著升高,可独立预测脑外伤住院期间死亡及外伤后6个月死亡和神经功能预后不佳[10]。本研究检测多个时间点血浆脂联素水平,揭示其时程变化规律,研究发现,血浆脂联素水平在脑外伤后早期显著升高,24h达高峰,后逐渐下降,各个时间的血浆脂联素水平与脑外伤患者入院时GCS评分呈显著负相关,且外伤性蛛网膜下腔出血、瞳孔散大、环池消失及中线移位(>5mm)患者各个时间点血浆脂联素水平明显升高。因此,血浆脂联素水平可用于反映脑外伤的严重程度,为脑外伤预后的早期预测提供实验室依据,指导临床。
[1]Risda ll J E,Menon D K.Traumatic b rain injury[J].Philos Trans R Soc Lond BBiolSci,2011,366(1562):241-250.
[2]Shukla D,DeviB I,Ag rawal A.Outcome measures for traumatic brain injury[J].Clin NeurolNeurosurg,2011,113(6):435-441.
[3]FantuzziG.Adiponectin in inflammatory and immune-mediated d iseases[J].Cytokine,2013,64(1):1-10.
[5]Shehzad A,Iqba lW,Shehzad O,et al.Ad iponectin:regulation o f its p roduction and its role in human d iseases[J].Horm ones(A-thens),2012,11(1):8-20.
[6]Yatom iK,Miyamoto N,Kom ine-KobayashiM,etal.Pathophysiologica ldualaction of ad iponectin after transient foca l ischem ia in m ouse b rain[J].Brain Res,2009,1297(2):169-176.
[7]Takeuchi S,Wada K,Nawashiro H,et al.Decrease in p lasm a ad iponectin leveland increase in ad iponectin immunoreactivity in cortex and hippocampus a fter traum atic b rain injury in rats[J]. Turk Neurosurg,2013,23(3):349-354.
[8]Nagasawa H,Yokota C,Toyoda K,et al.High level of p lasm a ad iponectin in acute stroke patients is associated with stroke m ortality[J].JNeurolSci,2011,304(1):102-106.
[9]Wang W H,YuW H,Dong XQ,etal.Plasm a ad iponectin as an independentp red ictorofearly death afteracute intracereb ra lhemorrhage[J].Clin Chim Acta,2011,412(17):1626-1631.
[10]Shen L J,Yang SB,Lv QW,etal.High p lasm a ad iponectin levels in patients with severe traum atic b rain injury[J].Clin Chim Acta,2014,427(1):37-41.
[11]Frattalone A R,Ling G S.Moderate and severe traumatic b rain injury:pathophysiology and m anagement[J].Neurosurg Clin N Am,2013,24(3):309-319.
[12]Hickm an IJ,Whitehead JP.Structure,signalling and physiologic role of ad iponectin-d ietary and exercise-related variations[J]. CurrMed Chem,2012,19(32):5427-5443.
[13]Wilkinson M,Brown R,Im ran S A,etal.Ad ipokine gene exp ression in b rain and p ituitary g land[J].Neuroendocrinology,2007,86 (3):191-209.
[14]Psilopanagioti A,PapadakiH,Kranioti E F,et a l.Exp ression o f ad iponectin and ad iponectin recep tors in human p ituitary g land and b rain[J].Neuroendocrinology,2009,89(1):38-47.
[15]ArreguiM,Buijsse B,Fritsche A,et al.Ad iponectin and risk of stroke:p rospective study and m eta-analysis[J].Stroke,2014,45 (1):10-17.
[16]Chen B,Liao W Q,Xu N,et al.Ad iponec tin p rotects against cereb ral ischem ia-reperfusion injury through anti-inflammatory action[J].Brain Res,2009,1273(3):129-137.
[17]Nishim ura M,Izum iya Y,Higuchi A,et al.Ad iponec tin p revents cereb ral ischem ic injury through endothelial nitric oxide synthase dependentmechanism s[J].Circu lation,2008,117(2):216-223.
[18]TakeuchiS,Wada K,Nawashiro H,etal.Adiponectin and traumatic brain injury[J].Acta Neurochir,2013,118(Supp l):111-114.
Plasma adiponectin levels in patients w ith traumatic brain injury and its clinical significance
SHEN Liangjun,YANG Songbin,LV Qingw ei,et al.
Department of Neurosurgery,Shenzhou People's Hospital,Shenzhou 312400,China
Objective To investigate p lasma ad iponectin levels in patients w ith traumatic b rain injury(TBI)and its c linical significance.Methods Plasma adiponec tin levels were measured by enzyme-linked immunosorbent assay(ELISA)in 86 patients w ith severe b rain injury on adm ission and at d1,d2,d3,d5,d7 after adm ission.Ad iponectin levels were also measured in 86 sub jects on health checkup as controls.Results After TBI,p lasma adiponectin levels were elevated w ithin 6h, peaked at24h and decreased gradually thereafter.Plasma ad iponectin levels atall time points after TBIwere significantly higher than that in healthy controls(all P<0.01).G lasgow coma scale scores at adm ission were negatively correlated w ith p lasma adiponectin levels ateach time pointafter TBI(all P<0.01).Patients w ithm id line shift(>5mm),d isappearance of cisterna ambiens,p resence of subarachnoid hemorrhage or dilation of pupilhad higher p lasma adiponectin levels ateach time pointafter TBI (all P<0.01).Conclusion Plasma adiponectin levels are elevated after TBI,and its levels are highly associated w ith the severity ofbrain trauma.
Adiponectin Traumatic brain injury Severity
2014-07-03)
(本文编辑:严玮雯)
绍兴市科技计划项目(2012D10002)
312400嵊州市人民医院神经外科
沈良军,E-mail:13454576590@126.com
