利用半纤维素水解液中的木糖生物合成壳聚糖
2015-01-17林广修车利伟
林广修 赵 华 刘 盼 车利伟
(天津科技大学生物工程学院,工业发酵微生物教育部重点实验室,天津,300457)
·合成壳聚糖·
利用半纤维素水解液中的木糖生物合成壳聚糖
林广修 赵 华 刘 盼 车利伟
(天津科技大学生物工程学院,工业发酵微生物教育部重点实验室,天津,300457)
研究了制浆废液中半纤维素水解液中的木糖用于生物合成壳聚糖的脱毒及培养条件。结果表明,最优脱毒条件为:先加入Ca(OH)2调pH值至10,抽滤后再加入质量分数10%的H2SO4调pH值至7,再次抽滤后以1∶20的固液比加入活性炭,置于50℃摇床以120 r/min的转速处理2 h,抽滤后取上清液。雅致放射毛霉(ActinomucorelegansTCCC450005)生物合成壳聚糖的最佳培养条件为:以6%的玉米浆为氮源,以适当稀释(使木糖浓度为3%)的脱毒后制浆废液为碳源,接入雅致放射毛霉,于30℃下培养60 h,菌丝体浓度可达15.20 g/L,壳聚糖产量为2.02 g/L。
壳聚糖;半纤维素;制浆废液;脱毒;雅致放射毛霉
(*E-mail: bevallingx@163.com)
壳聚糖因其独特的理化性质,可制备成不同结构和特性的衍生物,应用广泛。在食品行业中,壳聚糖可用作果蔬涂膜保鲜剂、食品添加剂、酿酒与果汁澄清剂等,此外由于壳聚糖带有大量氨基,是食物纤维素中唯一的阳离子聚合物,可吸附肠道中脂肪,因此具有降血脂、抗血栓、预防心脑血管疾病等功效,能与果胶等酸性多糖加工成高质量、低热量的保健食品;在医药领域中,壳聚糖可用作胶囊剂和缓释剂,明显改善药物溶解性和吸收性,从而减少药用次数、减轻毒副作用,此外,国内已将壳聚糖无纺布、壳聚糖涂层纱布及壳聚糖流涎膜等材料用于临床;在环保领域中,因壳聚糖对金属离子有络合吸附作用,可作为废水处理中的金属离子螯合剂和活性污泥絮凝剂,壳聚糖无毒无害,因此沉淀物可回收提纯,用作原料或饲料,而絮凝剂经过再生后又可重复利用[1-2]。目前壳聚糖的工业化生产主要是从虾、蟹壳中提取[3],但原料来源受季节和地域的影响,品质难以控制,且提取过程耗碱量大,提取成本较高[4-6]。近年来,国内外关于从真菌中提取壳聚糖的研究已逐渐兴起,与传统生产方式相比,从真菌中提取壳聚糖具有分离工艺简便、原料来源稳定、产品性能优良、成本低等优点,经济效益和社会效益十分明显[7],生产用真菌包括黑曲霉、米根霉、毛霉和犁头霉等[8-10]。
造纸工业的废水治理形势依然严峻。2012年造纸业废水排放量高达34.27亿t,占全国工业废水排放总量的16.9%,CODCr排放量为62.3万t,占全国工业CODCr总排放量的20.5%[11]。原料蒸煮制浆过程中产生的制浆废液占造纸废水的90%[12]。
制浆主要有化学制浆、醇类有机溶剂制浆、有机酸溶剂制浆等方法[13]。制浆废液的主要成分为木素、糖类及蒸煮所用的化学药剂,具有一定的回收利用价值。目前制浆废液的资源化利用研究要集中于木素的回收与利用[14]。制浆废液中木糖含量较高,因此资源化利用方式可参考半纤维素水解液的回收利用工艺,近年来逐渐兴起制浆废液中木糖的回收利用研究,包括结晶制取木糖,或通过发酵生产酒精、木糖醇等产品[15-16],但还存在处理成本高、经济效益低等问题,如某些造纸厂将制浆废液用大量活性炭脱毒后进行结晶制取木糖,但结晶母液中仍有大量木糖残留无法利用,且目前木糖市场趋于饱和,因此经济效益过低。而壳聚糖的市场需求量很大,且壳聚糖平均售价为木糖的数倍至十数倍,因此将制浆废液用于合成壳聚糖具有较高的经济效益。
本实验主要研究了制浆废液脱毒条件和雅致放射毛霉菌体培养及壳聚糖生物合成培养条件对利用制浆废液半纤维素水解液中的木糖生物合成生产壳聚糖的影响,旨在寻找一条制浆废液资源化利用的新途径。
1 材料与方法
1.1 菌种
雅致放射毛霉(ActinomucorelegansTCCC450005),保藏于天津科技大学菌种保藏中心。
1.2 制浆废液与木糖结晶母液
制浆废液取自某造纸厂,pH值为2.0,木糖浓度约10%;木糖结晶母液取自同一造纸厂,该厂将制浆废液经活性炭脱毒处理后进行结晶制取木糖,母液脱水后为固态,木糖浓度约65%。
1.3 培养基的制备
1.3.1 斜面培养基(PDA培养基)
200 g土豆切块煮沸30 min后过滤取滤液,加入葡萄糖20 g,琼脂20 g,定容至1000 mL,pH值不用调节,115℃灭菌20 min。
1.3.2 壳聚糖合成培养基
将木糖结晶母液和脱毒处理后的制浆废液适当稀释(使木糖浓度约为3%),向100 mL稀释液中加入0.2 g MgSO4·7H2O,0.2 g KH2PO4及不同用量的玉米浆(玉米浆用量见2.3),pH值调至7,115℃灭菌20 min。
1.4 实验方法
1.4.1 木糖浓度的测定
本研究采用斐林法测定木糖结晶母液和制浆废液中的木糖含量。
1.4.2 制浆废液脱毒方法
1.4.2.1 Ca(OH)2中和脱毒
在制浆废液中加入粉末状Ca(OH)2调pH值至10,抽滤取滤液,再加入质量分数10%的H2SO4调pH值至7,抽滤取滤液。
1.4.2.2 Ca(OH)2二次脱毒
在中和脱毒得到的上清液中加入粉末状Ca(OH)2调pH值至10,抽滤取滤液,再加入质量分数10%的H2SO4调pH值至7,抽滤取滤液。
1.4.2.3 活性炭脱毒
在二次脱毒得到的滤液中,以1∶20的固液比加入活性炭,置于50℃摇床以120 r/min的转速处理2 h,抽滤取滤液。
1.4.2.4 脱毒条件
采用不同脱毒条件,具体为:①不处理。②Ca(OH)2中和脱毒。③Ca(OH)2二次脱毒。④活性炭脱毒。⑤Ca(OH)2中和脱毒后再进行活性炭脱毒。⑥Ca(OH)2二次脱毒后再进行活性炭脱毒。
1.4.3 菌体培养
1.4.3.1 斜面培养
将雅致放射毛霉接种于PDA培养基,置于恒温培养箱28℃培养3~7天,待斜面上长出大量孢子后取出。
1.4.3.2 壳聚糖生物合成培养
用10 mL无菌生理盐水洗脱孢子,经两层无菌纱布过滤除去菌丝体,将滤液加入装有少量玻璃珠的三角瓶中充分摇匀,即为孢子悬浮液。以血球计数板计数,确定孢子悬浮液浓度,将其适当稀释,使最终孢子浓度为106个/mL。向50 mL壳聚糖合成培养基中接入3 mL孢子悬浮液,置于恒温摇床中在200 r/min的转速下以不同温度分别培养不同时间。
1.4.4 菌丝体收集
将培养液抽滤收集菌丝体,以蒸馏水洗涤菌丝体至滤液澄清,于65℃烘箱中烘干后称量质量。
1.4.5 壳聚糖提取
将烘干后的菌体充分研磨,加入质量分数2%的NaOH溶液(菌体与溶液比为1∶20,W∶V)于100℃处理2 h后离心,得到的不溶物用蒸馏水洗涤至中性。再加入2%醋酸溶液(菌体与溶液比为1∶40,W∶V)于60℃处理3 h后离心,往上清液中缓慢加入质量分数40%的NaOH溶液至pH值为9,待出现大量白色絮状沉淀,静置后离心。将沉淀物用蒸馏水洗涤至中性,离心收集沉淀物。于50℃烘箱烘干,即为壳聚糖粗品。将壳聚糖粗品用95%乙醇洗涤3次,再用丙酮洗涤2次,于50℃烘箱烘干,即为壳聚糖纯品[17]。
2 结果与讨论
2.1 脱毒条件对菌丝体浓度及壳聚糖产量的影响
以不同脱毒条件(见1.4.2.4)对制浆废液进行脱毒处理,测定处理后废液中的木糖浓度。将脱毒处理后的废液进行适当稀释,使木糖浓度约为3%,向100 mL稀释液中加入6 mL玉米浆(即用量为6%,玉米浆干物质含量约为47%,以下同)、0.2 g MgSO4·7H2O、0.2 g KH2PO4,pH值调至7,接种量6%,装液量为50 mL/250 mL,在30℃、200 r/min条件下培养60 h后测定菌体的菌丝体浓度和壳聚糖产量,结果见表1。

表1 脱毒条件对菌丝体浓度及壳聚糖产量的影响
从表1可以看出,菌体在未经处理的制浆废液中几乎无法生长。经Ca(OH)2中和脱毒后,由于菌体生长抑制物的去除,菌丝体浓度明显上升。Ca(OH)2二次脱毒后菌丝体浓度反而有所下降,可能是因为二次脱毒使制浆废液中的木糖浓度明显下降,导致菌丝体浓度低于一次脱毒。仅使用活性炭进行脱毒处理的效果比Ca(OH)2中和脱毒差。各脱毒条件中,使用Ca(OH)2中和脱毒后再进行活性炭脱毒的效果最好。
2.2 氮源对菌丝体浓度和壳聚糖产量的影响
脱毒处理后的废液经适当稀释,使木糖浓度约为3%,分别向100 mL稀释液中加入2 g蛋白胨、酵母粉、牛肉膏、玉米浆,以及0.58 g NaNO3和0.73 g NH4NO3作为氮源(无机氮源的量以含氮量与有机氮源相同为准),培养基其他成分及培养条件不变,培养60 h后测定菌丝体浓度和壳聚糖产量,结果见表2。
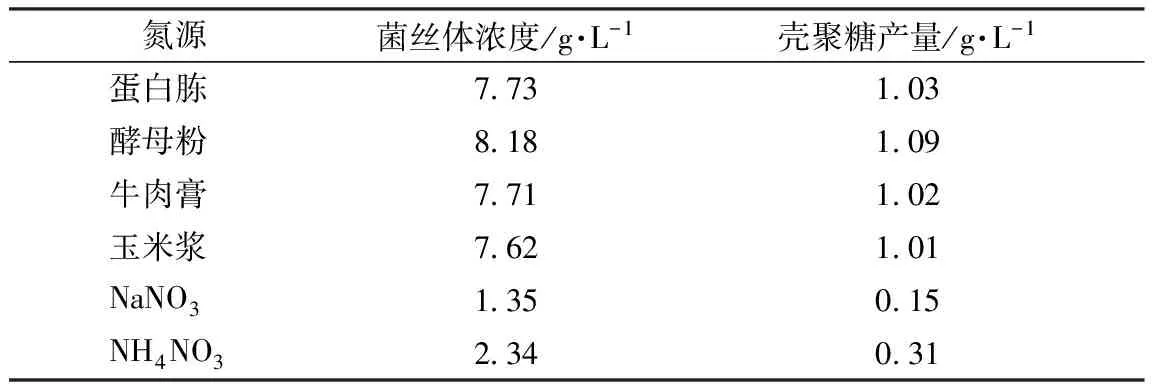
表2 氮源对菌丝体浓度和壳聚糖产量的影响
由表2可知,雅致放射毛霉对有机氮源的利用效率要远高于无机氮源。4种有机氮源中酵母粉效果最好,玉米浆效果最差,但差距并不十分明显,出于成本考虑,以玉米浆为氮源为宜。
2.3 玉米浆用量对菌丝体浓度和壳聚糖产量的影响
以不同用量的玉米浆为氮源,培养基其他成分及培养条件不变,培养60 h后测定菌丝体浓度和壳聚糖产量,结果见图1。
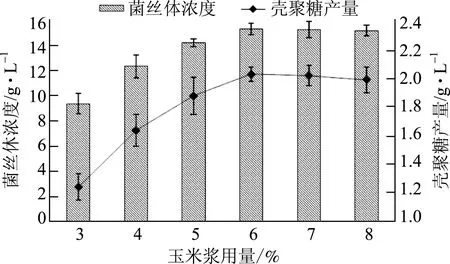
图1 玉米浆用量对菌丝体浓度和壳聚糖产量的影响
由图1可知,随着玉米浆用量的提高,菌丝体浓度和壳聚糖产量也随之上升。当玉米浆用量超过6%后,由于底物抑制,菌丝体浓度和壳聚糖产量有所下降。由此确定最佳玉米浆用量为6%,此时菌丝体浓度为15.21 g/L,壳聚糖产量为2.02 g/L。
2.4 碳源种类及木糖浓度对菌丝体浓度及壳聚糖产量的影响
分别以不同浓度的木糖结晶母液和脱毒处理后的制浆废液为碳源(浓度以等效木糖浓度表示),培养基其他成分和培养条件不变,培养60 h后测定菌丝体浓度和壳聚糖产量,结果见图2。

图2 碳源种类及木糖浓度对菌丝体浓度及壳聚糖产量的影响
由图2可知,当木糖浓度低于3%时,菌丝体浓度及壳聚糖产量随着木糖浓度增加而增大;当木糖浓度超过3%后,由于底物抑制作用,菌丝体浓度及壳聚糖产量逐渐下降。因此最佳木糖浓度为3%,此时以脱毒后的制浆废液为碳源的菌丝体浓度为15.21 g/L,壳聚糖产量为2.01 g/L。
此外,木糖结晶母液与脱毒后的制浆废液均可作为碳源,当木糖浓度为2%~5%时,以脱毒后制浆废液为碳源的菌丝体浓度和壳聚糖产量高于以木糖结晶母液为碳源的菌丝体浓度和壳聚糖产量。这可能是因为造纸厂在进行木糖结晶前使用了大量活性炭对制浆废液进行脱毒处理,使一些菌体生长因子和刺激物也一同被去除,从而导致了菌体生长量的下降。因此,较优的碳源为脱毒后的制浆废液。
2.5 温度对菌丝体浓度和壳聚糖产量的影响
选取不同的培养温度,培养基成分及其他培养条件不变,培养60 h后测定菌丝体浓度和壳聚糖产量,结果见图3。
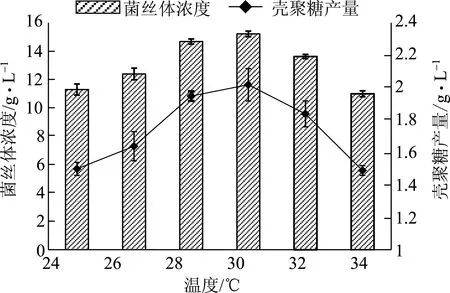
图3 温度对菌丝体浓度和壳聚糖产量的影响
由图3可知,温度对菌丝体浓度和壳聚糖产量的影响较大。在28~30℃的温度范围内,菌体生长最为旺盛,因此壳聚糖产量也最高。当温度继续升高,超出菌体的最适生长温度范围时,菌丝体浓度和壳聚糖产量急剧下降。由此确定最佳培养温度为30℃。
2.6 培养时间对菌丝体浓度和壳聚糖产量的影响
在相同培养基成分与培养条件下,培养不同时间后,测定菌丝体浓度和壳聚糖产量,结果见图4。
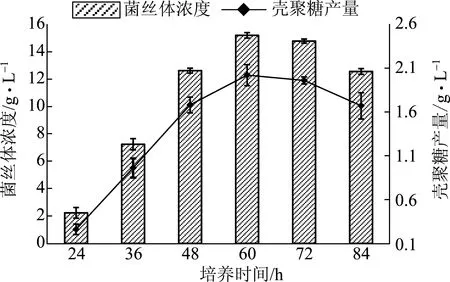
图4 培养时间对菌丝体浓度和壳聚糖产量的影响
由图4可知,在24~60 h时,菌体快速生长繁殖,壳聚糖也随之大量累积。当培养时间超过60 h后,菌体开始衰老自溶,细胞壁破碎,因此壳聚糖产量有所下降。由此确定最佳培养时间为60 h,此时菌丝体浓度可达15.20 g/L,壳聚糖产量为2.02 g/L。
3 结 论
实验研究了利用制浆废液中的半纤维素水解液中的木糖生物合成壳聚糖的脱毒和培养条件。
3.1 本实验采用的各种脱毒条件中,使用Ca(OH)2中和脱毒后再进行活性炭脱毒的效果最好。具体脱毒条件为:先加入Ca(OH)2调pH值至10,抽滤后再加入质量分数10%的H2SO4调pH值至7,再次抽滤后以1∶20的固液比加入活性炭,置于50℃摇床以120 r/min的转速处理2 h,抽滤后取上清液。
3.2 利用制浆废液半纤维素水解液中木糖生物合成壳聚糖的最优条件为:将脱毒后的制浆废液进行适当稀释,使木糖浓度约为3%,向稀释液中加入玉米浆6 mL、0.2 g MgSO4·7H2O、0.2 g KH2PO4,初始pH值调至7,装液量为50 mL/250 mL,在温度30℃,转速200 r/min条件下培养60 h,此时,壳聚糖菌丝体浓度可达15.20 g/L,壳聚糖产量可达2.02 g/L。
3.3 木糖结晶母液和脱毒处理后的制浆废液均可作为雅致放射毛霉(Actinomucorelegans)生物合成制备壳聚糖的碳源,但以脱毒处理后的制浆废液为碳源较优。
[1] QIAO De-liang. The Preparation of Chitooligosaccharide and Its Application in Functional Food[J]. Scienceand Technology of Food Industry, 2007, 28(4): 228. 乔德亮. 低聚壳聚糖制备及其在功能食品中应用[J]. 食品工业科技, 2007, 28(4): 228.
[2] YANG Xin-chao, ZHAO Xiang-ying, LIU Jian-jun. Research Advance of Recovering Chitosanfrom Mycelium[J]. Food Research and Development, 2006, 27(2): 179. 杨新超, 赵祥颖, 刘建军. 从菌丝体中提取壳聚糖的研究进展[J]. 食品研究与开发, 2006, 27(2): 179.
[3] Chatterjee S, Adhya M, Guha A K, et al. Chitosan from Mucorrouxii: production and physic-chemical characterization[J]. Process Biochemistry, 2005, 40(1): 395.
[4] ZENG Zhe-ling, FAN Lei, YIN Pei-min, et al. Preliminary Study on Chitosan Extraction from Rhizopusoryzae[J]. China Brewing, 2008 (20): 16. 曾哲灵, 范 镭, 印培民, 等. 从米根霉中提取壳聚糖的初步研究[J]. 中国酿造, 2008 (20): 16.
[5] LOU Yong-jiang. Study on Abstracting Chitosan from the WasteAspergillusNigerMycilium of Citric Acid Production Plant[J]. Journal of Zhejiang Ocean University(Nature Science), 1999, 18(2): 129. 娄永江. 从柠檬酸厂废菌丝体中提取壳聚糖的研究[J]. 浙江海洋学院学报(自然科学版), 1999, 18(2): 129.
[6] CHEN Xue-mei, XIAO Wen-sheng, DENG Xiang-yi, et al. Research on Extracting Chitosan formAsp.Niger[J]. Chemistry & Bioengineering, 2005 (8): 43. 陈雪梅, 肖文胜, 邓祥义, 等. 从柠檬酸厂废黑曲霉菌丝体中提取壳聚糖的工艺研究[J]. 化学与生物工程, 2005 (8): 43.
[7] DING Yun-qiao, CHU Chun, LI Zhen-e. The Internal Situation of Chitin/Chitosan Extractededfrom Filar Fungus[J]. Shandong Chemical Industry, 2002 (31): 8. 丁云桥, 初 春, 李振娥. 国内从丝状真菌中提取甲壳素/壳聚糖研究状况[J]. 山东化工, 2002 (31): 8.
[8] WU Jian-guo, LIU Qing-bin, GAN Guang-dong. Development Situation of the Production of Chitosan by Fermentation[J]. Biotechnology, 2008, 18(4): 93. 吴建国, 刘清斌, 甘广东. 发酵法生产壳聚糖的研究现状[J]. 生物技术, 2008, 18(4): 93.
[9] Kishore D. Rane, Dallas G Hoover. An evaluation of alkali and acid treatments for chitosanextraction from fungi[J]. Process Biochemistry, 1993, 28(2): 115.
[10] Tai C, Li S, Xu Q, et al. Chitosan production from hemicellulose hydrolysate of corn straw: impact of degradation products onRhizopusoryzaegrowth and chitosan fermentation[J]. Applied Microbiology, 2010, 51(3): 278.
[11] CAO Chun-yu. Investigation of Pollutant Load of Different Pulping Effluent of the Main Fiber Raw Materials in China[J]. China Pulp & Paper, 2009, 28(2): 73. 曹春昱. 我国主要纤维原料制浆废水污染负荷研究分析[J]. 中国造纸, 2009, 28(2): 73.
[12] ZHAO Yu-nan. Characteristics and Treatment of Pulping & Papermaking Effluent[J]. China Pulp & Paper, 2010, 29(9): 41. 赵宇男. 制浆造纸废水特性及处理的相关问题[J]. 中国造纸, 2010, 29(9): 41.
[13] LIANG Jun-feng, LIU Zong-yu. Papermaking Methods Overview[J]. Hubei Paper Making, 2011 (1): 6. 梁军风, 刘宗瑜. 制浆方法概述[J]. 湖北造纸, 2011 (1): 6.
[14] YI Shou-zhi, SHI Shu-lan, LI Cui-zhen. Latest Progress of Lignin Separation from Kraft Pulping Black Liguor and Its Application[J]. World Pulp and Paper, 2001, 20(6): 56. 衣守志, 石淑兰, 李翠珍. 制浆废液中木质素的分离与利用新进展[J]. 国际造纸, 2001, 20(6): 56.
[15] ZHAO Jing, XIA Li-ming. Ethanol Production from Hemicellulosic Hydrolysate by a Recombinant Yeast[J]. Journal of Chemical Engineering of Chinese Universities, 2010, 24(2): 247. 赵 晶, 夏黎明. 重组酵母发酵半纤维素水解液生产酒精的研究[J]. 高校化学工程学报, 2010, 24(2): 247.
[16] WANG Xu, SU Gui-feng. Xylitol Productionfrom Corn Cob HydrolysatebyCandidatropicalis[J]. China Brewing, 2009, 6: 42. 王 旭, 苏桂峰. 假丝酵母发酵玉米芯半纤维素水解液生产木糖醇[J]. 中国酿造, 2009, 6: 42.

(责任编辑:董凤霞)
Biosynthesis of Chitosan Using Xylose from Hemicellulose Hydrolysate
LIN Guang-xiu*ZHAO Hua LIU Pan CHE Li-wei
(Key Lab of Industrial Microbial Fermentation of Ministry of Education, College of Biotechnology,TianjinUniversityofScience&Technology,Tianjin, 300457)
The detoxification technology and culture conditions of biosynthesis of chitosan using xylose from hemicelluloses hydrolysate such as pulping waste liquor were investigated. The detoxification technology was as follows: pH was adjusted to 10 with Ca(OH)2at first then adjusted back to 7 with 10% H2SO4after suction filtration, then activated carbon was added in a ratio of 1∶20(W∶V) after the second suction filtration, finally it was put on a rocking table at the tempreture of 50℃ and the rotating speed of 120 r/min for 2 hours, the supernatant after the final suction filtration was collected for cultivation. The culture conditions included that using 6% of corn milk as nitrogen source and properly diluted detoxicated pulping waste liquor (which contains 3% of xylose) as carbon source.Actinomucorelegans(TCCC450005) was cultured in this medium at 30℃ for 60 hours. The mycelia concentration was 15.20 g/L and the chitasan yield was 2.02 g/L.
chitosan; hemicellulose; pulping effluent; detoxification;Actinomucorelegans
林广修先生,在读硕士研究生;主要研究方向:纤维原料的综合利用工艺。
2014- 12- 10(修改稿)
X793
A
0254- 508X(2015)05- 0032- 05
