冠心病合并2 型糖尿病患者冠状动脉病变特征分析
2015-01-16童随阳
王 欣 夏 豪 童随阳 李 磊
国内外许多前瞻性及回顾性流行病学资料均表明,糖尿病与冠状动脉疾病的发生关系密切[1]。著名的Framingham 调查资料显示,男性糖尿病患者冠状动脉粥样硬化性心脏病的发生率增加1 倍,女性增加2 倍,而且起病年龄早、病情进展快、女性高于男性、无痛性心肌缺血、心肌梗死常见[2]。目前公认糖尿病是冠心病发病重要的独立危险因素之一,不可忽视的是约有70%的糖尿病患者死于心血管病变的各种并发症[3,4]。笔者从患者的临床资料、冠状动脉病变程度、部位初步探讨冠心病合并糖尿病患者的临床特征,为进一步明确二者之间的关系提供临床依据。
资料与方法
1.研究对象:选取武汉大学人民医院2012 年6 月~2014年2 月初次诊断为冠心病的患者213 例,排除存在冠状动脉造影禁忌证、既往有明确心肌梗死史、既往曾接受冠状动脉介入治疗和冠状动脉搭桥的患者。
2.研究方法:记录入选患者的一般资料,包括年龄、性别、高血压病、糖尿病、高脂血症、吸烟、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、WBC、服用药物情况等。高血压病[收缩压≥140 mmHg 和(或)舒张压≥90mmHg 或正在服用降压药物治疗]、糖尿病史(符合1999 年WHO 糖尿病诊断标准或正在使用降糖药物)、高脂血症史(根据2007 年中国成人血脂异常防治指南)、吸烟史(1984 年WHO 标准,每日1 支以上持续至少1年)均通过采集病史确定[5]。所有入选对象隔夜禁食12 h,采用真空抗凝采血管采集静脉血。血常规、生化指标在笔者医院检验科检测。所有研究对象住院期间均行冠状动脉造影检查,采用Judkins 法,常规左冠脉投射6 个体位,右冠脉投射2个体位,少数患者根据病变情况增加投射体位以清楚显示冠状动脉病变情况。造影结果由2 ~3 名心内科专业医生判定,各投射体位中最大狭窄程度作为病变狭窄程度。根据冠状动脉狭窄直径≥50%累及左前降支(LAD)、左回旋支(LCX)、右冠状动脉(RCA)或左主干(LM)分为单支、双支(累及左主干为双支病变)及3 支病变[6]。
3.统计学方法:采用SPSS 17.0 版统计软件,计量资料采用均数±标准差(±s)表示,组间比较采用两独立样本t 检验,计数资料采用率表示,组间比较用χ2检验,以P <0.05 为差异有统计学意义。
结 果
1.2 型糖尿病组与非糖尿病组临床资料比较:入选符合标准的研究对象213 例,冠心病合并2 型糖尿病患者90 例,未合并糖尿病患者123 例。两组患者在性别、年龄、高血压病、高脂血症、吸烟史、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL)、低密度脂蛋白胆固醇(LDL)方面比较,差异均无统计学意义(P >0.05)。冠心病合并2 型糖尿病组患者空腹血糖(FPG)比非糖尿病组明显升高(8. 45 ±0.40mmol/L vs 5.61 ±0.13mmol/L),差异有统计学意义(P=0.000,表1)。

表1 2 型糖尿病与非糖尿病组患者临床资料比较
2.2 型糖尿病组与非糖尿病组冠状动脉病变程度分析:与非糖尿病组相比,2 型糖尿病组患者冠状动脉3 支病变发生率更高(50.00% vs 8.94%,P =0.000),有统计学意义。单支病变、两支/左主干病变发生率低于非糖尿病组(24. 4% vs 48. 8%,P =0.000;25.6% vs 42.3%,P =0.000),差异有统计学意义(表2)。
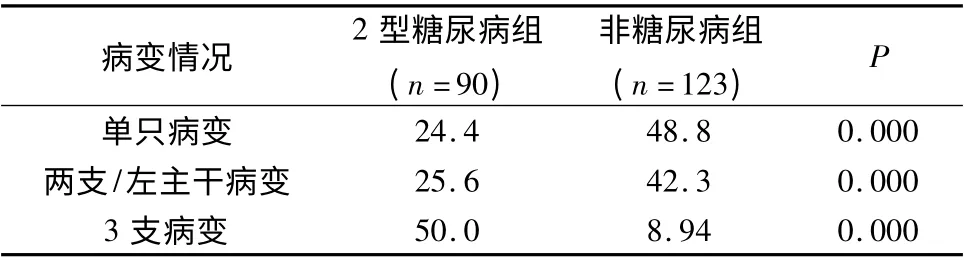
表2 2 型糖尿病组与非糖尿病组冠状动脉病变情况比较(%)
3.2 型糖尿病组与非糖尿病组冠状动脉病变部位分析:与非糖尿病组相比,2 型糖尿病组患者冠状动脉病变部位更多累及前降支(92.2% vs 82.1%,P=0.034),左回旋支(68.9% vs 39.8%,P =0.000),右冠状动脉(64.4% vs 39.0%,P =0.000),均有统计学意义。两组患者冠状动脉左主干病变并无统计学意义(7.8% vs 2.4%,P=0.100,表3)。
讨 论
1979 年Ledet 首先提出糖尿病心脏病的概念,可单独或联合表现在心肌、心脏微血管和大血管等部位[7]。与糖尿病有关的血管病变可为非特异性(动脉粥样硬化和动脉硬化)或特异性(微血管或小动脉内膜增生性改变),前者主要累及大血管(特别是下肢)、心脏和老年患者的大脑,而后者主要局限于小血管,可能在各年龄段的患者中均可发现[8]。糖尿病合并冠心病患者其动脉粥样硬化常严重,病变范围广,多累及冠脉3 支大血管[9]。
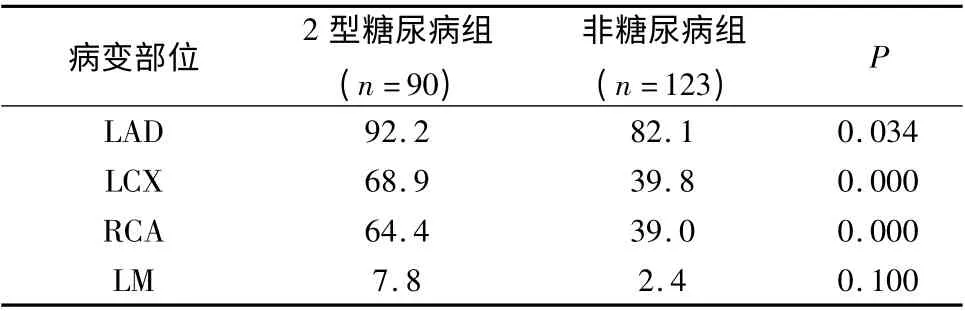
表3 2 型糖尿病组与非糖尿病组冠状动脉病变部位比较(%)
本研究提示冠心病合并2 型糖尿病患者与未合并糖尿病患者相比,性别、年龄、总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇并无统计学意义,这与许多研究不甚一致。一般认为冠心病合并2 型糖尿病患者女性居多,发病年龄更早,甘油三酯、低密度脂蛋白胆固醇更高、高密度脂蛋白胆固醇更低。可能的解释是笔者选取的研究对象样本量太小、两组患者在服用他汀类调脂药上没有差别所导致两组在性别、年龄、血脂上并无统计学意义。
本研究发现2 型糖尿病患者与非糖尿病患者相比,3 支病变更常见,这与许多研究一致[10~12]。冠心病合并2 型糖尿病患者与未合并糖尿病患者冠脉病变相比更多累及LAD、LCX、RCA,而其自身累及部位并无特异性,3 支冠脉均可累及。这表明2 型糖尿病对冠心病患者冠脉损害程度远比未合并糖尿病的患者广泛、而且严重。可能的解释是合并2 型糖尿病的冠心病患者临床症状常不典型,无症状型心肌缺血较常见,冠脉侧支循环较充分,导致患者常常延误就诊。笔者所研究的对象均是首次经冠状动脉造影检查诊断为冠心病的患者,这样就出现前者冠脉病变范围和程度要较后者广泛、严重的结果。
糖尿病患者易伴发冠心病,其发病机制复杂,目前认为可能与以下因素有关[13~17]:(1)血小板功能、纤溶功能障碍致血液流变学紊乱:糖尿病患者聚集能力增强,存活时间缩短,血小板在损伤的血管壁处聚集并释放其内容物,如血栓素可增加局部血小板聚集,释放丙二醛可修饰局部低密度脂蛋白,增加其被摄取。因此患者有高凝倾向,易于发生血栓。(2)高血糖对动脉内皮细胞的影响:高血糖、高血压可损伤血管内皮细胞,内皮细胞功能改变,血小板聚集、黏附增加。(3)糖尿病对平滑肌细胞的影响:平滑肌细胞的移行和增殖受血小板内含有的多种生长因子的影响,它们刺激内皮细胞、平滑肌细胞或成纤维细胞的复制、糖尿病血清生长因子较胰岛素或者其他生长因子有更强的刺激平滑肌细胞生长和增殖的作用。(4)糖尿病对血管壁脂质沉积的影响:未控制的糖尿病患者有低密度脂蛋白胆固醇(LDL)及极低密度脂蛋白胆固醇(VLDL)的增高,非胰岛素依赖型糖尿病(NIDDM)患者高密度脂蛋白减低,部分患者有载脂蛋白B(apoB)及载脂蛋白E(apoE)增高,这些增高的脂蛋白通过损伤血管内皮细胞,穿透内皮,沉积于内膜下,形成粥样斑块,导致冠状动脉粥样硬化的形成。(5)高胰岛素血症对动脉粥样硬化的影响:高胰岛素致动脉粥样硬化的机制尚不清楚,不少研究者认为NIDDM 患者的高胰岛素血症与胰岛素抵抗有关,胰岛素抵抗常同时存在糖、脂质代谢紊乱可能是NIDDM 患者易患冠心病的原因[18]。
本研究也存在一些局限性。首先笔者在分析2型糖尿病对冠心病的影响时未将2 型糖尿病病程纳入研究范围内;其次本研究也存在样本量不足、研究对象选取上存在偏倚、研究方法是一项回顾性研究,导致研究的科学性、严谨性表前瞻性研究差。总的来说,2 型糖尿病和冠心病的关系密切冠心病合并2 型糖尿病的患者发病年龄早,进展快,临床过程隐匿,预后差。2 型糖尿病导致冠心病发病机制复杂,许多分子机制尚未明确,有待进一步研究[19,20]。本研究初步明确冠心病合并2 型糖尿病患者冠状动脉病变广泛、严重,提示要重视对患者血糖的管理,延缓冠状动脉病变进展,提高患者的生存质量和生存时间。
1 King SB,Kosinski AS,Guyton RA,et al. Eight -year mortality in the Emory Angioplasty versus Surgery Trial (EAST)[J]. Am Coll Cardiol,2000,35(2):1116 -1121
2 Fujihara K,Suzuki H,Sato A,et al.Comparison of the Framingham risk score,UK Prospective Diabetes Study (UKPDS)risk engine,Japanese atherosclerosis longitudinal study - existing cohorts combine(JALS - ECC)and maximum carotid intima - media thickness for predicting coronary artery stenosis in patients with asymptomatic type 2 diabetes[J].Atheroscler Thromb,2014,8(3):113 -119
3 Rodriguez AE,Baldi J,Fernández Pereira C,et al. Five -year follow -up of the Argentine randomized trial of coronary angioplasty with stenting versus coronary bypass surgery in patients with multiple vessel disease (ERACI II)[J].Am Coll Cardiol,2005,46(6):582 -588
4 Chatzizisis YS,Baker AB,Sukhova GK,et al. Augmented expression and activity of extracellular matrix - degrading enzymes in regions of low endothelial shear stress colocalize with coronary atheromata with thin fibrous caps in pigs[J].Circulation,2011,123(6):621 -630
5 Stone P,Saito S,Takahashi S,et al. Prediction of progression of coronary artery disease and clinical outcomes using vascular profiling of endothelial shear stress and arterial plaque characteristics. The PREDICTION study[J]. Circulation,2012,126(2):172 -181
6 Patel D,Hamamdzic D,Llano R,et al. Subsequent development of fibroatheromas with inflamed caps can be predicted by intracoronary near-IR spectroscopy[J]. Arteriosclerosis Thrombosis and Vascular Biology,2013,33(2):346 -353
7 Weintraub WS,Stein B,Kosinski A,et al. Outcome of coronary bypass surgery versus coronary angioplasty in diabetic patients with multivessel coronary artery disease[J]Am Coll Cardiol,2008,31(1):10 -19
8 Banning AP,Westaby S,Morice MC,et al. Diabetic and nondiabetic patients with left main and/or 3 -vessel coronary artery disease:comparison of outcomes with cardiac surgery and paclitaxel-eluting stents[J].Am Coll Cardiol,2010,55(7):1067 -1075
9 Yamagata K,Kataoka Y,Kokubu N,et al. A 3 -year clinical outcome after percutaneouscoronary intervention using sirolimus -eluting stent and off-pump coronary artery bypass grafting for the treatment of diabetic patients with multivessel disease[J]. Circulation,2010,74(4):671 -678
10 Daemen J,Boersma E,Flather M,et al. Long-term safety and efficacy of percutaneous coronary intervention with stenting and coronary artery bypass surgery for multivessel coronary artery disease:a metaanalysis with 5 -year patient -level data from the ARTS,ERACI -Ⅱ,MASS - Ⅱ,and SoS trials[J]. Circulation,2008,118(4):1146 -1154
11 Stein EA,Mellis S,Yancopoulos GD,et al. Effect of a monoclonal antibody to PCSK9 on LDL cholesterol[J].The New England Journal of Medicine,2012,366(12):1108 -1118
12 Swindle MM. Swine in the laboratory:surgery,anesthesia,imaging,and experimental techniques[M].USA:CRC Press,2007:123 -128
13 Dyson MC,Alloosh M,Vuchetich JP,et al. Components of metabolic syndrome and coronary artery disease in female Ossabaw swine fed excess atherogenic diet[J]. Comparative Medicine,2006,56(1):35 -45
14 Kreutz RP,Alloosh M,Mansour K,et al. Morbid obesity and metabolic syndrome in Ossabaw miniature swine are associated with increased platelet reactivity[J]. Diabetes Metabolic Syndrome and Obesity,2011,4(3):99 -105
15 Zhang L,Zalewski A,Liu Y,et al. Diabetes - induced oxidative stress and low -grade inflammation in porcine coronary arteries[J].Circulation,2003,108(4):472 -478
16 Kumada M,Kihara S,Sumitsuji S,et al.Osaka CADSGCad Association of hypoadiponectinemia with coronary artery disease in men[J].Arterioscler Thromb Vasc Biol,2003,23(9):85 -89
17 Lee S,Park Y,Dellsperger KC,et al. Exercise training improves endothelial function via adiponectin -dependent and independent pathways in type 2 diabetic mice[J]. Am Physiol Heart Circ Physiol,2011,301(8):306 -314
18 Li R,Xu M,Wang X,et al. Reduced vascular responsiveness to adiponectin in hyperlipidemic rats - mechanisms and significance[J].Mol Cell Cardiol,2010,49(23):508 -515
19 Lyzogubov VV,Tytarenko RG,Bora NS,et al. Inhibitory role of adiponectin peptide I on rat choroidal neovascularization[J]. Biochim Biophys Acta,2012,1823(4):1264 -1272
20 Maeda N,Shimomura I,Kishida K,et al. Diet -induced insulin resistance in mice lacking adiponectin/ACRP30[J]. Nat Med,2002,8(4):731 -737
