菊杞保肝胶囊对大鼠亚急性酒精性肝损伤的保护作用及其机理
2015-01-16杜丽萍郝旭亮岳永花
杜丽萍, 康 永, 郝旭亮, 刘 聪, 岳永花
(山西省中医药研究院,山西太原030012)
[科研报道]
菊杞保肝胶囊对大鼠亚急性酒精性肝损伤的保护作用及其机理
杜丽萍, 康 永, 郝旭亮, 刘 聪, 岳永花*
(山西省中医药研究院,山西太原030012)
目的观察菊杞保肝胶囊对大鼠亚急性酒精性肝损伤的防治作用及作用机理。方法取SPF清洁级SD大鼠60只,随机分为6组,分别为空白组、模型组、对照药 (葵花护肝片)组、菊杞保肝胶囊低、中、高剂量 (0.23、0.46、0.92 kg/g)组,建立大鼠亚急性酒精性肝损伤模型,菊杞保肝胶囊各组及对照药水溶液灌胃,给药30 d后,检测大鼠血清中胆固醇 (CHO)、甘油三酯 (TG)、低密度脂蛋白胆固醇 (LDL-C)、高密度脂蛋白胆固醇 (HDL-C)、胆红素 (TBIL)、丙氨酸氨基转移酶 (ALT)、天门冬氨酸氨基转移酶 (AST)及超氧化物歧化酶 (SOD)活性和丙二醛(MDA)水平;ELISA检测血清中肿瘤坏死因子(TNF-α)、前列腺素E2(PGE2)、白介素-6(IL-6)的水平;RTPCR检测COX-2 mRNA的表达及肝组织病理观察。结果与模型组比较,菊杞保肝胶囊各剂量组大鼠血清中CHO、TG、LDL-C、ALT、AST、PGE2、TNF-α、IL-6水平降低,COX-2表达下调,HDL-C水平升高(P<0.05或P<0.01),并可显著升高中、高剂量组大鼠血清中SOD活性,降低MDA水平 (P<0.05或P<0.01)。病理结果显示菊杞保肝胶囊各剂量能改善模型大鼠的肝脏组织病理损伤。结论菊杞保肝胶囊对大鼠亚急性酒精性肝损伤具有保护作用,其作用机理可能与降低血清中PGE2,TNF-α及IL-6量及下调肝组织COX-2的表达及抗氧化应激有关。
菊杞保肝胶囊;亚急性酒精性肝损伤;大鼠;血脂;肝功
目前我国由大量酗酒所致的肝损伤呈逐年上升趋势,为仅次于病毒性肝炎的第二大肝病[1]。酒精性肝损伤是以肝脏脂肪变性、炎性细胞浸润,甚至纤维化为特征的一种长期慢性中毒性肝脏疾病[2],其主要临床特征是恶心呕吐、黄疸、肝脏肿大和压痛,进一步可并发肝功能衰竭和上消化道出血等[3]。菊杞保肝胶囊为我院的临床经验方,由泽泻、葛根、菊花、枸杞子等药材组成,在治疗酒精性肝病效果显著,毒副作用少,且低成本、高效率、具有开发价值。本实验就菊杞保肝胶囊对亚急性酒精性肝损伤大鼠的保肝作用进行研究探讨。
1 实验材料
1.1 实验动物 60只健康SD大鼠,雌性未孕,体质量(220±20)g,购于北京华阜康生物科技股份有限公司,许可证号SCXK(京)2009-0004。清洁恒温环境,饲料由医科院动物研究所提供,适应性喂养1周开始实验。
1.2 实验仪器 科大创新股份有限公司KDC-2046低速冷冻离心机;北京普析通用仪器有限责任公司TU-1901双光束紫外可见分光光度计;日本三洋公司医用冷冻冰箱;美国BioTeK公司全自动酶标仪,多功能微孔读板仪;LEICA RM2125石蜡切片机;日本Olympus PM.10AD光学显微镜;日本株式会社尼康Nikon尼康光镜显微照相机;美国Agilent StratagenePCR仪;全自动生化分析仪OLYMPUS-AU640。
1.3 试剂和材料 菊杞保肝胶囊为自制,批号130705。由菊花、枸杞子、丹参、山楂、黄精、葛根等十味药材组成。加水煎煮2次,每次1 h,合并滤液,浓缩,干燥,得到干膏,出膏率31.56%,干膏为棕褐色,气微辛、味苦。大鼠每日给药量5.1 g/kg(相当于生药量15 g)。52%二锅头(北京二锅头酒业股份有限公司,批号043005)。葵花护肝片 (黑龙江葵花药业股份有限公司,批号201309004)。CHO、TG、HDL-C、LDL-C试剂盒均购自北京北化康泰临床试剂有限公司,批号分别为:20130115、20130112、20130717、20130401。总胆红素测试盒、MDA测试盒、SOD测试盒,均购自南京建成生物工程研究所,批号分别为20130816、20130911、20130916。PGE2、TNF-α、IL-6试剂盒购自上海西唐生物科技有限公司,批号分别为1310283、1310318、130325。RT-PCR试剂盒购自上海生工公司;引物由上海生工生物工程有限公司合成。
2 方法
2.1 动物模型建立 50只SD大鼠,每天灌胃给予52%二锅头10mL/kg,每天1次,连续4周,复制亚急性酒精性肝损伤大鼠模型[4]。
2.2 动物分组与给药 (受试药物灌胃后间隔2 h以上再给予52%二锅头) 将50只SD大鼠随机分为5组即模型组、阳性对照组 (葵花护肝片,0.525 g/kg),菊杞保肝胶囊低剂量组(0.23 g/kg)、中剂量组(0.46 g/kg)、高剂量组 (0.92 g/kg),每组10只。另取10只大鼠为空白组。各组大鼠分别灌胃给予上述剂量的受试药物;空白组和模型组给予相同剂量的蒸馏水。给药体积为1 mL/100 g,连续30 d,每周称定体质量一次,调整给药剂量。
2.3 指标检测及方法
2.3.1 一般情况观察 观察实验过程中各组动物的一般情况,包括精神、活动状况、饮食、排便、皮毛等,每周测1次体质量,观察大鼠的体质量变化情况。末次给药后8 h,称体质量,10%水合氯醛 (0.3 mL/100 g)麻醉,腹主动脉取血,3 000 r/min离心,15 min,取上清液制备血清,-20℃保存待检;分离肝脏组织,称定,左叶置于10%福尔马林中固定,右叶迅速放置于液氮中冷冻保存。
2.3.2 肝脏指数 肝脏指数(%)=肝脏质量 (g)/体质量 (g)×100%。
2.3.3 指标检测方法 检测大鼠血脂、肝功及血清中SOD、MDA的水平,总胆红素 (TBIL)、血清胆固醇(CHO)、血清低密度脂蛋白胆固醇(LDL-C)、血清高密度脂蛋白胆固醇(HDL-C)、甘油三酯 (TG)检测均按试剂盒说明书进行检测;采用全自动生化分析仪检测大鼠血清中丙氨酸氨基转移酶 (ALT)、天门冬氨酸氨基转移酶(AST);化学比色法检测大鼠血清中丙二醛 (MDA)、超氧化物歧化酶 (SOD)的水平。
2.3.4 血清PGE2,TNF-α及IL-6的测定 采用酶联免疫吸附试验 (ELISA)法测定,按试剂盒说明书进行。
2.3.5 COX-2 mRNA的表达 实时荧光定量PCR检测环氧-2(COX-2)mRNA的表达,用TRIZOL法提取总RNA,在紫外分光光度计中测OD260、OD280值,计算RNA浓度和含量,OD260/OD280在1.8~2.0,RNA的纯度符合实验要求;检测RNA的完整性后采用逆转录系统试剂盒将总RNA逆转录为cDNA;特异性引物分别扩增COX-2、β-actin。引物序列(5cy3c):COX-2正向引物为CTG TAT CCC GCC CTG CTG GT;反向引物为GAG GCA CTTGCG TTG ATG GT[5]。产物210 bp。β-actin(内参照)正向引物为GATGGTGGG TATGGG TCA GAA;反向引物为CTA GGA GCC AGG GCA GTA ATC,产物332 bp(均由上海生工公司合成)。反应条件:94℃预变性3 min,然后按94℃,30 s,50℃,30 s,72℃,1 min进行28个循环,最后72℃延伸10 min。PCR产物在琼脂糖凝胶上电泳,溴化乙锭(EB)染色,凝胶成像仪照相记录。用Quantity One 4.0图像分析软件分析。
2.3.6 肝脏组织病理学检查 用10%福尔马林液中固定肝组织标本,48 h后常规脱水、透明、浸蜡、包埋、切片、HE染色、脱水、透明、封片,光学显微镜下观察。
2.4 统计学处理 所有实验数据以均值±标准差 (x±s)表示,采用SPSS 13.0统计软件进行数据处理,组间比较采用方差分析及LSD-t检验,P<0.05为差异有统计学意义。
3 实验结果
3.1 一般情况 实验期间,模型组有2只大鼠、葵花护肝片组1只大鼠、菊杞保肝胶囊中剂量组1只大鼠酒精灌胃误入气管死亡,其余全部存活。模型组与空白组比较其皮毛无光泽,有脱毛现象,体质量减轻,嗜睡,且反应迟钝,个别大鼠有被咬伤。中低剂量组相对模型组大鼠,偶有脱毛,进食增多,活动相对较多,食欲和整体状态较好。高剂量组与空白组对比状态相近,无死伤。
3.2 菊杞保肝胶囊对各组大鼠体质量和肝脏指数的影响
与空白组相比,模型组大鼠体质量无明显变化 (P>0.05),但肝脏指数增加 (P<0.05),与模型组相比,菊杞保肝胶囊各剂量组和葵花护肝片组大鼠体质量无统计学意义 (P>0.05),而高剂量组和葵花护肝片组大鼠肝脏指数减小,与模型组相比具有统计学意义 (P<0.05),见表1。
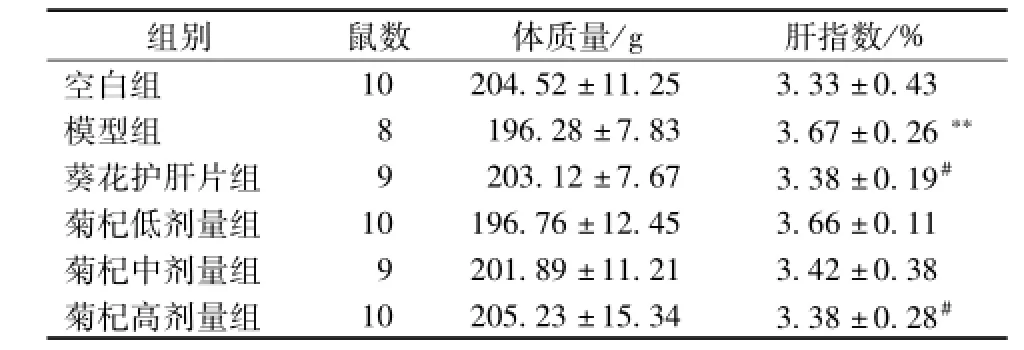
表1 各组大鼠体质量和肝脏指数的变化 (x±s)
3.3 菊杞保肝胶囊对各组大鼠血脂的影响 与空白组比较,模型组大鼠血清中CHO、TG、LDL-C水平均显著升高,HDL-C水平降低(P<0.01),表明模型复制成功。与模型组相比,菊杞保肝胶囊各剂量组大鼠血清中CHO、TG、LDL-C水平降低(P<0.01或P<0.05);HDL-C均升高 (P<0.01),见表2。
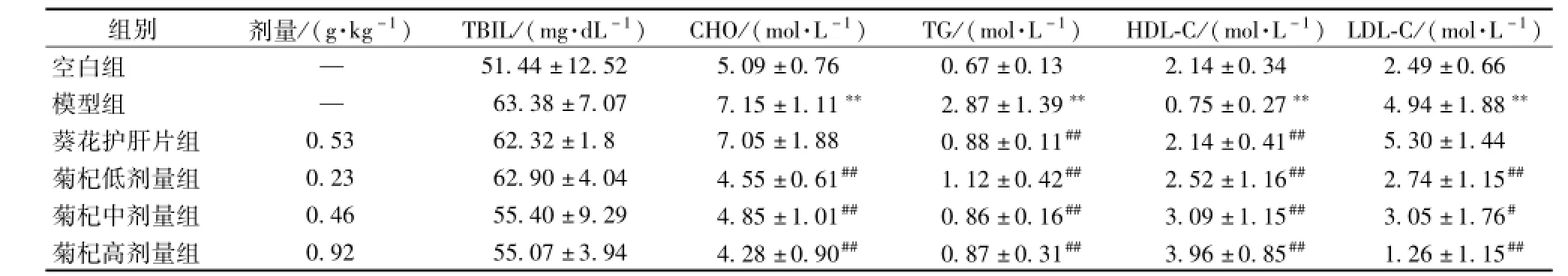
表2 各组大鼠血清TBIL、CHO、TG、HDL-C、LDL-C、ALT、AST水平(x±s)
3.4 菊杞保肝胶囊对各组大鼠肝功能的影响 血清ALT,AST模型组与正常组比较均升高,具有统计学意义 (P< 0.01);菊杞保肝胶囊各组与模型组比较血清ALT,AST有下降,与模型组相比具有统计学意义 (P<0.01或P<0.05),见表3。
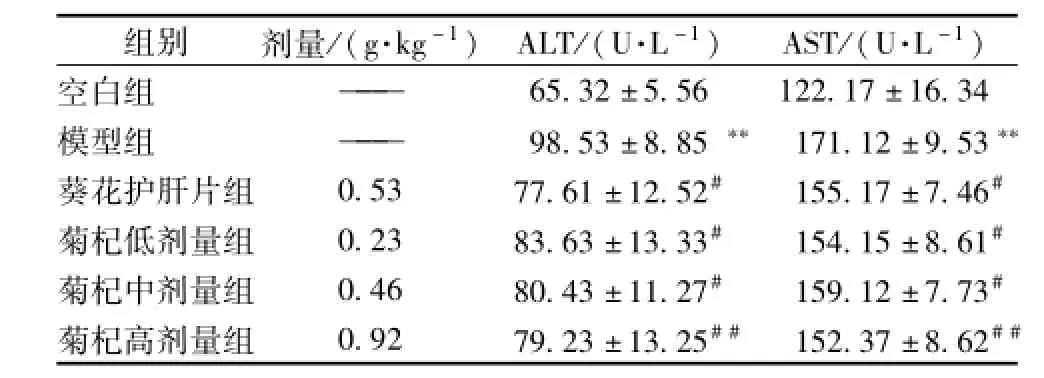
表3 各组大鼠血清中ALT、AST水平(x±s)
3.5 菊杞保肝胶囊对各组大鼠血清中SOD、MDA的影响
模型组大鼠血清中SOD水平降低、MDA水平升高,与正常组相比具有统计学意义 (P<0.01);菊杞保肝胶囊中、高剂量组SOD水平均升高,与模型组相比具有统计学意义(P<0.01);中、高剂量组MDA水平降低,与模型组相比具有统计学意义 (P<0.01或P<0.05);阳性组 (葵花护肝片组)SOD水平较升高,与模型组相比具有统计学意义(P<0.01),而MDA水平有所降低,与模型组相比具有统计学意义 (P<0.05),见表4。#P<0.05,##P<0.01
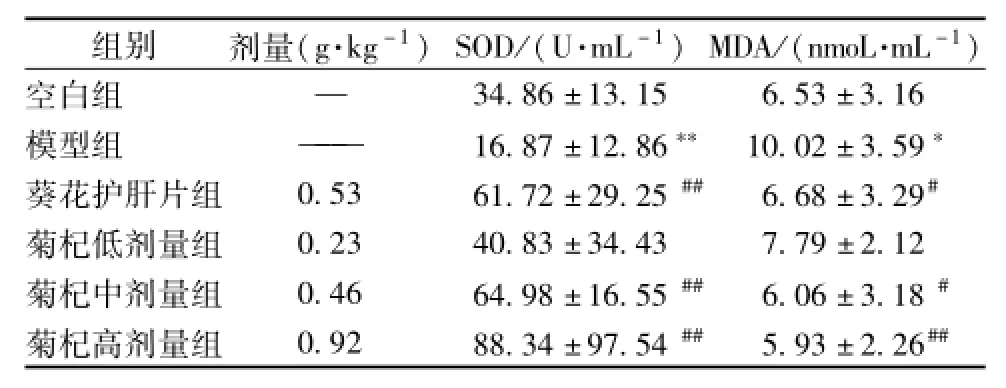
表4 各组大鼠血清中SOD、MDA水平(x±s)
3.6 菊杞保肝胶囊对各组大鼠血清PGE2、TNF-α及IL-6的影响 由表5所见模型组血清PGE2,TNF-α及IL-6均升高,与正常组相比具有统计学意义 (P<0.01);菊杞保肝胶囊各组血清PGE2,TNF-α及IL-6均下降,与模型组相比具有统计学意义 (P<0.05)。结果表明菊杞保肝胶囊具有减少炎症介质PGE2,TNF-α及IL-6作用,见表5。

表5 各组大鼠血清PGE2,TNF-α及IL-6水平(x±s)
3.7 菊杞保肝胶囊对各组大鼠肝组织COX-2mRNA表达
正常对照组表达弱,模型组呈高表达,与对照组相比具有统计学意义 (P<0.01),见图1。菊杞保肝胶囊高剂量组COX-2 mRNA表达下调,与模型组相比具有统计学意义(P<0.01),F=27.94。经计算机Bandscan软件分析其灰度值,COX-2mRNA灰度值与β-actin灰度值比值为:对照组 (n=7)为0.196±0.079,模型组 (n=7)为0.421± 0.033,菊杞保肝胶囊高剂量组 (n=6)为0.281±0.046。

图1 各组COX-2 mRNA在肝组织中的表达
3.8 菊杞保肝胶囊对各组大鼠肝脏形态学变化及病理学检查 肉眼观察空白大鼠肝脏被膜光滑,明亮有光泽,呈红褐色。模型组较空白组大鼠肝脏体积明显增大,包膜紧张,边缘圆钝,部分肝脏呈奶黄色,切面油腻,无光泽,与周围组织有黏连。与模型组比较,菊杞保肝胶囊各组大鼠介于正常组与模型之间,肝脏颜色红润,被膜较光滑,切面无明显油腻感,无局灶黄白色变性灶,质地接近正常肝组织。肝组织病理学观察,光镜下由图可见,空白组大鼠肝脏中央静脉周围肝细胞体积未见增大,胞浆致密,肝窦未见异常;与空白组相比,模型组中央静脉肝细胞体积明显增大,胞浆疏松肝窦受压变窄,并可见大量的红染物质,汇管区可见大量炎细胞浸润;菊杞保肝胶囊高、中、低组肝细胞体积、胞浆疏松程度显著减小,肝窦受压程度降低,部分肝细胞存在脂肪变及核固缩。见图2。
4 讨论
亚急性酒精性肝损伤是人类常见的肝病之一,在我国日益增多,早期症状通常表现为脂肪肝,进而发展为酒精性肝炎,后期酒精性肝纤维化和肝硬化,因此肝损伤早期的预防及治疗尤为重要。菊杞保肝胶囊源于我院临床经验方,由枸杞、菊花、葛根等十余种药味组成,临床表明其具有解毒保肝的功效,但其作用机理尚未明确。
ALT、AST作为肝细胞内转氨酶,在氨基酸的合成与分解代谢中起重要作用。在正常情况下活性低,只有极少量释放入血液中。当肝组织受到急性损伤或细胞膜通透性增加时,这两种酶活性显著增高。当肝功能受损时脂类代谢发生紊乱,从而导致血脂浓度发生改变,肝病患者肝细胞肿胀、变性、坏死,使体内激素代谢发生变化,影响脂类代谢,是反映肝实质性损伤的一个重要指标[6]。现代研究指出,LDL-C、HDL-C测定可作为肝功能的辅助参考指标[7]。本实验模型组与空白组比较,血清中ALT和AST均明显升高,CHO、TG、LDL-C水平显著升高,HDL-C水平显著降低,表明大鼠摄入52%北京二锅头可成功建立亚急性酒精性肝损伤大鼠模型。经杞菊保肝胶囊给药30 d后,与模型组比较,各给药组大鼠血清中ALT、AST、CHO、TG、LDL-C水平均显著降低,HDL-C水平显著升高,表明杞菊保肝胶囊可改善酒精对肝组织的损伤作用。

图2 各组大鼠酒精肝模型肝组织病理学观察 (×200)
SOD活性反映了机体清除氧自由基的能力,MDA的高低反映了机体细胞受自由基攻击的严重程度。机体自身有一套抗氧化防御系统,不断清除新产生的自由基,当机体SOD活性下降、MDA水平增高时,该防御系统作用减弱或受损,就会诱发或加重疾病[8]。实验结果表明菊杞保肝胶囊中、高剂量均能降低大鼠血清MDA水平,升高SOD活性,菊杞保肝胶囊高剂量组对血清MDA水平影响要优于各组。
酒精性肝炎发病中有免疫因素参与,如分离的酒精透明小体和自身肝抗原,可刺激体内淋巴细胞转化和游走移动抑制免疫因子活力。有些细胞因子如白细胞介素 (IL)、肿瘤坏死因子(TNF)、前列腺素E2(PGE2)等与酒精性肝炎的发生有关。菊杞保肝胶囊各组与模型组比较,血清PGE2、TNF-α及IL-6明显下降,差别均有显著性意义,菊杞保肝胶囊具有减少炎症介质PGE2、TNF-α及IL-6作用。
环氧合酶-2(COX-2)又称前列腺素合成酶,是前列腺素合成过程中的限速酶,正常情况下在大部分组织中不表达或极低表达,而主要表达在单核细胞、血管内皮细胞、巨噬细胞等与炎症有密切关系的细胞或组织中;在炎症因子或细胞因子受到各种刺激的情况下可诱导表达,参与和加重炎症反应,在炎症及组织损伤、肿瘤的发生发展过程中表达增高[9-11]。本实验结果显示正常大鼠肝组织中COX-2呈极低表达,模型组中COX-2表达明显增高,使用菊杞保肝胶囊后各组COX-2表达与模型组相比有明显降低。提示菊杞保肝胶囊各组在急性肝损伤中起着一定的保护作用,由于COX-2及其产物PGs体系本身的复杂性,现有的结果对于其在肝损伤方面的作用机制解释尚不够完善,有关亚急性酒精性肝损伤发生发展中炎症通路的作用及确切机制仍有待进一步探讨。
上述实验结果表明,在酒精性肝损伤过程中,逐渐出现脂代谢紊乱和肝功异常,菊杞保肝胶囊可改善脂质代谢紊乱,抑制肝组织损伤;长期大量酒精可刺激肝组织化学性炎症介质PGE2、TNF-α及IL-6的释放,促进肝组织COX-2的表达,而菊杞保肝胶囊可以拮抗上述变化,从而减轻酒精导致的肝组织损伤。
[1]王安莲,石 年.酒精性肝病研究进展[J].安徽预防医学杂志,2009,15(6):454-458.
[2]郑丽红,陈冠敏,郑显著,等.山楂提取物对亚急性酒精性肝损伤辅助保护作用的研究[J].海峡药学,2011,23(12):34-38.
[3]王宝恩,尹珊珊.酒精性肝病的流行病学[J].中华肝脏病杂志,2001,9(5):312.
[4]陈春晓,朱肖鸿.酒精性肝炎大鼠模型建立及枳棋子的干预作用[J].浙江中西医结合杂志,2007,17(5):285-287.
[5]严文伟,周总光,陈友琴,等.急性水肿性胰腺炎大鼠胰腺微血流变化和环氧合酶-2的表达 [J]中华肝胆外科杂志,2004,10(4):252-255.
[6]雷 勇,左 成,王 秦.肝病患者血脂检测对肝功能的评价[J].中外医疗,2008,27(15):140-141.
[7]吴爱成,黄国清,唐恒锋.血脂检测对肝脏疾病诊断的意义[J].中外医疗,2010,29(20):4-6.
[8]冷兴文,刘志华,罗书练,等.血清丙二醛和超氧化物歧化酶水平与病情转归的关系[J].中国危重病急救医学,1996,8(10):598-600.
[9]Samaka R M,Abdou A G,Abd El-Wahed M M,et al.Cyclooxygenase-2 expression in chronic gastritis and gastric carcinoma,correlation with prognostic parameters[J].JEgypt Natl Canc Inst,2006,18(4):363-374.
[10]Harada N,Okajima K,Uchiba M,et al.Antithrombin reduces ischemia/reperfusion-induced liver injury in rats by activation of cyclooxygenase-1[J].Thromb Haemost,2004,92(3):550-558.
[11]Warford-Woolgar L,Peng C Y,Shuhyta J,et al.Selectivity of cyclooxygenase isoform activity and prostanoid production in normaland diseased Han:SPRD-cy ratkidneys[J].Am JPhysiol Renal Physiol,2006,290(4):897-904.
R285.5
:B
:1001-1528(2015)06-1325-05
10.3969/j.issn.1001-1528.2015.06.037
2014-07-15
杜丽萍,女,硕士生,研究方向为中药药理。Tel:(0351)2486811,E-mail:297957178@qq.com
