刺五加注射液在正常大鼠与脑缺血-再灌注损伤疾病大鼠体内药动学比较
2015-01-16范惠霞邓志鹏王福文徐晓婷姚庆强
范惠霞, 邓志鹏, 王福文, 徐晓婷, 姚庆强*
(1.山东省医学科学院药物研究所,山东济南250062;2.济南大学山东省医学科学院医学与生命科学学院,山东济南250022;3.山东省罕少见病重点实验室,山东济南250062)
刺五加注射液在正常大鼠与脑缺血-再灌注损伤疾病大鼠体内药动学比较
范惠霞1,2,3, 邓志鹏1,3, 王福文1, 徐晓婷1,2,3, 姚庆强1,3*
(1.山东省医学科学院药物研究所,山东济南250062;2.济南大学山东省医学科学院医学与生命科学学院,山东济南250022;3.山东省罕少见病重点实验室,山东济南250062)
目的比较刺五加注射液 (紫丁香苷、刺五加苷E、异嗪皮啶等)在正常大鼠与脑缺血-再灌注损伤大鼠体内药代动力学行为。方法采用longa法建立大鼠局灶性脑缺血-再灌注损伤疾病模型,采用液相色谱-串联四级杆质谱法测定不同时间点大鼠血浆中紫丁香苷、刺五加苷E及异嗪皮啶的含有量,用药代动力学软件DAS 2.0非房室模型计算药动学参数并用统计软件SPSS 17.0对主要药动学参数进行比较。结果与正常大鼠体内药动学相比较,脑缺血-再灌注损伤对刺五加注射液中紫丁香苷产生蓄积,对异嗪皮啶的消除发生改变,对刺五加苷E无影响。结论初步推测脑缺血-再灌注损伤大鼠体内,紫丁香苷及异嗪皮啶与血浆蛋白结合能力发生改变,有待进一步研究。
脑缺血-再灌注损伤;大鼠;五加注射液;紫丁香苷;刺五加苷E;异嗪皮啶;药动学
刺五加注射液是刺五加经过提取制得的灭菌注射液,在我国临床用于治疗心脑血管疾病已经多年,主要用于肝肾不足所致的短暂性脑缺血发作、脑动脉硬化、脑血栓形成、脑栓塞等。紫丁香苷、刺五加苷E及异嗪皮啶是刺五加的主要活性成分,也是刺五加注射液发挥药效的物质基础,具有广泛的药理活性[1-4]。研究表明,刺五加提取物可减缓大鼠大脑海马趾CA1区神经死亡,减弱脑缺血-再灌注引起的COX-2,GFAP及OX-42因子的活化,实现对脑缺血大鼠的神经保护作用[5]。此外,刺五加苷B、E可通过抑制iNOS活性,减少一氧化氮生成,减少缺血性神经元凋亡[6]。上述研究表明,紫丁香苷、刺五加苷E及异嗪皮啶可能在刺五加注射液治疗缺血性脑血管疾病时发挥重要作用。
目前,已有文献报道刺五加注射液中紫丁香苷、刺五加苷E在大鼠体内的药代动力学研究[7-8]。然而,该研究主要局限于正常大鼠体内,对病理状态大鼠体内的药动学研究未见报道。为进一步明确刺五加注射液的药动学,更好地指导临床用药,本课题组对刺五加注射液中3个主要活性成分在脑缺血-再灌注损伤大鼠体内的药代动力学行为进行研究,比较刺五加注射液中主要有效成分在正常大鼠及脑缺血-再灌注损伤大鼠体内药动学行为差异。
1 仪器与试药
1.1 试药与试剂 紫丁香苷 (LPZ022)、刺五加苷E(LPC031)、异嗪皮啶 (LPQ069)、牡荆苷(内标物质LPM041),均购自沈阳泷浦科技有限公司,纯度>98%;刺五加注射液 (批号20120112,规格250 mL/支,黑龙江乌苏里江制药有限公司),并采用高效液相色谱法测定其中紫丁香苷、刺五加苷E、异嗪皮啶的质量浓度,结果分别为139.9、126.6、13.6μg/m L。色谱级甲醇(美国TEDIA公司);色谱级乙腈(美国Burdick&Jackson公司);其他试剂均为分析纯 (国药集团化学试剂有限公司);水为娃哈哈纯净水。新鲜大鼠空白血浆为本实验自制。
1.2 仪器 Agilent1200高效液相色谱仪、Agilent 6410三重四级杆串联质谱仪 (美国安捷伦公司);氮气浓缩仪 (北京普利泰科技仪器有限公司);TGL-16G高速台式离心机、SK-1快速混匀器涡流混悬仪 (常州澳华仪器有限公司);KQ5200型超声波清洗仪 (昆山市超声波仪器有限公司)。
1.3 动物 雄性健康Sprague-Dawley大鼠,体质量220~250 g,由山东中医药大学实验动物中心提供,合格证号 SCXK(鲁)2011-0003。实验前于本室动物房饲养10 d,给药前禁食12 h,自由饮水。
2 实验方法
2.1 大鼠脑缺血-再灌注损伤模型的建立 12只大鼠随机分为模型组与正常组。模型组大鼠参照longa[9]法,用2.5%戊巴比妥钠(25 mg/kg)腹腔注射麻醉,使其在手术台仰卧固定,切开颈部正中皮肤,钝性分离出右颈总动脉及分支和颈内、外动脉,穿线结扎颈外动脉,进而分离并结扎颈内动脉进耳分支。在颈总动脉 (近内、外颈动脉分叉处)上作一小切口,由此沿颈内动脉插入一根头端加工成圆珠状 (直径<0.30 mm)尼龙线,插入约17 mm(由颈内、外动脉分叉处起算),用缝线固定尼龙线,造成局灶性大脑中动脉梗塞,记录梗塞时间。该模型成功的标志为大鼠苏醒后出现同侧Homer征和对侧以前肢为重的偏瘫。2 h后轻轻提拉出插线,实现对缺血脑组织的再灌注,结扎残端并逐层缝合肌肉、皮肤。
2.2 给药及血样采集 模型组大鼠实现再灌注后立即经尾静脉注射刺五加注射液(10 mL/kg),正常组大鼠按同等剂量给药。分别于给药后2、5、10、15、20、30、40、60、90、120、150、180 min眼底静脉丛取血约300μL,置于肝素抗凝管中。经8 000 r/min离心5 min,取上清液,置于-20℃冷冻保存待测。
2.3 测定条件
2.3.1 色谱条件 Diamonsil C18色谱柱(4.6mm× 150 mm,5μm);流动相为甲醇(A相)-0.1%甲酸水溶液 (B相),梯度洗脱(0~4.0 min,A相20%~70%;4.0~12.0 min,A相70%);体积流量0.6 mL/min;进样量20μL,柱温30℃。
2.3.2 质谱条件 采用电喷雾离子源 (ESI),多反应监测模式(MRM),正负离子同时监测;紫丁香苷、刺五加苷E、异嗪皮啶及牡荆苷 (内标)的监测离子对分别为m/z 395.0/232.0、765.1/765.1、223.0/162.0、431.0/311.1,优化的碎裂电压分别为150、150、135、150V;碰撞能量分别为20、0、25、20 eV;毛细管电压 (±)4.0 kV;干燥气体积流量10 L/min;干燥气温度325℃;雾化气压力35 psi;碰撞气为高纯氮气,压力0.15MPa。
2.4 血浆样品的处理 50μL血浆样品,依次加入50μL内标溶液 (1.0μg/mL),50μL乙腈作为沉淀试剂,涡流混合1 min,于1.2×104r/min条件下离心5 min,取上清液进行测定。
2.5 方法学考察
2.5.1 线性关系考察 取7份180μL的空白血浆,置离心管中并加入不同质量浓度梯度混合对照品溶液 (紫丁香苷、刺五加苷E质量浓度为30.0、100.0、300.0、1 000.0、3 000.0、10 000、30 000 ng/m L,异嗪皮啶质量浓度为10.0、30.0、100.0、300.0、1 000.0、3 000.0、10 000 ng/mL)各20μL,制成含有紫丁香苷、刺五加苷E质量浓度为3.0、10.0、30.0、100.0、300.0、1 000、3 000 ng/m L;异嗪皮啶质量浓度为1.0、3.0、10.0、30.0、100.0、300.0、1 000 ng/mL的含药血浆样品。将含药血浆按 “2.4”项下样品处理方法处理并进样测定。以目标化合物与内标化合物峰面积之比y为纵坐标,进样质量浓度x(ng/m L)为横坐标进行线性回归,权重因子选择1/x2。
2.5.2 精密度与准确度 取18份空白血浆180μL,分为3组,每组6样本。向每组中分别加入3种不同质量浓度的混合对照品溶液 (紫丁香苷、刺五加苷 E质量浓度为 100.0、1 000.0、27 000 ng/mL;异嗪皮啶质量浓度为 300.0、3 000.0、9 000 ng/mL)20μL,制成含有紫丁香苷、刺五加苷E质量浓度为10.0、100.0、2 700 ng/mL;异嗪皮啶质量浓度为3.0、30.0、900 ng/mL的低、中、高3种质量浓度质控血浆样品。将质控血浆样品按 “2.4”项下样品处理方法处理,进样测定,计算日内精密度 (RSD)。如此操作,连续测定3 d。计算日间精密度。综合上述测定结果,计算准确度(RE)。
2.5.3 回收率 按 “2.5.2”项下制备含有紫丁香苷、刺五加苷E及异嗪皮啶的低、中、高3种质量浓度质控血浆样品各3份。将质控血浆样品按“2.4”项下处理方法处理,进样测定记录峰面积(用A表示);取50μL大鼠空白血浆9份,分为3组,每组3样本,分别加入100μL乙腈沉淀蛋白,取全部上清液经氮气吹干。分别向每组加入低、中、高3种质量浓度 (紫丁香苷、刺五加苷E质量浓度为10.0、100.0、2 700 ng/mL;异嗪皮啶质量浓度为3.0、30.0、900 ng/mL)的混合对照品溶液50μL,内标50μL,乙腈50μL。经超声、涡流、离心后,取上清液进样分析,记录被分析物及内标的峰面积(用B表示);另取50μL纯水9份,分为3组,每组3样本,加入100μL乙腈涡流离心,氮气吹干。分别依次加入低、中、高3种质量浓度混合对照品溶液50μL,内标溶液50μL,乙腈50μL,经超声、涡流、离心后,取上清液进样测定,记录被分析物及内标的峰面积 (用C表示)。计算A/B,得目标化合物及内标的回收率;计算A/C比值,得基质效应。
2.6 血药浓度的测定及数据处理 参照血浆样品处理方法处理,采用测定条件依法测定,按当日标准曲线计算各时间点内的血药浓度。所得血药浓度采用DAS 2.0软件进行拟合,拟合得到的参数采用SPSS 17.0组间t检验进行比较,以P<0.05为显著性差异判断标准。
3 结果
3.1 色谱行为 大鼠空白血浆、空白血浆加目标化合物的对照品及内标及正常大鼠、模型大鼠给药后血浆的色谱图如图1。由图可知,血浆中内源性物质不干扰目标化合物及内标化合物的测定。

图1 紫丁香苷、刺五加苷E、异嗪皮啶及内标牡荆苷的色谱图Fig.1 MRM chromatogram s of syringin,eleutheroside E,isofraxidin,and vitexin
3.2 方法学考察
3.2.1 线性范围及最低定量下限 以目标化合物与内标化合物峰面积之比y为纵坐标,进样质量浓度x(ng/mL)为横坐标进行线性回归,紫丁香苷、刺五加苷E、异嗪皮啶线性回归方程分别为y= 0.001 30 x+0.002 25(r=0.996 2);y= 0.007 48 x+0.007 59(r=0.995 1);y= 0.000 89 x+0.003 67(r=0.999 4)。紫丁香苷、刺五加苷 E及异嗪皮啶分别在3.00~3 000、3.00~3 000、1.00~1 000 ng/mL范围内线性关系良好。目标化合物的最低定量下限为3.00、3.00、1.00 ng/mL。
3.2.2 精密度与准确度 低、中、高3个质量浓度下,紫丁香苷日内RSD≤7.3%,日间RSD≤14.4%;刺五加苷E日内RSD≤8.2%,日间RSD≤11.5%;异嗪皮啶日内RSD≤6.4%,日间RSD≤10.5%。3种质量浓度下紫丁香苷RE≤ 6.0%,刺五加苷E RE≤8.6%,异嗪皮啶RE≤10.1%,表明该方法日内、日间精密度及准确度良好,满足方法学要求。
3.2.3 回收率及基质效应 低、中、高3个质量浓度下,紫丁香苷的提取回收率分别为 (82.5± 7.3)%、(82.3±4.5)%、(84.5±2.3)%;刺五加苷E的提取回收率分别为 (70.3±5.9)%、(70.8±2.6)%、(73.7±2.8)%;异嗪皮啶的提取回收率分别为 (81.2±14.3)%、(80.8± 4.3)%、(83.3±2.1)%;内标化合物的提取回收率为 (88.0±6.8)%。表示回收率良好,满足样品测定要求。血浆基质对各质量浓度项下目标化合物具有微弱的离子增强效应,但均小于 (109.5± 4.3)%,对内标牡荆苷具有微弱的离子抑制作用,为(90.9±1.9)%。
3.3 药代动力学实验结果 正常大鼠及模型组大鼠尾静脉注射刺五加注射液后,紫丁香苷、刺五加苷E及异嗪皮啶的药-时曲线见图2。拟合得到的主要药动学参数见表1。得到的药动学参数通过SPSS 17.0组间t检验进行组间比较。在疾病模型大鼠体内,紫丁香苷的药-时曲线下面积[AUC(0→∞)]为 (979.5±224.3)(μg·h)/L,较正常大鼠体内(692.7±71.5)(μg·h)/L显著增大;清除率 (CL)为 (1.5±0.3) (L·kg)/h,较正常组显著减小;半衰期 (t1/2)为 (0.7± 0.4)h,与正常组保持一致。异嗪皮啶AUC(0→∞)为(26.3±7.8) (μg·h)/L;CL为(5.5±1.6)(L·kg)/h,与正常组无显著性差异;t1/2(0.17±0.06)h,较正常组(0.11±0.01)h显著延长。刺五加苷E在疾病模型大鼠体内的AUC(0→∞)为 (1 421.9±360.5)(μg·h)/L;CL为(0.9±0.3)(L·kg)/h;t1/2为 (0.7±0.5)h,与正常组相比无显著性差异。
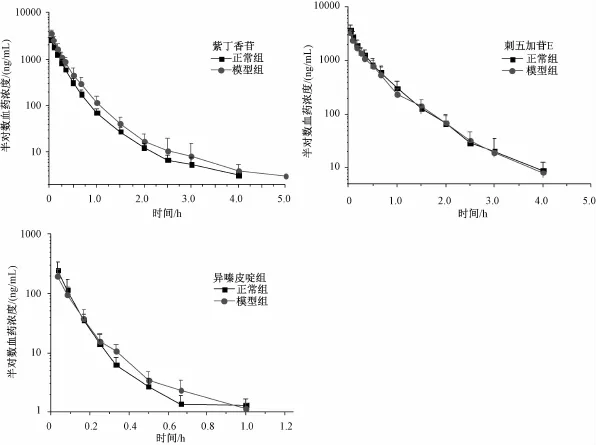
图2 刺五加注射液中紫丁香苷、刺五加苷E及异嗪皮啶在正常大鼠及脑缺血-再灌注损伤大鼠体内的半对数血药浓度-时间曲线Fig.2 Sem i-logarithm ic concentration-time curves for syringin,eleutheroside E,and isofraxidin in norm al and model(cerebral ischem ia-reperfusion)rats

表1 紫丁香苷、刺五加苷E及异嗪皮啶的在正常组大鼠及模型组大鼠体内的主要药动学参数Tab.1 M ain pharm acokinetics parameters for syringin,eleu theroside E,and isofraxidin in normal and model rats
4 讨论
为考察刺五加注射液在脑缺血-再灌注损伤疾病大鼠体内的药动学行为,必须选择与临床接近的动物模型。大脑中动脉闭塞造成的局灶性脑缺血是临床常见的缺血性脑血管疾病[10]。本研究采用改良Longa法,使用尼龙鱼线闭塞大鼠大脑中动脉建立局灶性脑缺血模型,缺血2 h后恢复血流灌注。该方法操作简单易行,避免开颅,动物损伤小,为后续的药代动力学研究奠定良好的基础。
本实验采用LC-MS/MS法对血浆样品中3个目标化合物进行定量。质谱采用电喷雾离子源和多反应监测模式,通过对目标化合物及内标化合物进行全扫描、子离子扫描,确定紫丁香苷、异嗪皮啶及内标化合物的监测离子对分别为m/z395.0/232.0、223.0/162.0、431.0/311.1。将刺五加苷E进行全扫描,选择丰度较高的[M+Na]+(m/z 765.1)峰作为刺五加苷E的母离子,对母离子做子离子扫描时发现,无论施加多大碎裂电压及碰撞能量,仍难以裂解,因而同时选用m/z765.1的离子作为刺五加苷E的子离子,确定其监测离子对为765.1/765.1。
药代动力学研究结果显示,刺五加注射液中紫丁香苷及异嗪皮啶在疾病模型大鼠体内药动学行为发生改变,刺五加苷E的药动学行为与正常大鼠体内保持一致。3个有效成分在疾病模型大鼠及正常大鼠体内的药动学差异,是其在大鼠体内分布、代谢及排泄过程综合作用的结果。由半对数血药浓度-时间曲线图可以看出,较正常组,紫丁香苷在脑缺血疾病模型大鼠体内发生蓄积,而异嗪皮啶在模型大鼠体内的消除发生改变。研究显示,紫丁香苷及异嗪皮啶可与血浆蛋白结合[11-12]实现其在大鼠体内的分布及转运。初步推测脑缺血-再灌注损伤大鼠体内,紫丁香苷及异嗪皮啶与血浆蛋白结合能力发生改变,从而使紫丁香苷及异嗪皮啶在疾病大鼠体内的药动学行为发生改变。另有研究表明[13-15],脑缺血-再灌注损伤使得大鼠体内某些代谢酶的活性降低,生物膜转运能力下降,也可能是造成紫丁香苷及异嗪皮啶在模型大鼠体内药动学行为差异的原因。静脉注射给药后,紫丁香苷及异嗪皮啶主要经尿液排泄,而脑缺血再灌注损伤引起血液流经肾的血流量减少,可能使得两目标化合物经尿液排泄减少,因而推测可能造成紫丁香苷及异嗪皮啶药动学行为的改变[16]。至于病理状态下机体对紫丁香苷及异嗪皮啶的处置机制及过程,有待进一步研究。
该项研究表明,药物在疾病状态机体内的药代动力学行为发生改变。对临床应用而言,病理状态下获得的药动学参数对于指导临床用药更有意义。本实验以紫丁香苷、刺五加苷E及异嗪皮啶3种不同结构的活性成分为指标,初步探索刺五加注射液在脑缺血-再灌注损伤疾病大鼠体内的药代动力学行为,为刺五加注射液临床安全用药提供理论依据。
[1]Lee SH,Son DW,Ryu JY,et al.Anti-oxidant activities of Acanthopanax senticosus stemsand their lignan components[J]. Arch Pharm Res,2004,27(1):106-110.
[2]Liu K Y,Wu YC,Liu IM,etal.Release ofacethylcholineby syringin,an active principle of Eleutherococcus senticocus,to raise insulin secretion in Wistar rats[J].Neurosci Lett,2008,434(2):195-199.
[3]Kimura Y Y,SumiyoshiM H.Effect of various Eleutherococcus senticosus cortex on swimming time,natural killer activity and corticosterone level in forced swimming stressed mice[J].J Ethnopharmacol,2004,95(2-3):447-453.
[4]张 涛,朴俊虹,袁 蕾,等.刺五加化学成分及自由基清除活性研究[J].中草药,2012,43(6):1057-1060.
[5]Lee D H,Park JY,Yoon JP,et al.Neuroprotective effects of Eleutherococcussenticosus bark on transientglobal cerebral ischemia in rats[J].JEthnopharmacol,2012,139(1):6-11.
[6]Lin QY,Jin L J,Ma Y S,et al.Acanthopanax senticosus inhibits nitric oxide production inmurinemacrophages in vitro and in vivo[J].Phytother Res,2007,21(9):879-883.
[7]Feng S L,Hu FD,Zhao JX,etal.Determination of eleutheroside E and eleutheroside B in rat p lasma and tissue by highperformance liquid chromatography using solid-phase extraction and photodiode array detection[J].Eur J Pharm Biopharm,2006,62(3):315-320.
[8]Ma B,Zhang Q,Liu Y H,etal.Simultaneous determination of Eleutheroside B and Eleutheroside E in rat plasma by high performance liquid chromatography-electrospray ionization mass spectrometry and itsapplication in a pharmacokinetic study[J]. JChromatogr B,2013,917-918:84-92.
[9]Longa E Z,Weinstein PR,Carlson S,etal.Reversiblemidd le cerebral artery occlusion without craniectomy in rat[J]. Stroke,1989,20(1):84-91.
[10]辛 丽.复方刺五加注射液对大鼠脑缺血再灌注损伤的保护作用[D].吉林:吉林大学,2013.
[11]Gao W H,Li N N,Chen YW,et al.Study of interaction between syringin and human serum albumin bymulti-spectroscopic method and atomic force microscopy[J].JMol Struct,2010,983(1):133-140.
[12]Liu JQ,Tian JN,Tian X,etal.Interaction of isofraxidin with human serum albumin[J].Bioorg Med Chem,2004,12(2):469-474.
[13]He X,Xing D,Ding Y,et al.Effects of cerebral ischemiareperfusion on pharmacokinetic fate of paeoniflorin after intravenous administration of Paeoniae Radix extract in rats[J].JEthnopharmacol,2004,94(2-3):339-344.
[14]Yan B,Xing D M,Ding Y,et al.HPLCmethod for the determination and pharmacokinetic studies on puerarin in cerebral ischemia reperfusion ratp lasma after intravenous administration of puerariae radix isoflavone[J].JPharm Biomed Anal,2005,37(2):297-301.
[15]Ma SW,Zhao M,Liu H X,et al.Pharmacokinetic effects of baicalin on cerebral ischemia-reperfusion after iv administration in rats[J].Chin Herb Med,2012,4(1):53-57.
[16]Zhou J,Zeng P,Cheng Z H,et al.Application of hollow fiber liquid phasemicro extraction coupled with high-performance liquid chromatography for the study of osthole pharmacokinetics in cerebral ischemia hypoperfusion rat p lasma[J].J Chromatogr B,2011,879(23):2304-2310.
Com paring pharmacokinetics of Acanthopanax Injection in normal and cerebral ischem ia-reperfusion rats
FAN Hui-xia1,2,3, DENG Zhi-peng1,3, WANG Fu-wen1, XU Xiao-ting1,2,3, YAO Qing-qiang1,3*
(1.Institute of Materia Medica,Shandong Academy of Medical Sciences,Jinan 250062,China;2.Schoolof Medicineand Life Sciences,University of Jinan and Shandong Academy of Medical Science,Jinan 250022,China;3.Key Laboratory of Rareand Uncommon Diseases of Shandong Province,Jinan 250062,China)
AIMTo compare the pharmacokinetics of the normal and the cerebral ischemia-reperfusion rats given Acanthopanax Injection(syringin,isofraxidin,and eleutheroside E)intravenously.METHODSLonga method was for establishing the ratmodel with cerebral ischemia-reperfusion;high performance liquid chromatography-tandem mass spectrometry(LC-MS/MS)was for determination of the contents of syringin,isofraxidin,and eleutheroside E in rat plasma.The pharmacokinetic parameters and statistics were obtained through DAS 2.0 and SPSS softwares processing,respectively.RESULTSWhile eleutheroside E remained unchanged between the two groups,gradual in vivo syringin accumulation and elimination change of isofraxidin were observed in cerebral ischemia reperfusion rats,but not in normal rats.CONCLUSIONWe speculate from the study that the syringin and isofraxidin somehow combine with plasma proteins,but further study is needed.
cerebral ischemia-reperfusion;syringin;eleutheroside E;isofraxidin;pharmacokinetics
R969.1
:A
:1001-1528(2015)06-1215-07
10.3969/j.issn.1001-1528.2015.06.013
2014-02-18
范惠霞(1988—),女,硕士,从事药物分析研究。Tel:13156371500,E-mail:fan.hui.xia@163.com
*通信作者:姚庆强 (1965—),男,博士,研究员,硕士生导师,从事天然药物化学与药物分析研究。Tel:(0531)82919960,E-mail:yao_imm@163.com
