基于上转换发光技术的尿液中吗啡及甲基苯丙胺快速定量检测方法研究
2015-01-13林承喜张平平杨笑熳李春凤孙崇云邱景富杨瑞馥
刘 晓 ,林承喜, ,张平平,杨笑熳,赵 勇 ,李春凤, ,孙崇云, ,邱景富,杨瑞馥,周 蕾
(1.重庆医科大学公共卫生与管理学院,重庆400016;2. 军事医学科学院微生物流行病研究所 病原微生物生物安全国家重点实验室,北京100071;3. 中海智(北京)科技有限公司,北京100027;4. 中国人民解放军总医院,北京100853)
《禁毒法》第二条规定:“本法所称毒品,是指鸦片、海洛因、甲基苯丙胺(冰毒)、吗啡、大麻、可卡因以及国家规定管制的其他能够使人形成瘾癖的麻醉药品和精神药品”。在国家食品药品监督管理总局2012 年发布的《国家药物滥用监测年度报告》中指出:海洛因与“冰毒”是主要滥用物质,“冰毒”滥用者有增长趋势。吗啡(Morphine,MOP)是鸦片重要成分,也是海洛因在尿液中的代谢物质。甲基苯丙胺(Methamphetamine,MET)因其外观似冰故俗称为“冰毒”,是一种具有强烈兴奋中枢神经作用的苯丙胺类物质,MET 摄入体内后,大部分以原形从尿中排出[1]。
毒品检测对吸毒行为的认定、戒毒治疗过程的监控具有重要作用,是检察起诉、法院量刑的重要依据,对打击毒品犯罪、开展禁毒戒毒工作具有重要意义[2-3]。目前,毒品的检测主要包括确证与初筛两种类型。确证方法主要包括色谱法、光谱法、质谱法等[4-12],可实现定量检测,且结果可靠,但需严格的质控规程、标准的样品处理及精密的仪器分析,其方法复杂对于操作人员与操作环境依赖性过强。为满足现场大量样品的快速筛查,近年来各种初筛技术不断涌现,其中最为成熟的技术是胶体金免疫层析[13]、酶联免疫[14]等,可实现快速定性或半定量检测,但现场初筛操作下的全定量检测尚未实现。针对这一问题,本研究以免疫层析技术为基础,将新型上转换发光纳米材料(Up-converting Phosphor Nano-Particles, UCP-NPs)[15-16]作为生物示踪物与其有机结合,采用竞争免疫模式,研制可对尿液MOP及MET 进行精确定量检测的两种上转换发光免疫层析(Up-converting Phosphor Technology based Lateral Flow, UPT-LF)试纸。本研究所建立的方法同时兼顾了现场条件下“操作的简便、快捷”以及“结果的精确定量”,从而为警方对涉嫌吸毒人员进行现场快速筛查提供了可靠便捷的技术手段。
1 材料与方法
1.1 试剂与仪器
UCP-NPs(NaYF4: Yb3+,Er3+,粒径50nm,激发光980nm,发射光541.5nm)由上海科研光电科技有限公司制备。硝酸纤维素膜(SHF1350225)、玻璃纤维(GFCP20300)、吸水纸及粘性底衬购自美国Millipore 公司;试纸条塑料外壳由军事医学科学院微生物流行病研究所分析微生物实验室设计,深圳金灿华公司制造。小牛血清白蛋白(BSA)、蔗糖、聚乙烯醇(PVA)及十二烷基磺酸钠(SDS)等生化试剂购自美国Sigma-Aldrich;MOP、MET 标准品购自公安部物证鉴定中心;MOP、MET 单克隆抗体及其与BSA 交联抗原购自杭州隆基生物技术有限公司。胶体金试剂盒购自艾康生物技术(杭州)有限公司。尿液样品为现场执法时采集,吗啡阳性尿液样品经LC-MS 确证,冰毒阳性尿液样本经GC-MS 确证。
UPT 生物传感器(上转换发光免疫分析仪,UPT-3A 型)由军事医学科学院微生物流行病研究所与中国科学院上海光学精密机械研究所联合研制。其它主要设备包括:5417R 高速离心机(Eppendorf),喷膜机(Imagene Echnology),DHG-9245A 烘干机(上海一恒科学仪器),ZQ4000 数控高速斩切机(上海金标生物科技有限公司)。
1.2 UPT-LF 试纸条研制
对MOP 进行痕量检测(1ng/mL)的MOP 定量检测UPT-LF 试纸(MOP-UPT-LF)的制备方法如下。样品垫制备:吸水纸于样品垫处理液(0.3mol/L pH7.2 磷酸盐缓冲液含0.5%SDS、1%BSA、0.5%PVA)中浸泡10min,取出后37℃烘干2h,备用;结合垫制备:将UCP-NPs 与抗MOP 单克隆抗体、羊IgG 分别共价偶联[17],用结合物稀释液(0.03mol/L pH7.2 磷酸盐缓冲液含0.01%SDS、0.5%PEG20000、1%BSA)将UCP-抗MOP 单克隆抗体结合物与UCP-羊IgG结合物等比混合,以终浓度0.2mg/mL 泡玻璃纤维5min,45℃下烘干50min,备用;分析膜制备:将终浓度0.5 mg/mL MOP-BSA 与1mg/mL 兔抗羊IgG,按2µL/cm 喷点于分析膜上作为检测带(T)与质控带(C),45℃下15min 烘干,备用。将样品垫、结合垫、分析膜、吸水垫依次贴于底衬上,4mm/条斩切后放入塑料外壳,备用。
对MOP、MET 进行常规阈值浓度(MOP:300ng/mL;MET:1000 ng/mL) 检 测 的MOP 定量 检 测UPT-LF 试 纸(MOP-UPT-LF) 与MET 定量检测UPT-LF 试纸(MET-UPT-LF)制备方法如下。样品垫制备:MET-UPT-LF 样品垫处理液为0.3mol/L pH7.2 磷酸盐缓冲液含0.5%SDS、1%BSA、0.5%PEG8000、0.1%NaCl,其余同上;结合垫制备:UCP-抗MOP/MET 单克隆抗体结合物与UCP-羊IgG 结合物等比混合,以终浓度0.5mg/mL 浸泡玻璃纤维,其余同上;分析膜制备:将终浓度1.5mg/mL MOP-BSA/MET-BSA 与2mg/mL 兔抗羊IgG 喷点于分析膜上,其余同上。
100µL 尿液样品直接添加于试纸条样品垫部分,静置层析15min。用UPT 生物传感器对分析膜进行扫描分析,获得检测带对应的T 值与质控带对应的C 值,以T/C 作为检测结果。检测的过程中待检MOP/MET 与T 带上的MOP-BSA/MET-BSA 竞争结合UCP-抗MOP/MET 抗体复合物,从而形成样品中MOP 或MET 浓度与T/C 值呈反比的量效关系,若待检样品T/C 值小于Cutoff 值(空白均值-3×标准差),则样品判定为阳性,反之为阴性。
1.3 敏感性、线性及精密性评价
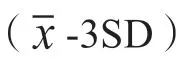
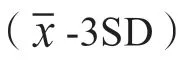
1.4 定性检测现场评价
现场采集涉嫌吸毒人员尿液,包括97 份吗啡现场筛查尿样及30 份冰毒现场筛查尿样,吗啡筛查尿液样品经LC-MS 确证,其中41 份为吗啡阳性,56份为吗啡阴性;冰毒筛查尿液样本经GC-MS 确证,其中22 份为冰毒阳性,8 份为冰毒阴性。将上述尿液,100µL/条直接仪器上样,分别进行MOP-UPT-LF 及MET-UPT-LF 检测,同时按试剂盒标准操作进行胶体金试纸条检测,胶体金检测MOP 阳性阈值为300ng/mL、MET 阳性阈值为1000ng/mL。分别以LC-MS及GC-MS 检测结果作为金标准,比较UPT-LF 与胶体金两种方法定性检测一致性,评价MOP-UPT-LF及MET-UPT-LF 对现场尿样的定性检测能力。
1.5 定量检测现场评价
以阴性尿样分别加入MOP 及MET 标准品,配制系列浓度模拟阳性样品,MOP 模拟样品系列浓度为50ng/mL,150ng/mL,300ng/mL,450ng/mL,1000ng/mL,3000ng/mL;MET 模拟样品系列浓度为125ng/mL,500ng/mL,1000ng/mL,1500ng/mL,3000ng/mL。对MOP 模拟阳性样本同时进行LC-MS 及UPTLF 定量检测,MET 模拟阳性样本同时进行GC-MS及UPT-LF 定量检测,分别比较两种检测方法定量结果一致性,评价MOP-UPT-LF/MET-UPT-LF 对尿液中MOP/MET 定量检测性能。
2 结 果
2.1 敏感性、线性及精密性评价
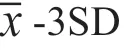
随着MOP、MET 浓度增加,T/C 值降低,以Logit(T/C)作为横坐标(x),Log(浓度[ng/mL])作为纵坐标(y),获得标准定量曲线(见图1),经统计拟合分析可知在痕量检测条件下,MOP-UPTLF 对MOP 进行检测在1~5000ng/mL 之间具有线性关系(r = -0.98172,P < 0.0005)(见图1D);按常规检测需求调整后,MOP-UPT-LF 对MOP 进行检测在50~3000ng/mL 之间具有线性关系(r = -0.98464, P <0.0005)(见图1E),MET-UPT-LF 对MET 进行检测在100~5000ng/mL 之间具有线性关系(r = -0.99964,P < 0.0005)(见图1F)。
2.2 定性检测现场评价
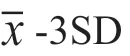
如表1 所示,对于尿液中MOP 及MET 的定性检测,MOP-UPT-LF 及MET-UPT-LF 与胶体金结果一致,均无假阳性及假阴性结果出现,检测效能较优。如图2 所示,MOP-UPT-LF(见图2A)检测尿液中MOP,ROC 曲线下面积为1.000±0.000(95%CI),MET-UPT-LF(见图2B)检测尿液中MET,ROC 曲线下面积为1.000±0.000(95%CI),诊断准确性均较优。
2.3 定量检测现场评价
采用LC-MS/GC-MS 与MOP-UPT-LF/MET-UPTLF 对模拟阳性样品进行定量检测,分别根据其定量曲线计算样品中MOP 及MET 回归浓度,结果见表2。就尿液中MOP 检测而言,MOP-UPT-LF 检测回收率在77%~133%之间,均值与CV 分别为109%、21%,LC-MS 检测回收率在80%~131%之间,均值与CV 分别为112%、17%;就尿液中MET 检测而言,MET-UPT-LF 检测回收率在81%~119%之间,均值与CV 分别为105%、12%,GC-MS 检测回收率在56%~101%之间,均值与CV 分别为85%、19%。将MOP-UPT-LF 与LC-MS 的回收率进行配对t 检验,t= 0.591,P > 0.05;将MET-UPT-LF 与GC-MS 的回收率进行配对t 检验,t = 2.271,P > 0.05;即就定量检测结果而言MOP-UPT-LF 及MET-UPT-LF 与传统确证方法LC-MS 及GC-MS 无显著性差异,且就平均回收率而言,MOP-UPT-LF(109%)及MET-UPTLF(105%)略优于定量确证方法LC-MS(112%)及GC-MS(84%),其检测性能可满足现场快速定量检测要求。
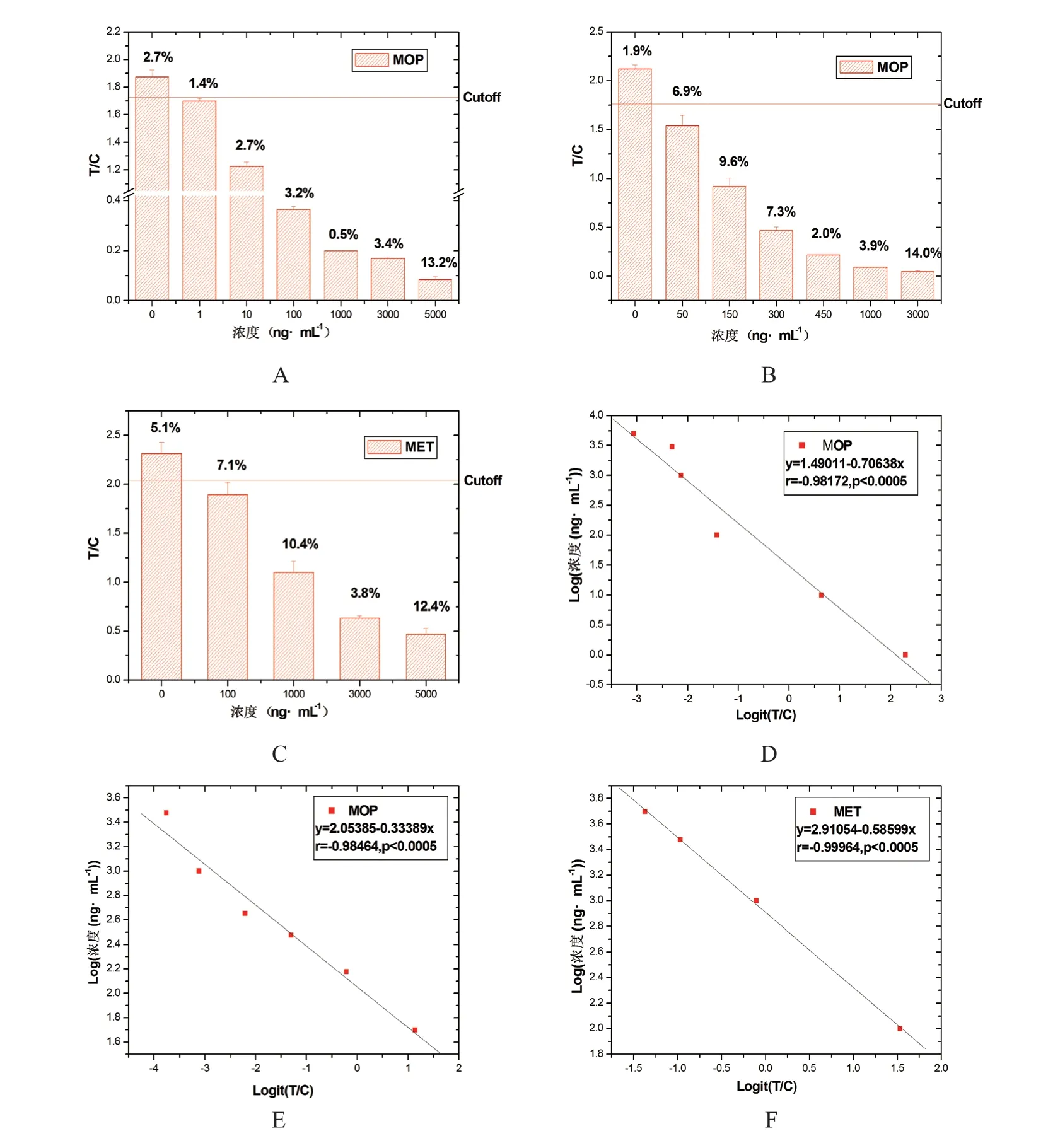
图1 MOP-UPT-LF/MET-UPT-LF 浓度响应与标准定量曲线。A:MOP 痕量检测;B:MOP 常规检测;C:MET 常规检测;D:MOP 痕量检测;E:MOP 常规检测;F:MET 常规检测。Fig.1 Concentration-response relationship and standard quantitative curve of MOP-UPT-LF/MET-UPT-LF. A: trace detection of MOP; B: routine threshold detection of MOP; C: routine threshold detection of MET; D: trace detection of MOP; E: routine threshold detection of MOP; F: routine threshold detection of MET. The detection limit of MOP-UPT-LF reached 1ng/mL with a linear range from 1ng/mL to 5000ng/mL (r = -0.98172, P < 0.0005) in trace detection. In detection with the routine threshold, the detection limit of MOP-UPT-LF was 50ng/mL with a linear range from 50ng/mL to 3000ng/mL (r = -0.98464, P < 0.0005). The detection limit of METUPT-LF was 100ng/mL with a linear range from 100ng/mL to 5000ng/mL (r = -0.99964, P < 0.0005).
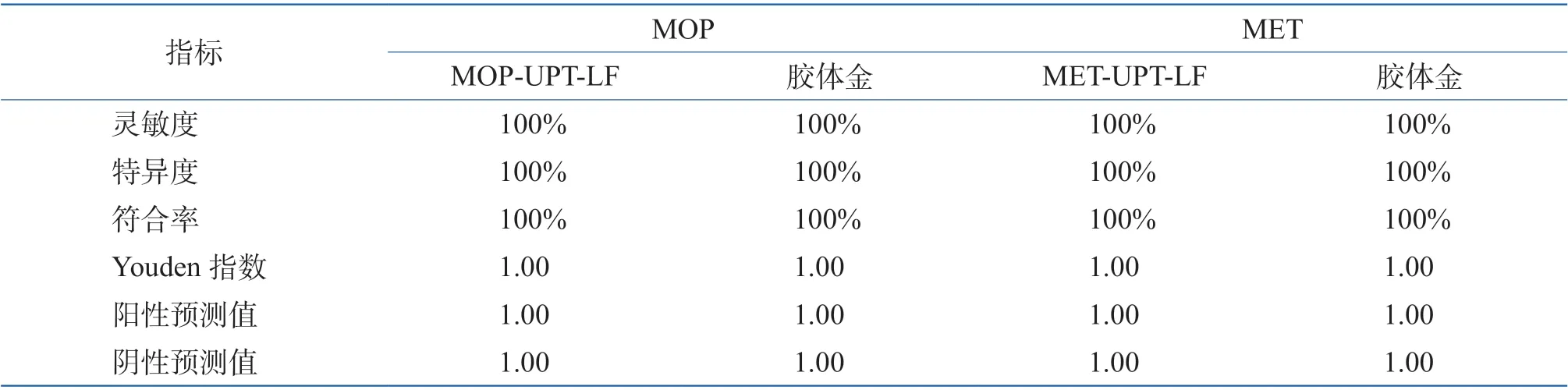
表1 现场尿样MOP-UPT-LF 及MET-UPT-LF 定性检测评价Table 1 Qualitative detection of MOP-UPT-LF and MET-UPT-LF in on-site urine samples
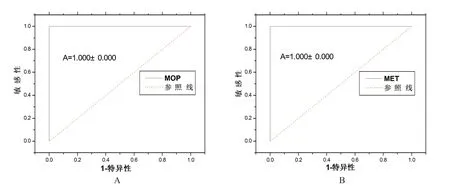
图2 MOP-UPT-LF MET-UPT-LF ROC 曲线。A:41 份MOP 阳性,56 份MOP 阴性尿液MOP-UPT-LF 检测结果;B:22份MET 阳性,8 份MET 阴性尿液MET-UPT-LF 检测结果。Fig.2 ROC curve of MOP-UPT-LF and MET-UPT-LF. A: 41 positive and 56 negative MOP urine samples tested with MOP-UPTLF; B: 22 positive and 8 negative MET urine samples obtained with MET-UPT-LF. Both detections owned a high diagnostic value with a ROC area of 1.000±0.000 (95%CI).
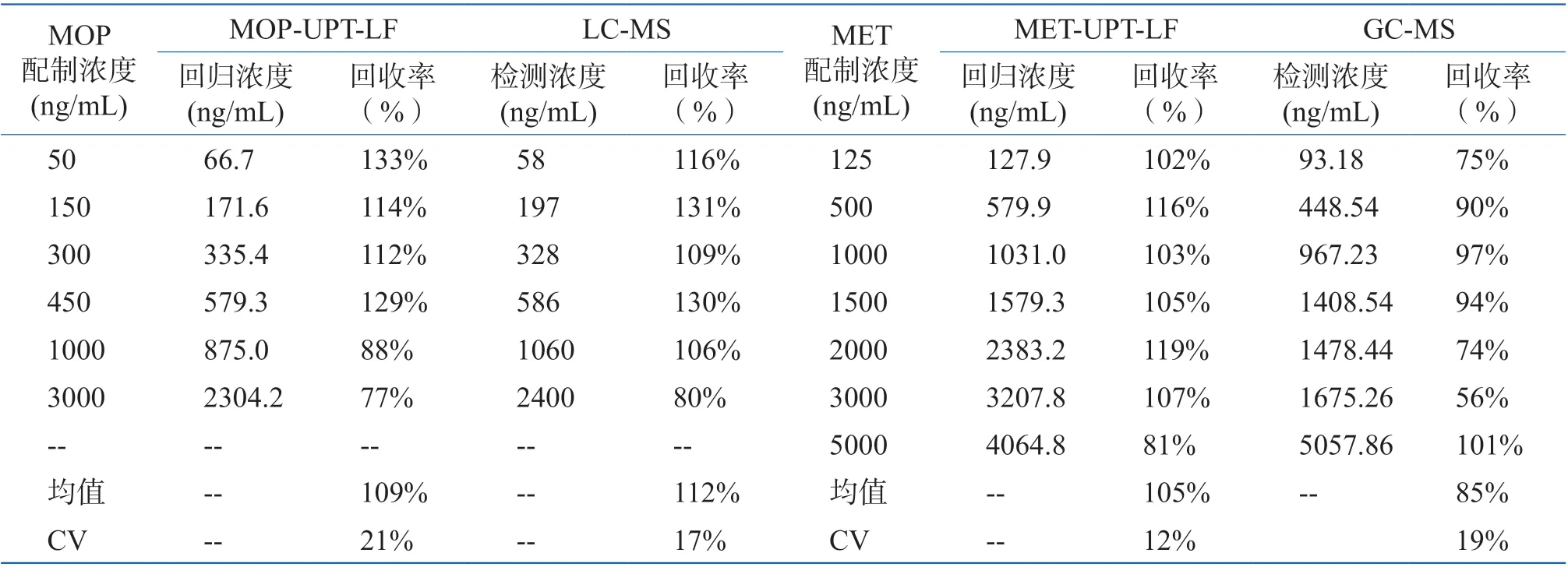
表2 尿液中MOP-UPT-LF/MET-UPT-LF 检测回收率Table 2 Recovery rate of MOP-UPT-LF and MET-UPT-LF in urine sample
3 讨 论
近年来伴随体外诊断技术的迅猛发展,缩短现场初筛技术与实验室确证技术之间的性能差异,提高现场执法准确性是大势所趋。胶体金免疫层析技术由于操作简便、价格低廉、无需辅助设备而广泛应用于现场筛查,但其存在肉眼判读主观差异及检测结果无法有效保存的问题。本研究在承袭层析技术简便快捷的基础上,采用具有独特上转换发光现象的UCPNPs 作为光学生物示踪物,使免疫层析与生物智能传感有机融合,实现了现场初筛条件下的自动仪器判读与精确定量,使现场执法结果作为证据永久保存得以实现。经系统评价在痕量MOP 检测中,MOP-UPTLF 敏感性可达1ng/mL,在1~5000ng/mL 之间具有线性关系(r = -0.98172,P < 0.0005);在常规检测中,MOP-UPT-LF 敏感性为50ng/mL,在50~3000ng/mL之间可精确定量(r = -0.98464,P < 0.0005),METUPT-LF 敏感性为100ng/mL,在10~5000ng/mL 之间可精确定量(r = -0.99964,P < 0.0005)。在定性检测评价中,MOP-UPT-LF 及MET-UPT-LF 灵敏度均为100%,特异度均为100%,ROC 曲线下面积均为1.000±0.000(95%CI),均具有较优检测效能。其定性检测能力与目前成熟快筛试剂胶体金一致,且MOP-UPT-LF 及MET-UPT-LF 具有其他快筛试剂所不具备的定量检测能力,与确证方法LC-MS 及GC-MS 定量能力比较无显著差异。MOP-UPT-LF 与MET-UPT-LF 操作简便,样品无需前处理即可直接上样,16min 内可出检测结果,具备快速、敏感性高、特异性好、可精确定量等诸多优点,为打击毒品犯罪,开展禁毒、戒毒工作提供了先进的毒品检测技术。
[1] 何颂跃. 尿液中常见毒品标准检验法[C]//公安部物证鉴定中心.首届全国毒品检验技术交流会论文集,1997,15: 115-129.
[2] 燕珊珊,张琼. 毒品检测技术的研究进展[J]. 上海化工,2014, 39(4): 12-16.
[3] 苗翠英. 毒品检测新技术[C]//中国化学会.公共安全中的化学问题研究进展. 北京:中国人民公安大学出版社2011, 2(6): 369-374.
[4] 杨瑞琴. 液相色谱-质谱联用技术在滥用药物检验中的应用[J]. 中国人民公安大学学报(自然科学版),2007:8-11.
[5] Magni PA, Pacini T, Pazzi M, et al. Development of a GCMS method for methamphetamine detection in calliphora vomitoria L (Diptera: Calliphoridae) [J]. Forensic Sci Int,2014, 241C: 96-101.
[6] Mahdy T, El-Shihi T H, Emara M M, et al. Development and validation of a new GC-MS method for the detection of Tramadol, O-desmethyltramadol, 6-acetylmorphine and morphine in blood, brain, liver and kidney of wistar rats treated with the combination of heroin and tramadol [J]. J Anal Toxicol, 2012, 36(8): 548-559.
[7] Ahadi A, Partoazar A, Abedi-Khorasgani M H, et al.Comparison of liquid-liquid extraction-thin Layer chromatography with solid-phase extraction-high-performance thin layer chromatography in detection of urinary morphine [J]. J Biomed Res, 2011, 25(5): 362-367.
[8] Dahn T, Gunn J, Kriger S, et al. Quantitation of morphine,codeine, hydrocodone, hydromorphone, oxycodone, oxymorphone, and 6-monoacetylmorphine (6-MAM) in urine, blood,serum, or plasma using liquid chromatography with tandem mass spectrometry detection [J]. Methods Mol Biol, 2010,603: 411-422.
[9] Miranda G E, Sordo M, Salazar A M, et al. Determination of amphetamine, methamphetamine, and hydroxyamphetamine derivatives in urine by gas chromatography-mass spectrometry and its relation to CYP2D6 phenotype of drug users [J].J Anal Toxicol, 2007, 31(1): 31-36.
[10] Okajima K, Namera A, Yashiki M, et al. Highly sensitive analysis of methamphetamine and amphetamine in human whole blood using headspace solid-phase microextraction and gas chromatography-mass spectrometry [J]. Forensic Sci Int, 2001, 116(1): 15-22.
[11] 邸玉敏,朱军,常靖,等. SPE-GC/MS、GC/NPD 法检测血液中苯丙胺类毒品[J]. 刑事技术,2010(3): 11-14.
[12] 张小婷,刘娟,杜晖玲,等. 超高效液相色谱法(UPLC)同时筛选检测吗啡等7 种常见毒品[J]. 刑事技术,2008(6): 11-12.
[13] Dehghannezhad A, Paknejad M, Rasaee M J, et al. Development of a nanogold-based immunochromatographic assay for detection of morphine in urine using the Amor-HK16 monoclonal antibody [J]. Hybridoma (Larchmt),2012, 31(6): 411-416.
[14] Lin C N, Strathmann F G. Elevated urine zinc concentration reduces the detection of methamphetamine, cocaine, THC and opiates in urine by EMIT [J]. J Anal Toxicol, 2013,37(9): 665-669.
[15] Zijlmans H J, Bonnet J, Burton J, et al. Detection of cell and tissue surface antigens using up-converting phosphors: a new reporter technology [J]. Anal Biochem,1999, 267(1): 30-36.
[16] Hampl J, Hall M, Mufti N A, et al. Upconverting phosphor reporters in immunochromatographic assays [J]. Anal Biochem, 2001, 288(2): 176-187.
[17] Yan Z, Zhou L, Zhao Y, et al. Rapid quantitative detection of Yersinia Pestis by lateral-flow immunoassay and upconverting phosphor technology-based biosensor [J].Sensors And Actuators B: chemical, 2006: 656-663.
