高风险有源植入式医疗器械标准要求及异同分析
2015-01-12刘毅孟志平
刘毅,孟志平
(北京市医疗器械检验所,北京101111)
高风险有源植入式医疗器械标准要求及异同分析
刘毅,孟志平
(北京市医疗器械检验所,北京101111)
本文阐述了植入式心脏起搏器、神经刺激器、除颤器、输注泵、人工耳蜗等高风险有源植入式医疗器械的特点,介绍了国内外相关标准内容及要求,分析梳理其异同点,重点分析了植入式心脏起搏器和心脏除颤器标准的异同。
有源植入式;医疗器械;标准;电磁兼容
0 引言
植入式心脏起搏器、神经刺激器、除颤器、输注泵、人工耳蜗等产品属高风险医疗器械,涉及学科多,技术含量高,临床风险大。目前,我国市场上绝大多数此类产品被国外大公司所垄断,而且价格昂贵。在这种局面下,国内也有部分厂家开始了植入式医疗器械的研发,但由于国内此类产品缺乏相应的标准指导,使得企业只能参照国外同类产品的功能和性能以及国际标准的要求进行研发,但研发的产品是否符合国际标准的要求,却由于国内相应检测和验证手段的欠缺,使得这种符合性验证根本无法实施!
基于上述问题,本文作者自2008年开始,先后承担北京市科委“医疗器械研发测试技术服务平台”项目和首都卫生发展科研专项“高风险有源植入式医疗器械检验技术研究及检验能力建立”项目,深入研究了有源植入式医疗器械的基本原理、基本结构、关键技术,及国内外相关标准:包括ISO14708-1/-2/-3/-4/-5/-6(国际)、AAMIPC69(美国)、EN45502-1/-2-1/-2-2 (欧洲)、GB 16174.1(国内)的要求和方法,分析梳理其异同点,并依据上述系列标准的要求,完成了心脏起搏器、心脏除颤器、神经刺激器的技术方案,研制了测试工装,编制了测试软件,定制了测试设备、创建了测试系统,并就创建的系统为国内外著名厂家提供了设计验证及测试技术服务,解决了国内厂家无力验证其产品是否符合相关标准的困难,提高了该类产品的抗干扰能力,减低了其使用风险和不良事件发生的概率。
本文重点阐述了有源植入式医疗器械的国内外标准的内容及要求,并分析了其异同点。
1 有源植入式医疗器械国内外相关标准
目前,国际上关于有源植入式医疗器械标准主要采用国际标准化组织(ISO)颁布的ISO14708系列标准、欧盟颁布的EN45502系列标准和美国医疗仪器促进协会AAMI系列标准,这三套标准对有源植入式医疗器械提出了性能、电气安全和电磁安全的要求,具体如表1所示。
目前,我国现行有效的植入式心脏起搏器的标准是GB 16174.1-1996(等同采用的ISO 5841-1:1989),但是在国际上ISO 5841-1:1989标准已经由ISO 14708.2:2005替代。除植入式心脏起搏器外,其他有源植入式医疗器械均没有国行标。
2 国外有源植入式医疗器械标准差异性分析
2.1 有源植入式心脏起搏器电磁兼容标准内容及要求对比
目前,国外关于植入式心脏起搏器电磁兼容(EMC)测试的标准主要有欧盟颁布的EN45502-2-1:2003、国际标准化组织颁布的ISO14708-2和美国医疗仪器促进协会颁布的AAMI PC69: 2007。由于EN45502-2-1和ISO14708-2由联合工作组制定,故两者内容一样,下面仅对ISO14708-2和AAMIPC69:2007作介绍,这两个标准的绝大部分条款和测试方法是一致的,只在个别条款有所差别,不同点在下文中介绍。

表1 有源植入医疗器械电气安全和电磁兼容标准
(1)标准ISO14708:2005中EMC测试要求。
ISO14708-2对心脏起搏器及其相关的概念进行了定义,并对诸如脉宽、感知灵敏度、逸搏间期等电学特征参数的测量方法予以规范,同时规定了测量结果的标准。ISO14708-2的14-19条款规定了避免IPG可能对病人产生的危害,如起搏器的电流、起搏器本身产生的辐射、热伤害以及生物效应等,标准还给出了相应的测试方法。而外部可能对起搏器造成的影响方面,ISO14708-2包括外部的高能交变电场、机械性载荷、电极导线的柔韧性,甚至气压、温度、静电等相关要求和测试方法以检验起搏器的相关抗干扰能力[1]。
除了上述内容,ISO14708-2的另一个重点就是第27条款,即关于避免使有源植入式医疗器械受到非电离电磁辐射的影响,也就是EMC测试的相关内容。27条款规定,对于有源植入式医疗器械的可植入部分,不应因外部电磁场造成的感应电流而影响其正常工作,如器械故障、失灵、发热或者因感应电流的增强对病人产生危害等。为此,ISO14708-2针对不同的外部干扰电磁场的频段设计了相应的试验模型和指标,旨在检验起搏器在不同的非电离电磁辐射场中的抗干扰能力。
27条款可分为两大块,分别用于检验起搏器在电磁场环境下(16.6 Hz~3 GHz)和磁场环境下的抗扰性。在电磁场环境下,不同的频段对应不同的组织接口电路,附录G规定了组织等效接口电路及测试规程。对于磁场环境又分别规定了静磁场和交变磁场的要求。
如图1所示,为一个感应电流的测试配置,测试信号发生器产生16.6 Hz~20 kHz干扰信号,并以扫频或在某些频点停留若干时间等形式通过C端加载到组织等效接口电路上。干扰信号有两种形式,一是幅度为1 V的正弦信号,另一为载波频率500 kHz,调制信号为频率130 Hz的正弦信号,其中调制波的最大幅度为2 V,调制系数为95%(如图2所示)。
根据不同起搏器类型和电极类型F、G、J分别用来连接起搏器电极和外壳(图3为单极双腔起搏器的连接方法),两个示波器用于监视加载信号和感应电流信号。此配置用于测量在频率为16.6 Hz~20 kHz的干扰信号下起搏器的感应电流数值。
该测试配置的意义在于模拟起搏器或者植入起搏器的病人处于频率为16.6 Hz~20 kHz的电磁场环境中,起搏器是否会因感应电流过大而对起搏器或植入病人产生伤害。标准同时给出了感应电流的上限值。
前面以频率16.6 Hz~20 kHz的干扰信号为例,介绍了ISO14708-2标准27条款的大致测试规程。其他频段的测试方法和试验设计意义与它相同,只是对应的组织等效接口电路和加载的测试信号有所不同,在此就不再赘述。
此外,为避免起搏器或植入起搏器的病人处于磁场环境时会受到影响甚至遭受伤害,27条款按照静磁场和交变磁场两种情况给出了相关测试要求和方法。对于静磁场的测试需要信号发生器产生一个幅度为两倍于起搏器脉冲且频率相同的信号,按图4方式连接,S接起搏器输出端,T端接外壳。此时起搏器应被抑制,然后,将起搏器置于由励磁线圈产生的1~10mT的恒定磁场中1min,观察示波器是否有逃逸的起搏脉冲。以此方法检测起搏器功能是否受影响。
对于交变磁场,标准给出了测试仪器及相关正弦磁场强度的要求:
测试仪器:使用一个辐射线圈,直径≥12cm并且超过脉冲发生器最大径50%;一个校准线圈,直径≤4cm。辐射线圈应通过一个信号发生器供能,如图5所示。
测试场:测试磁场H应在频率f进行正弦调制,其关系如表2所示,检测起搏器在此磁场环境下功能是否受影响。

表2 正弦调制磁场强度
(2)标准AAMIPC69:2007中电磁兼容测试要求。
AAMIPC69的全称是“有源植入式医疗器械-电磁兼容性-植入式心脏起搏器和植入式心脏除颤器的EMC测试规程”,其是专门用于植入式心脏起搏器和心脏除颤器EMC测试的标准,其大部分内容与ISO14708-2标准的第27条款是一致的。它们的最大区别在于PC69标准明确了450 MHz~3 GHz频率范围的电磁干扰环境对植入式起搏器功能影响检测的试验方法,而ISO14708-2标准内只要求引用此项方法,而无具体内容。
AAMIPC69要求将起搏器置于躯干模体内,尔后加载干扰源,检测起搏器的相关功能是否正常。AAMIPC69所规定的躯干模体模拟人体心电环境,它是一个拥有2组电极的水箱,水箱的容积与人体躯干的体积相当,里面充满与人体体液密度相仿的盐溶液。信号发生器模拟心电信号通过一组电极注入体模,另外一组电极用来外接示波器监视起搏器的工作状态。将起搏器置于躯干模体内,起搏器上表面距液面0.5 cm,将起搏器导线按螺旋状排列并使之与起搏器在同一表面。此配置模拟出植入心脏起搏器的躯干。标准给出一例,如图6所示,图中上下两层网格起定位和支撑作用。在起搏器与导线连接处正上方2.5 cm处(即液面上方2 cm处),通过偶极子天线向起搏器辐射干扰场,频点分布在450~3000 MHz之间共13个,用以模拟实际生活或生产中可能遇到的频点,如移动电话、无线数据通信等。标准还明确规定了辐射信号诸如发射功率、是否调制、持续时间、辐射方向等。
此试验旨在检验植入式心脏起搏器在高频辐射场中是否能正常工作。通过辐射频率和辐射强度等参数的变化,在示波器中观察起搏脉冲是否正常。另外,AAMI PC69也规定了该试验环境的要求,如通过引用IEEEC95.1标准,推荐在电磁屏蔽室内完成该试验。
以上为关于心脏起搏器EMC测试的国际标准ISO14708-2:2005和AAMI PC96:2007的异同分析。
2.2 有源植入式心脏除颤器标准内容及要求对比
目前,有关有源植入式心脏除颤器的国际标准为ISO 14708-6:2010,欧洲颁布的标准为EN 45502-2-2:2008,而美国颁布的标准为AAMI PC69:2007。本章节分析了在上述标准中一些主要条款的异同点,详情见表3。

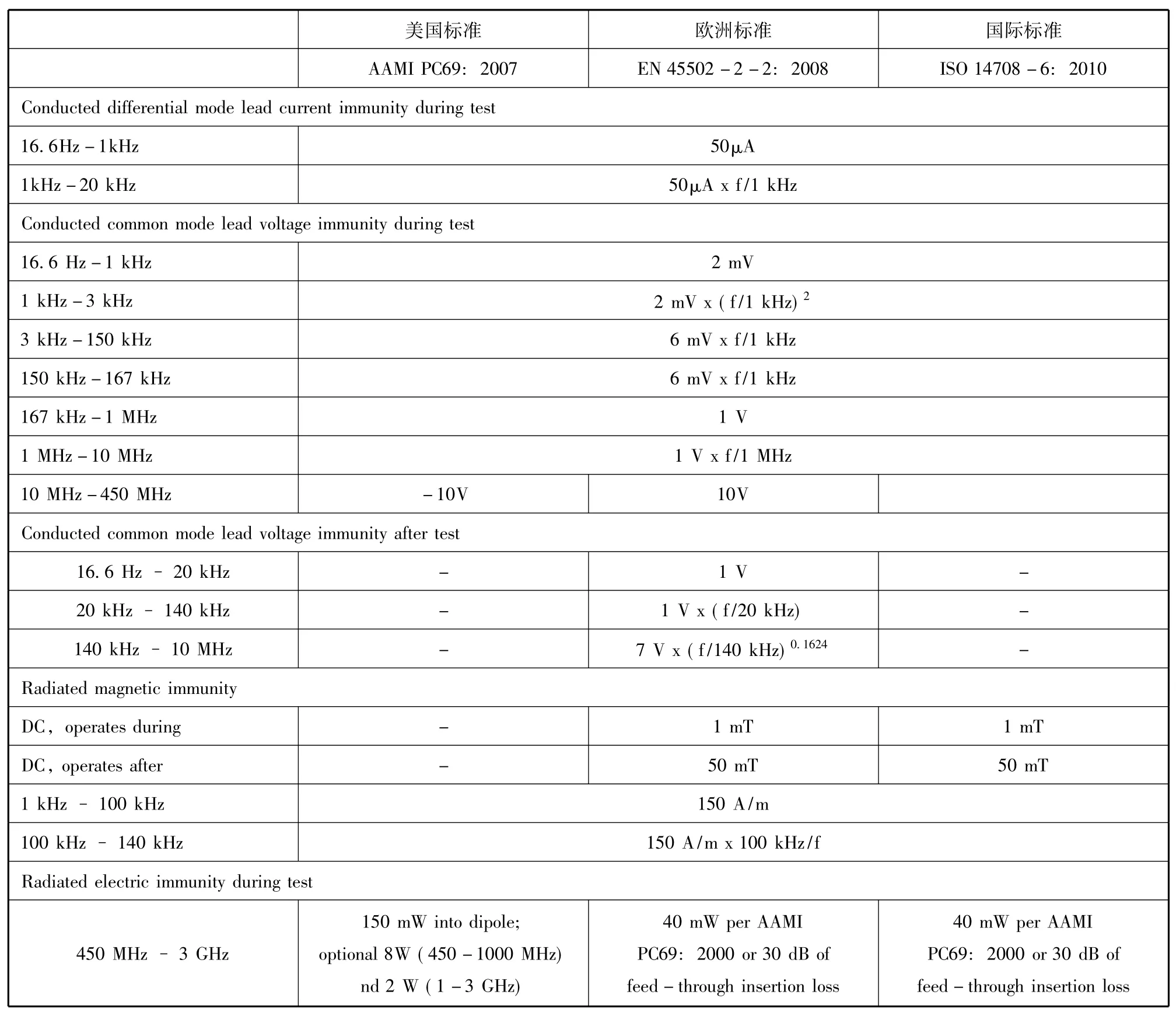
表3 有源植入式除颤器主要测试参数对比表
3 结束语
本文的研究为我国有源植入式医疗器械标准的制修订提供了技术支持,从而加速了我国有源植入式医疗器械国行标的转化速度,也使得我国相关医疗器械研发生产企业在研发过程中有据可依,提高了该类产品的电气安全、电磁兼容、机械冲击等安全指标,提升了我国有源植入式医疗器械产品的市场竞争力,减低该类产品的使用风险和不良事件发生的概率,保证人民大众的用械安全,打破我国市场上绝大多数此类产品被国外大公司所垄断的局面,同时填补国内该领域的空白。
[1]刘磊,高中.浅析国际标准对心脏起搏器电磁兼容测试的要求[J].中国医疗器械杂志,2010,34(5): 1-3.
[2]王梦蛟.心脏起搏器的发展及新技术[J].中国医疗器械信息,2008,14(8).
[3]《中国心脏起搏与心电生理杂志》编辑部,中国生物医学工程学会心脏起搏与电生理分会.埋置心脏起搏器及抗心律失常器指南(修订版)[J].中国心脏起搏与心电生理杂志,2003,17(5):1-17.
[4]吴永全主译:1-114《心脏起搏器图解阶梯教程》S.Serge Barold Roland X.Stroobandt Alfons F.Sinnaeve著.
[5]李路明,郝红伟.植入式神经刺激器的研究应用现状与发展趋势[J].中国医疗器械杂志,2009,33(2).
更正
本刊2014年第12期刊登的《急性上消化道出血患者的临床观察及急救护理》一文,第2作者杨婧后面的“通讯作者”四个字去掉。特此更正。
R197.39
A
1002-2376(2015)01-0005-04
2014-09-15
