鼠痘、小鼠肝炎和鼠仙台病毒感染症的国内流行情况及防控对策
2015-01-09仇保丰宋鸿雁董蓉莲顾炳泉刘文斌邵义祥高逢结
仇保丰,宋鸿雁,董蓉莲,顾炳泉,景 瑾,刘文斌,邵义祥,高逢结,李 建
(1. 南通出入境检验检疫局,江苏南通 226004;2. 南通大学实验动物中心,江苏南通 226001;3. 江苏省疾病预防控制中心,江苏南京 210009)
鼠痘、小鼠肝炎和鼠仙台病毒感染症的国内流行情况及防控对策
仇保丰1,宋鸿雁2,董蓉莲3,顾炳泉1,景 瑾2,刘文斌1,邵义祥2,高逢结1,李 建1
(1. 南通出入境检验检疫局,江苏南通 226004;2. 南通大学实验动物中心,江苏南通 226001;3. 江苏省疾病预防控制中心,江苏南京 210009)
为了解鼠痘、小鼠肝炎和鼠仙台病毒感染症这3种新纳入《中华人民共和国进境动物检疫疫病名录》鼠病在国内的流行情况,对这3种鼠病的文献资料进行了收集和分析。重点分析了3种鼠病在国内清洁级及以上级别的实验大、小鼠中的流行情况,同时对如何防控提出了建议和对策。这3种鼠病在国内清洁级或以上级别的实验大、小鼠中均有检出,应进一步提高实验大、小鼠屏障设施建设和管理的标准化和规范化水平,重视微生物监测的作用,有效提高实验大、小鼠的质量。
鼠痘;小鼠肝炎;鼠仙台病毒感染症;流行情况;预防;控制
2013年11月,农业部和国家质检总局联合发布了新版《中华人民共和国进境动物检疫疫病名录》(下文简称《名录》),与老版名录相比,其中一个重大的变化就是:淋巴细胞性脉络丛脑膜炎(lymphocytic choriomeningitis)、鼠痘(mouse pox)、小鼠肝炎(mouse hepatitis)和仙台病毒感染症(Sendai virus infection)这4 种鼠病首次被纳入新版《名录》中。由于淋巴细胞性脉络丛脑膜炎已引起广泛关注,本文不再赘述。但是,鼠痘、小鼠肝炎和仙台病毒感染症这3种鼠病无论在OIE的《陆生动物卫生法典》,还是在我国新版的《一、二、三类动物疫病病种名录》和《人兽共患传染病名录》中均未提及,因此关注程度不够,给口岸进境实验鼠的检验检疫工作带来了一定的困惑,也为实验大、小鼠的生产、保种和动物实验工作带来风险。本文对3种鼠病在国内的流行病学资料进行了系统的梳理和分析,可为加深对上述3种鼠病的认识、降低进境实验鼠的隔离检疫风险提供帮助,同时也为国内实验动物生产和使用单位了解相关疫病的流行现状,切实提高实验鼠的质量发挥一定的推动作用。
1 三种鼠病的概述及国内流行情况
实验动物按微生物学等级进行分类,可分为普通级(CV)、清洁级(CL)、无特定病原体级(SPF)和无菌级(GF)四个等级[1]。鼠痘、小鼠肝炎和仙台病毒感染症曾在我国普通级实验鼠中流行情况非常严重,但自2001年我国发布了取消使用普通级大、小鼠作为实验动物的国家标准后,普通级实验大、小鼠已逐渐退出实验动物的历史舞台,实验动物设施标准化建设、管理水平、工作人员的素质和技能等也得到逐年提高。由此可见,对普通级大、小鼠的原有疫病监测数据已经无法反映清洁级及其以上级别鼠群的健康状况。另外,现行国标《实验动物微生物学等级及监测》(GB 14922.2-2011)规定,鼠痘病毒、小鼠肝炎病毒和仙台病毒是清洁级及其以上级别小鼠的必检项目,仙台病毒是大鼠的必检项目,且以上检测结果均要求为阴性[1]。因此,本文在简要概述3种鼠病流行病学资料的基础上,重点梳理和分析国内清洁级及其以上级别的实验大、小鼠中3种鼠病的监测结果,为了解在屏障系统饲养的大、小鼠中的流行情况,提供更有参考价值的资料信息。
1.1 鼠痘
鼠痘又名小鼠脱脚病(ectromelia),是小鼠的一种常见急性传染病,由鼠痘病毒(mouse pox virus,MPV)或称为小鼠传染性脱脚病病毒(infectious ectromelia virus,ECTV)引起,特征是感染后不但引起全身或局部皮肤痘疹,还发生肢体末端皮肤坏死坏疽,使之发生脱脚、断尾和外耳缺损等病状。本病多呈暴发性流行,致死率可达95%,常造成全群淘汰,危害很大。1930年,Marchal等首先在英国报道本病[2],1947年Fenner将本病命名为鼠痘。鼠痘病毒为痘病毒科正黏液病毒属的成员,主要通过接触进行传播,也可经皮肤伤口、消化道和呼吸道传播。各种年龄的小鼠均易感,但不同品系的鼠对本病的易感性存在差异。大鼠对本病毒有一定的抵抗力。
1951年汤飞凡等首次报道了我国鼠痘的发生情况,随后多位学者分别报道了我国不同地区鼠痘的流行情况并做了病毒分离和鉴定[2]。本文通过对现有的文献资料进行梳理和总结发现(表1),我国CL和SPF级实验小鼠中鼠痘的控制情况总体较好:一方面,在现有的7篇报道中,仅有2篇检出阳性鼠群,检出阳性鼠群的总体频率较低;另一方,在阳性鼠群中检出的阳性鼠比率也比较低,均低于0.5%。但是,我们同时也应该注意到,国内公开报道的关于鼠痘的监测数据总体偏少,特别是我国取消普通级实验大、小鼠作为实验动物以后的监测数据更少,针对无菌级小鼠的相关数据也尚未发现,这非常不利于对当前实验鼠中鼠痘的流行情况做出准确判断,也不利于推动鼠痘的研究、监测和防控工作,这需要引起实验大、小鼠生产、使用和监管单位的重视。
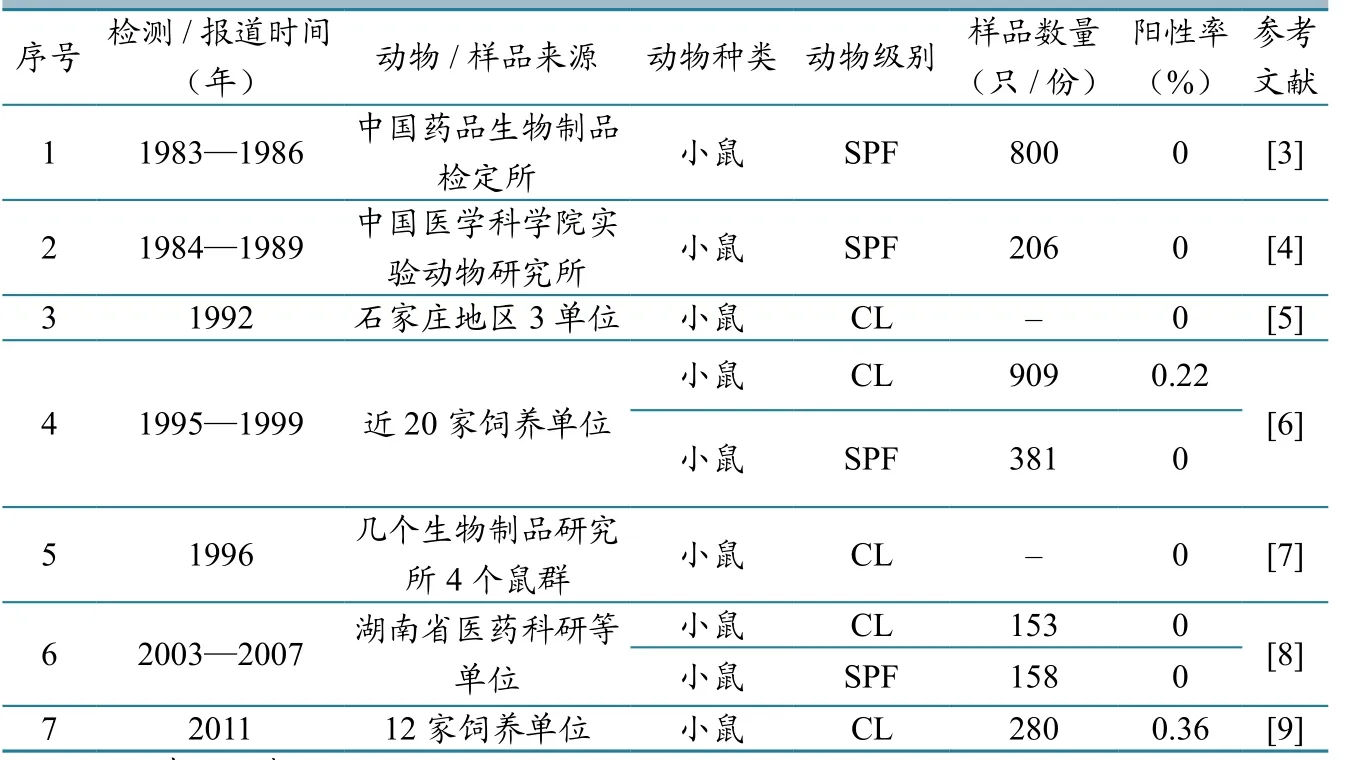
表1 国内清洁级及其以上级别实验小鼠中鼠痘的监测情况
1.2 小鼠肝炎
小鼠肝炎是由小鼠肝炎病毒(mouse hepatitis virus,MHV)引起的一种传染病。1949年Cheever首次在后肢瘫痪小鼠脑中分离到MHV-JHM株,以后又鉴定出许多毒株。MHV属于冠状病毒科冠状病毒属的成员,主要经过空气和接触传播,在自然界小鼠是其唯一易感动物,但可经脑接种感染棉鼠、大鼠和仓鼠。带毒小鼠分布于全世界,正常情况下呈隐性感染,在一些应激因素作用下可激发为急性致死病变,临床表现为肝炎、脑炎和肠炎,能严重影响实验小鼠的质量和实验结果,是对实验小鼠危害最为严重的病毒病之一[8-9]。
我国于1979年在裸鼠中发现小鼠肝炎,并分离到病毒,1982年经血清流行病学调查,发现我国普通小鼠群中小鼠肝炎的感染率为20%~100%[10]。据对公开发表的文献资料进行梳理和总结发现(表2),我国CL和SPF级实验小鼠中,不同时间、不同单位和不同等级的实验小鼠的监测结果也不尽相同,但是不难看出,MHV感染情况依然比较普遍,而且部分单位的实验小鼠中检出小鼠肝炎的阳性率还比较高。尤其值得关注的是,随着我国对实验动物生产单位软硬件要求的不断提高,CL和SPF级实验小鼠中MHV感染情况并没有出现大幅下降,甚至出现反弹。这应该引起我们的反思,积极查找不足,加强监督和管理,切实提高实验小鼠的质量。

表2 国内清洁级及其以上级别实验小鼠中小鼠肝炎的监测情况
1.3 鼠仙台病毒感染症
鼠仙台病毒感染症是由仙台病毒(Sendai virus,SV)引起的小鼠、大鼠及仓鼠等实验动物的一种呼吸道传染病。本病的主要特征是:传播速度快、流行范围广,仔鼠、幼鼠表现为急性肺炎,成年鼠为隐性感染。1952年,日本仙台市婴儿发生肺炎,1953年Kuroya等首次从病儿肺组织分离到病毒[2]。世界各地小鼠携带仙台病毒的现象非常普遍。SV又称鼠副流感病毒Ⅰ型,属于副黏病毒科副黏病毒属成员。病鼠和隐性感染鼠是主要传染源,本病毒主要通过直接接触和空气进行传播,由于传染性极强且容易扩散,是实验用鼠中最难控制的疫病之一[2,8]。在自然条件下,病毒可感染小鼠、大鼠、地鼠等动物,也可感染人类,并引起呼吸道疾病。
1956年我国也分离到本病毒[2],随后长春、武汉、北京、上海等地多次在实验动物中分离到本病毒。通过对历年来的文献报道进行总结发现(表3),我国清洁级及其以上级别的实验大、小鼠中SV的感染情况也不容乐观,尤其是近10多年来,我国实验大、小鼠中检出SV感染的鼠群数量和样品阳性率均比较高。SV是实验用鼠最难控制的病毒之一,动物一旦感染该病毒很难清除,常形成隐性感染,造成免疫系统紊乱,并在体内产生一系列类似癌变的组织学改变,对实验研究带来严重干扰。SV感染还会影响母鼠妊娠,妨碍胎鼠发育,引起乳鼠死亡率增加等,甚至感染人类[8]。因此,系统、全面地开展实验鼠群的SV监测,澄清SV在我国实验鼠中的流行现状,积极消除隐患,进一步提高实验鼠的数量,是当前一项不容回避的任务。
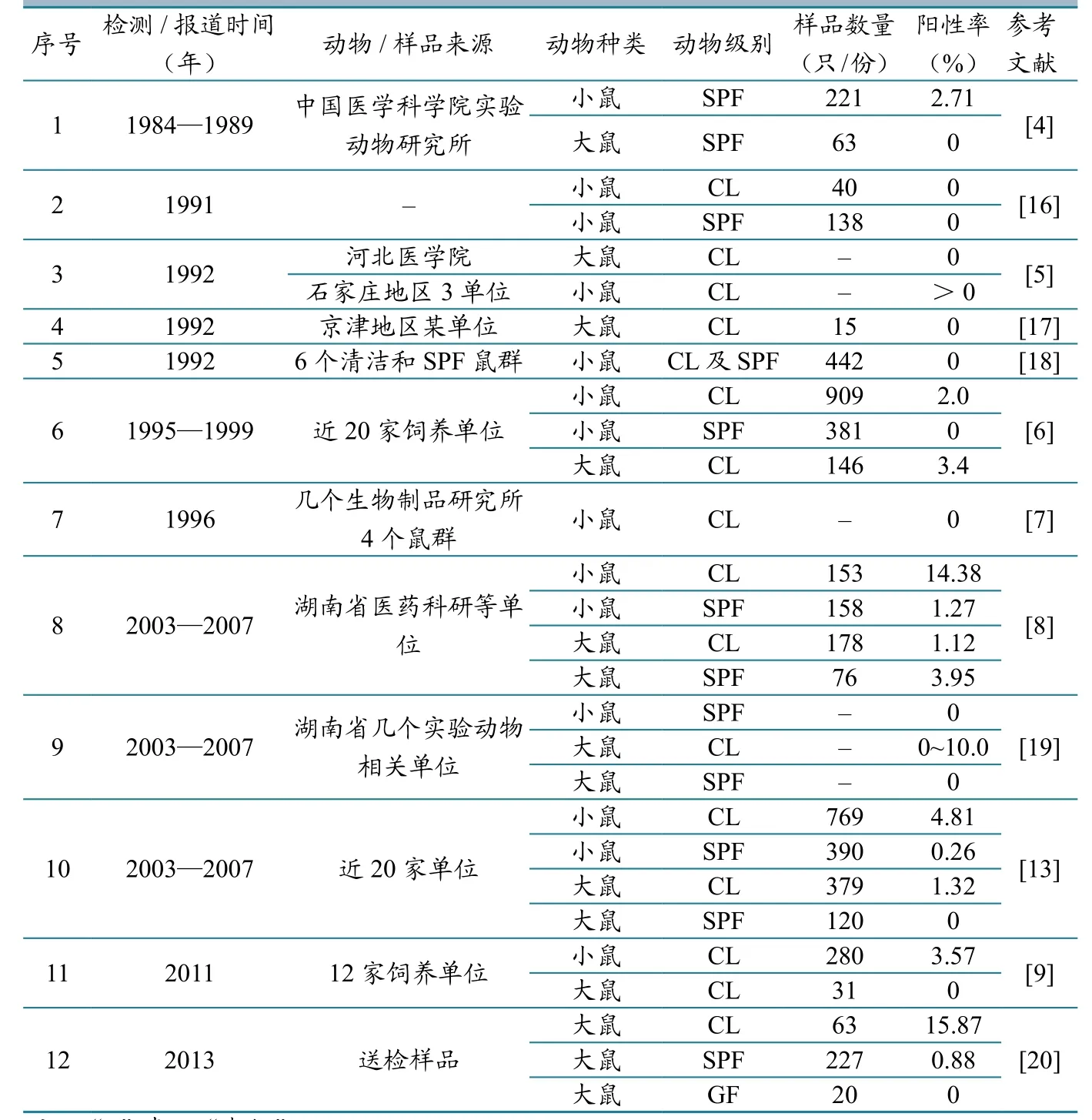
表3 国内清洁级及其以上级别实验大、小鼠中鼠仙台病毒感染症的监测情况
2 防控建议
鼠痘、小鼠肝炎和鼠仙台病毒感染症这3种鼠病具有传播速度快、流行范围广和危害大的特点,可以对实验大、小鼠的质量提高造成严重影响。正因如此,国际实验动物科学协会(ICLAS)检测中心根据已知可感染小鼠的微生物和寄生虫的毒力强弱,将它们分为A-E共5个等级,其中MPV、MHV和SV均被划分为B级,即,可引起鼠类死亡的致死性病原体。自2001年我国取消普通级实验大、小鼠作为实验动物以来,对实验用大、小鼠的饲养环境及设施、质量管理和监测、人员素质和技能等的要求越来越严格、规范,目的正是不断提高实验大、小鼠的质量。但是,根据对相关监测数据的梳理和分析发现,这3种鼠病在国内清洁级或其以上级别的实验大、小鼠均有检出,甚至阳性率较高。因此,屏障系统内饲养的大、小鼠也并不能简单与高质量、高等级实验动物画等号,要切实提高实验大、小鼠的质量并达到相应级别的要求,以下几项工作仍需进一步加强:
2.1 加强环境设施等“硬件”的标准化建设
实验动物环境及设施即实验动物赖以生存的“硬件”环境,是保障不同级别实验动物质量达标和相应级别动物实验顺利开展的重要条件。刘香梅等在工作中发现,屏障设施的空气高效过滤器密封不严、堵塞和气体倒流等问题均可能会导致MHV随气流传入屏障设施[10]。因此,要严格按照《实验动物管理条例》、《实验动物质量管理办法》、《实验动物许可证管理办法》和《实验动物 环境及设施》(GB 14925-2010)等部门规章和技术标准的规定,认真开展实验大、小鼠的生产、实验场所的环境条件及设施的规划、设计、施工、检测、验收和监督管理工作,不断加强屏障环境和隔离环境等“硬件条件”标准化建设,对于不符合国家法律法规、部门规章和技术标准等的环境和设施,视具体情形,严格按照有关规定,给予不予办理实验动物生产(使用)许可证、予以警告处分、收回或吊销许可证等处置措施;情节恶劣、造成严重后果的,依法追究行政责任和法律责任。加强环境设施的标准化建设可以为严防鼠痘、小鼠肝炎和鼠仙台病毒感染症等微生物的传入和传出提供可靠的物理屏障。
2.2 加强管理制度等“软件”的规范化建设
建立健全与实验动物环境设施等“硬件”相配套的规范化质量管理体系,是保证屏障设施和质量管理工作能有效运行的重要“软件”。魏巍等通过对清洁级大、小鼠的SV、MHV和MPV等病毒血清抗体进行检测和分析认为,小鼠病毒感染现象的出现可能是由于生产单位管理不善造成的,提出要在杜绝传染源、切断传播途径、加强人员管理和培训等方面多做努力[9]。刘香梅等认为MHV传入屏障设施的可能途径主要有气流、人流和物流三种,同时要防止屏障设施内MHV的传播,提示实验动物管理人员、饲养人员在实际操作过程中注意加强对小鼠肝炎病毒的预防控制[10]。因此,要根据国家有关实验大、小鼠及其屏障设施的标准、法律法规,系统全面地建立科学化、规范化的管理制度,如管理组织机构、人员分工和岗位职责,人员专业培训和岗位资质管理度,人员健康体检制度,实验鼠设施管理制度及标准操作规程等。同时,要按照国家规定制定严密的实验大、鼠引种、保种和隔离检疫制度。因为鼠痘、小鼠肝炎和鼠仙台病毒感染症目前尚无治疗办法,鼠群被污染后往往需要采取全群淘汰的手段进行净化,常常造成巨大的经济损失。
因此,实验大、小鼠生产单位应尽量坚持自繁自养,确需从国内外其他单位引种的,除了需要按照国家规定办理相关手续和要求对方提供相应证明材料外,要严格按照隔离检疫制度和防疫消毒制度执行,严防病原体通过人流、物流和气流传播。加强管理制度等“软件”的规范化建设,是确保实验大、小鼠环境设施正常运转的重要条件,因此,各项管理制度一旦建立,必须严格执行,为切实提高实验大、小鼠的质量目标发挥作用。
2.3 重视微生物监测的“把关”作用
定期对实验动物进行微生物监测,既是检验饲养动物环境设施及管理最终结果和评价实验动物质量的重要依据,也是保证实验动物质量和动物实验结果准确、科学、可靠的有效措施[6,9]。MPV、MHV和SV感染实验鼠后常呈无临床症状的隐性或慢性感染,一定条件下才引起发病,因此要通过定期监测才能及时发现[6,8,10]。但长期以来并未引起人们的足够重视,一方面,使用实验动物的科研人员对实验动物的健康状况重视程度不够,对外观健康的实验大、鼠很少进行上述3 种鼠病的检测;另一方面,实验动物生产、销售单位从自身利益等角度出发,对实验小鼠、大鼠的疫病监测不到位,从而造成一些隐性感染疾病的流行和暴发,同时也导致我国实验大、小鼠的疫病检测数据比较匮乏,不能客观反应我国现有实验大、小鼠的带毒状况。
因此,实验大、小鼠的生产、销售单位和监管部门必须认真履行职责,按照实验动物微生物监测的规范程序,严格采样,认真施检,确保监测数据真实、准确。同时,要增加相关疫病监测结果的透明度,积极宣传相关鼠病的对鼠群健康和动物实验的危害,以引起实验大、小鼠生产供应单位和动物实验人员的重视,从而为全面推动鼠病监测、防控和鼠群净化的科研和实践创造条件,最终为进一步提高实验大、小鼠的质量打下坚实基础。
Domestic Prevalence of Mouse Pox,Mouse Hepatitis and Sendai Virus Infection and the Prevention and Control Measures
Qiu Baofeng1,Song Hongyan2,Dong Ronglian3,Gu Bingquan1,Jing Jin2,Liu Wenbin1,Shao Yixiang2,Gao Fengjie1,Li Jian1
(1.Nantong Entry-Exit Inspection and Quarantine Bureau,Nantong,Jiangsu 226004;2. Laboratory Animal Center of Nantong University,Nantong,Jiangsu 226001;3. Jiangsu Center for Disease Control and Prevention,Nanjing,Jiangsu 210009)
[Objective]To deepen the recognition of mouse pox,mouse hepatitis and Sendai virus infection,which were included in the latest version of “List of Quarantine Diseases for the Animals Imported to the People’s Republic of China” and understand their epidemic situation in domestic laboratory mice and rats.[Methods]The epidemiological data regarding mouse pox,mouse hepatitis and Sendai virus infection were collected and analyzed.[Results]A general overview of the epidemiological data was provided to these diseases respectively with particular emphasis on the epidemiological status of the three diseases in domestic laboratory mice and rats of clean or above grade. Suggestions and countermeasures for prevention and control of the three diseases were put forward.[Conclusion]All the three diseases mentioned above have been detected among laboratory mice and rats of clean or above grade in China. In order to efficiently improve the laboratory mice and rat quality,the construction and management of laboratory animal barrier facility should be further standardized,and the pathogen monitoring must be given particular attention.
mouse pox;mouse hepatitis;Sendai virus infection;epidemic situation;prevention; control
R541.7
A
1005-944X(2015)10-0009-06
江苏检验检疫局科研项目(2013KJ03)、国家认监委行标制修订项目(2013B031)共同资助
[1]国家质量监督检验检疫总局,国家标准化管理委员会.GB l4922.2-2011,实验动物微生物学等级及监测[S].北京:中国标准出版社,2011.
[2]中国农业科学院哈尔滨兽医研究所.兽医微生物学[M].北京:中国农业出版社,1998,283-284,417.
[3]吴惠英,卫礼,贺争鸣,等.对鼠痘病毒抗体的血清学检测[J].畜牧兽医学报,1989,11(2):113-114.
[4]吴小闲,洪瑞珍,涂新明,等.实验小鼠和大鼠的病毒学监测(1984-1989)[J]. 中国实验动物学杂志,1993,21(3):8-11.
[5]吕占军,赵文政,王秀芳,等.ELISA检测法对石家庄地区大、小鼠病毒感染的调查[J]. 中国比较医学杂志,1992,22(3):106-106.
[6]应贤平,钱琴,屈霞琴,等.不同等级实验动物病毒学质量抽查结果分析[J]. 上海实验动物科学,2001,21(2):88-91.
[7]贺争鸣.生物制品系统实验动物微生物和寄生虫学检测报告[J]. 中国实验动物学杂志,1996,6(4):252-254.
[8]黄凰,戴德芳,黄一伟,等.湖南省2003-2007年实验大、小鼠病毒学监测结果[J]. 实用预防医学,2008,15(6):1926-1928.
[9]魏巍,刘霄磊,刘家森,等.大小鼠主要病毒血清抗体检测结果与分析[J]. 实验动物科学,2011,28(6):23-25.
[10]刘香梅,张钰,赵维波,等.广东省屏障设施小鼠群中小鼠肝炎病毒感染情况[J]. 中国比较医学杂志,2009,19(10):72-74.
[11]吴惠英,贺争鸣,卫礼,等.多价鼠肝炎病毒抗体ELISA试剂盒的研制及应用[J]. 中国生物制品学杂志,1993,6(1):14-17.
[12]杨邦玲,胡柏林,史晋,等.小鼠肝炎病毒抗体Dot-ELISA诊断试剂盒的研制[J].中国实验动物学杂志,1997,7(2):65-68.
[13]隋丽华,范薇,杨敬,等.实验动物微生物、寄生虫抽样调查及分析[J]. 实验动物与比较医学,2008,28(4):259-262.
[14]赖国旗,何明忠,谭毅,等.RT-PCR方法在实验小鼠肝炎病毒检测中的应用[J].西南农业大学学报(自然科学版),2004,26(3):289-290.
[15]许宝华,张玉珍,穆松牛,等.两种不同组织嗜性的小鼠肝炎病毒组合抗原检测抗体的间接ELISA方法[J]. 中国比较医学杂志,2006,16(8):495-498.
[16]徐蓓,钱琴,屈霞琴,等.仙台病毒抗体PPA-ELISA诊断试剂盒的研制和初步考核[J]. 上海实验动物科学,1991,11(3):129-132.
[17]刘佐民,贺争鸣,吴惠英,等.实验大鼠仙台病毒ELISA检测试剂盒的研制及其初步应用[J]. 北京实验动物科学,1992,9(2):4-7.
[18]贺争鸣,卫礼,吴惠英,等.实验小鼠Sendai病毒抗体ELISA方法标准化的研究[J]. 中国人兽共患病杂志,1992,8(4):13-15.
[19]周娉,董伟,刘建高,等.湖南省实验动物中几种常见的人兽共患病监测[J]. 中国比较医学杂志,2009,19(3):74-75.
[20]向志光,佟巍,李雨函,等.大鼠仙台病毒ELISA、间接免疫荧光和免疫印迹三种检测方法比较[J]. 中国比较医学杂志,2013,23(1):23-26.
王伟涛)
