甘草组培与栽培主要成分的提取及活性比较
2015-01-08满淑丽刘延涛郭松波高文远
满淑丽,刘延涛,张 咪,郭松波,高文远
(天津科技大学生物工程学院,天津 300457)
甘草(Glycyrrhiza uralensis Fisch)的化学成分复杂、药理作用显著,临床常协同其他药物使用.作为药用植物,甘草具有免疫调节、抗病毒、抗癌、抗炎、抗过敏、抗溃疡、抗衰老等多种生物活性作用[1].随着甘草使用量的不断加大、资源随之减少,组培甘草将成为可以解决供应紧张的栽培甘草的替代品.组培甘草的培养周期要短于栽培甘草,并且能产生大量的多糖、黄酮、三萜等有效成分.课题组前期已成功获得组培甘草[2],本文旨在研究比较栽培甘草与组培甘草之间提取物含量及抗氧化活性差异,最终探讨组培甘草辅助或替代栽培甘草的效果及可行性.
1 材料与方法
1.1 实验原料
栽培甘草购自天津同仁堂药店,悬浮培养细胞甘草种子由北京时珍中草药研究所提供,经天津大学药物科学与技术学院高文远教授鉴定为乌拉尔甘草(G.uralensis Fisch)的种子.甘草悬浮细胞采用两步培养方式培养,具体方法参考文献[2].
1.2 试剂与仪器
香草醛,天津市元立化工有限公司;蒽酮(分析纯),国药集团化学试剂有限公司;抗坏血酸,天津市福晨化学试剂厂;吐温40、亚油酸,天津市光复精细化工研究所;1,1-二苯基-2-三硝基苯(DPPH),Sigma 公司;其余试剂均为分析纯.
LAEOROTA 4000 型旋转蒸发仪,德国Heidolph公司;SHZ-DⅢ型循环水式真空泵,巩义市于华仪器有限责任公司;酶标仪,基因有限公司;TU-1810 型紫外-可见光分光光度计,北京市普斯通科技有限责任公司;TD6M 型台式低速离心机,盐城市凯特仪器有限公司.
1.3 实验方法
1.3.1 甘草水提物(甘草多糖)
取经粗研磨的组培甘草和栽培甘草粉末制成甘草提取液,4,000,r/min 离心 12,min,取上清液于70,℃、60,r/min 旋转蒸发浓缩.收集所得栽培甘草浓缩液.在4 倍体积的无水乙醇中加入栽培甘草浓缩液,静置出现絮状沉淀.经离心处理收集沉淀,干燥后得到甘草粗多糖.
Sevag 法脱蛋白:加入1/4 体积的氯仿-正丁醇(4∶1)溶液剧烈振荡15,min,静止分层后弃有机层,离心除水去掉水层和溶剂层交界处的变性蛋白质,重复操作5 次,合并上清液,测量其蛋白质含量和多糖含量.将所得脱蛋白多糖再次醇沉,干燥后得到精制的栽培甘草多糖和组培甘草多糖.
1.3.2 甘草醇提物(黄酮类)
称取栽培甘草和组培甘草样品各100,g,用80%,乙醇进行提取,料液比(g∶mL)为1∶20,静置1,h后,超声处理30,min,68,℃水浴2,h,冷却后过滤,对提取过的滤渣用0.5%,的氨性乙醇提取(乙醇60%,),料液比(g∶mL)为1∶20,静置12,h 后,68,℃水浴1,h 抽滤,合并3 次提取的滤液,浓缩干燥后得到的甘草浸膏即为实验所需甘草醇提物.
1.3.3 甘草中各有效部位的含量分析
甘草多糖含量的测定:分别称取干燥的栽培甘草多糖和组培甘草多糖样品.参考孟娟[3]的方法,以葡萄糖为标准品,采用硫酸蒽酮法测定多糖含量,做3组平行实验.
皂苷含量的测定:参考兰霞等[4]的方法.分别取栽培甘草和组培甘草醇提物各20,mg,加甲醇溶解并定容至10,mL,取组培甘草样品溶液2,mL、栽培甘草样品溶液500,µL 水浴挥干,以香草醛-冰醋酸为标准品,采用香草醛-高氯酸比色法测定皂苷含量,测定吸光度,做3 组平行实验.
总黄酮含量的测定:分别取栽培甘草和组培甘草醇提物各25,mg,加蒸馏水溶解并定容至25,mL,取栽培甘草和组培甘草样品溶液各1,mL,置于10,mL容量瓶中,参考前期报道[5]方法,测定吸光度,做3 组平行实验.
1.3.4 甘草的抗氧化活性研究实验
普鲁士兰法:参考李东海等[6]的方法.分别将栽培甘草和组培甘草的样品配制成15,mg/mL 的待测样品溶液,按测定抗坏血酸标准曲线的步骤,在700,nm 处测其吸光度,做3 组平行实验.
水杨酸比色法:将栽培甘草和组培甘草各配制出0.5、1、2、4、6,mg/mL这5个梯度的样品溶液.参考袁建梅等[7]的方法,并做适当调整,做3 组平行实验.
DPPH 清除自由基法:参考张丹参等[8]的方法,并进行适当调整选取合适的样品浓度.分别吸取0.4、0.8、1.2、1.6、2.0,mL 于试管中,并用无水乙醇定容至2,mL.加入1.0,mL DPPH 试剂后,37,℃反应30,min,于517,nm 处测定吸光度.
β-胡萝卜素褪黑法:参考黄海兰等[9]的方法,并进行适当的调整.取样品溶液0.5,mL,加入5,mL 的β-胡萝卜素-亚油酸乳化液,以蒸馏水为空白对照组.样品加入后开始于470,nm 处测量吸光度,此时记为0,min,之后每20,min 测1 次至120,min 结束.期间将反应试管置于50,℃水浴中保温.
1.3.5 统计学处理
实验数据以平均值±标准差表示,采用SPSS19.0软件处理,采用 t 检验分析数据.
2 结果与讨论
2.1 甘草活性成分的含量分析
2.1.1 甘草多糖
本实验采用栽培甘草和组培甘草粉末分别为150,g 和100,g.经粗提取和精制后多糖质量分别为2.04,g 和5.20,g.
依据硫酸-蒽酮比色法,在585,nm 处测量进行比色,得到样品的吸光度.结果显示,组培甘草中分离得到的精制甘草多糖高于栽培甘草,存在显著性差异(P<0.05),它们分别为(21.6±0.1)%,和(19.2±0.2)%,.
2.1.2 甘草皂苷和黄酮含量测定
植物组织培养基技术作为一种高效的生物技术已经在生产很多植物次生代谢产物得到了应用[10].通过测定,组培甘草的总皂苷含量为(7.0±0.2)%,,栽培甘草的总皂苷含量为(45.4±1.1)%,;通过紫外-可见光分光光度计,在400,nm 下测得组培甘草的总黄酮含量为(31.2±1.5)%,,栽培甘草的总黄酮含量为(30.6±1.9)%.
2.2 抗氧化活性实验
2.2.1 普鲁士兰法
根据抗坏血酸标准曲线得出线性回归方程为y=0.003,0,x+0.161,3,相关系数R2=0.999,2,该方法呈现良好线性关系,测定结果见表1.
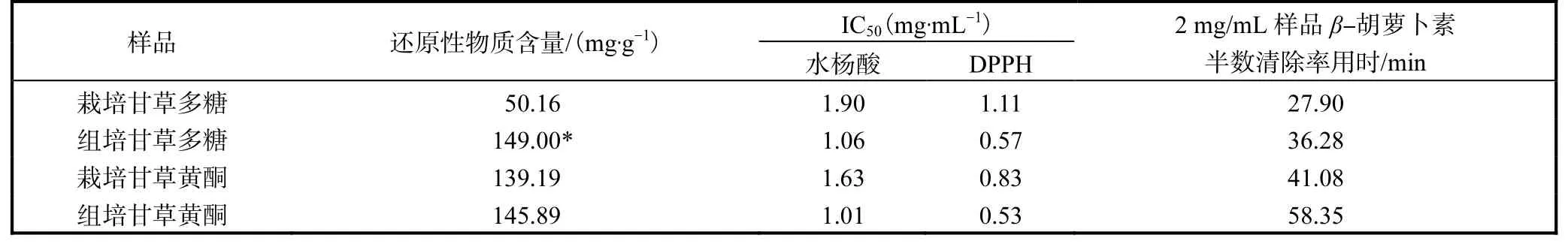
表1 栽培甘草和组培甘草中各成分抗氧化活性比较Tab.1 Comparison of the antioxidization activity of each component
由表1 可知,栽培甘草醇提物与组培甘草醇提物当中的还原物质含量相当,不存在显著性差异.而精制多糖中,组培甘草显著高于栽培品种.
2.2.2 水杨酸比色法
通过实验对4 种样品的氧自由基清除能力进行比较,结果如图1 所示.在实验研究的质量浓度范围内,4 种样品对氧自由基的清除能力随质量浓度的增大而上升,且在实验的质量浓度范围内,组培甘草醇提物抗氧化能力最强,其次为栽培甘草醇提物,再次为组培甘草多糖,抗氧化能力最弱的为栽培甘草多糖.
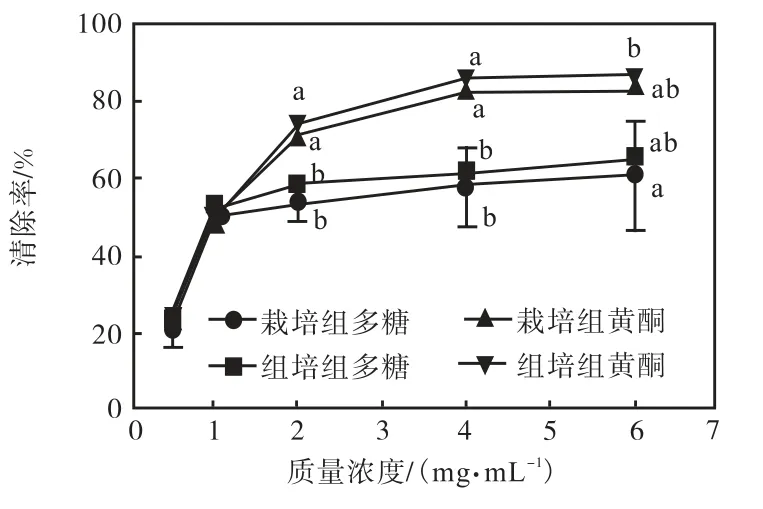
图1 4种样品对羟基自由基清除率曲线Fig.1 Curves of hydroxyl radical scavenging rate
2.2.3 DPPH 清除自由基法
由图2 可知,4 种样品对DPPH 自由基均有明显清除效果,在较低浓度时,4 种样品对DPPH 的清除率呈现近似线性关系,栽培甘草多糖与组培甘草黄酮此时清除率较为近似、栽培甘草黄酮与组培甘草黄酮之间的清除率较为近似,甘草中多糖与黄酮的清除率差距较大.
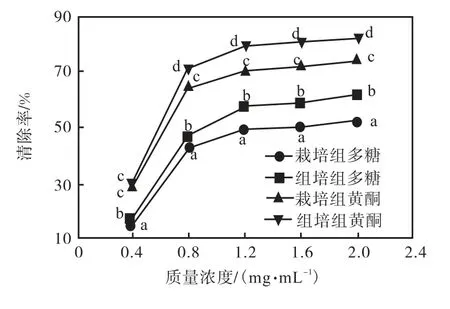
图2 4种样品对DPPH的清除率曲线Fig.2 Curves of DPPH scavenging rate
为准确量化对4 种样品清除DPPH 能力的大小,应用SPSS 软件计算清除率达到50%,的时候的IC50值(见表1).IC50值越小,则证明该样品对DPPH清除能力越强,抗氧化能力也越强.
综上,清除DPPH 的能力为:组培甘草黄酮>栽培甘草黄酮>组培甘草多糖>栽培甘草多糖.
2.2.4 β-胡萝卜素褪黑素法
图3 为2,mg/mL 样品组所测得的抗氧化活性结果.结果显示抗氧化活性最高的为栽培甘草多糖,其次为栽培甘草黄酮,再次为组培甘草多糖,最弱的是组培甘草黄酮.
为量化比较样品的抗氧化能力,分别计算出两个样品组清除率达到50%,所需时间.2 mg/mL 样品组结果见表1.
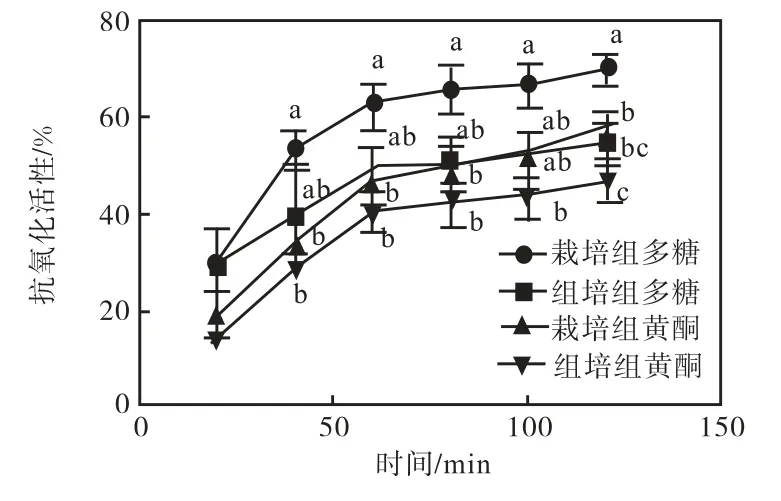
图3 β-胡萝卜素褪黑素法抑制曲线Fig.3 Curves of β-carotene melatonin suppression
根据表1 可以看出,总还原力比较中,组培甘草黄酮与栽培甘草黄酮活性相当,组培甘草多糖显著高于栽培甘草多糖.水杨酸及DPPH 实验均基于自由基清除原理,通过活性分析发现抗氧化效果较好的是组培甘草黄酮和组培甘草多糖;β-胡萝卜素-亚油酸模型表明栽培甘草多糖与组培甘草多糖均具有较强的抗氧化活性.由于以上模型的抗氧化机制不同,因此,组培甘草可能主要通过自由基清除和总还原性物质含量较高等发挥抗氧化活性.
3 结论
组培甘草多糖含量显著高于栽培甘草多糖,而组培甘草皂苷类含量显著性低于栽培甘草;黄酮类成分两者含量相当,不存在显著性差异.因此在开发其活性时更侧重于对甘草多糖及黄酮类活性的研究.通过抗氧化活性实验表明,组培甘草和栽培甘草黄酮活性相当,组培甘草多糖显著强于栽培甘草多糖.水杨酸及DPPH 实验均基于自由基清除原理,通过活性分析发现抗氧化效果较好的是组培甘草黄酮和多糖;β-胡萝卜素亚油酸模型表明栽培甘草和组培甘草多糖均具有较强抗氧化活性.由于以上模型的抗氧化机制不同,因此,组培甘草可能主要通过自由基清除和总还原性物质含量较高等发挥抗氧化活性.总之,组培甘草的各个有效部位均显示较好的抗氧化活性,因此,研究发现悬浮细胞技术将作为一个新的途径使辅助或替代栽培甘草成为一种可能.
[1]Asl M N,Hosseinzadeh H.Review of pharmacological effects of Glycyrrhiza sp.and its bioactive compounds[J].Phytotherapy Research,2008,22(6):709-724.
[2]Guo Songbo,Man Shuli,Gao Wenyuan,et al.Production of flavonoids and polysaccharide by adding elicitor in different cellular cultivation processes of Glycyrrhiza uralensis Fisch[J].Acta Physiologiae Plantarum,2013,35(3):679-686.
[3]孟娟.蒽酮-硫酸比色法测定甘草残渣中多糖含量[J].天津化工,2011,25(5):45-46.
[4]兰霞,王洪新.比色法测定甘草中总皂苷的含量[J].时珍国医医药,2007,18(4):886-887.
[5]Man Shuli,Wang Juan,Gao Wenyuan,et al.Chemical analysis and anti-inflammatory comparison of the cell culture of Glycyrrhiza with its field cultivated variety[J].Food Chemistry,2013,136(2):513-517.
[6]李东海,杨发忠,代红娟,等.叶下花黄酮抗氧化活性研究[J].云南化工,2009,36(2):32-35.
[7]袁建梅,尚学芳,汪应灵,等.谷精草总黄酮提取及对羟自由基清除作用研究[J].时珍国医国药,2010,21(4):894-895.
[8]张丹参,张天泰,杜冠华.均匀设计高通量筛选技术在中药丹参多成分配比研究中的应用[J].中国药学杂志,2009,44(14):1048-1052.
[9]黄海兰,赵祖亮,王斌贵.磷钼络合物法与β-胡萝卜素-亚油酸法测定海藻脂类成分抗氧化活性的比较[J].中国石油,2005,30(3):32-35.
[10]Wang Juan,Man Shuli,Gao Wenyuan,et al.Cluster analysis of Ginseng tissue cultures,dynamic change of growth,total saponins,specific oxygen uptake rate in bioreactor and immunoregulative effect of ginseng adventitious root [J].Industrial Crops and Products,2013,41:57-63.
