壳聚糖对新鲜银耳保鲜及活性氧代谢影响研究
2015-01-08邓丽莉谭红军石文娟
罗 杨 ,杨 勇,* ,吴 振,邓丽莉,陈 岗,谭红军,,詹 永,石文娟
1重庆市中药研究院,重庆 400065;2 西南大学食品科学学院,重庆 400715;3重庆市银耳营养食品企业工程技术研究中心,重庆 409003
银耳(Tremella fuciformis),又名白木耳、雪耳,历来同人参、鹿茸、燕窝齐名,其含有多糖、酚类、黄酮类和多种氨基酸等生物活性成分,是一种传统的高级滋补品和甜食珍品。银耳药性平和,服用安全;中医认为,银耳味甘淡性平,归肺、胃经,具有滋阴润肺、养胃生津的功效[1]。银耳含有丰富的营养成分,其鲜品水分含量极高,采收前后都极易感染病害,导致霉变腐烂,贮藏保鲜难度大,所以银耳一般只以干制品形式出售,产品出路少,附加值低,感官品质和营养价值较鲜品大幅下降。因此,研究适于新鲜银耳采后保鲜的天然保鲜剂具有重要意义。
壳聚糖(Chitosan,CTS)是一种资源丰富的甲壳类动物天然提取物,是由甲壳素脱去乙酰基形成的带阳离子的多糖,无味、无毒、安全,对人体具有一定的生理保健功能,为可食性物质。壳聚糖良好的成膜性和抗菌性,可降低机体组织中活性氧的形成,延缓细胞衰亡并保持其质量[2]。壳聚糖广泛应用于果蔬保鲜领域,在食用菌中也有应用[3]。有研究表明壳聚糖能诱导提高双孢蘑菇和白灵菇的SOD 和CAT 活性[4,5]。目前,新鲜银耳贮藏保鲜相关研究很少,本文在壳聚糖对新鲜银耳有良好的保鲜作用基础上,研究壳聚糖保鲜剂对银耳的活性氧代谢的影响,探讨壳聚糖对新鲜银耳贮藏保鲜机理,为壳聚糖在新鲜银耳保鲜领域应用提供理论参考依据。
1 材料与方法
1.1 材料
银耳:采摘自朵朵润尔营养食品股份有限公司袋料银耳智能培养标准间,菌种为朵朵3 号,选取已除蒂、朵形硬实饱满、表面光洁、无病虫害、大小一致、外形佳且无机械损伤的新鲜银耳。
1.2 主要仪器与试剂
主要仪器:UV1000 紫外分光光度计(上海天美科学仪器有限公司),3H16R1 高速冷冻离心机(湖南赫西仪器装备有限公司),HWS-26 电热恒温水浴锅(上海齐欣科学仪器有限公司),DW-FL 超低温冷冻储存箱(合肥美菱股份有限公司),FA2004B 电子天平(上海精科天美科学仪器有限公司)。
包装材料:保鲜用圆形带盖碗盒,PP5 材质,口径×底径×高=185 mm ×150 mm ×88 mm,佛山市顺德区泓生吸塑包装有限公司。
主要试剂:壳聚糖(食品级,脱乙酰度50%~60%,黏度200 mps,山东潍坊海之源生物科技有限公司)。
1.3 保鲜处理
选取质量为130~150 g/朵的鲜银耳,清除菌体表面的杂质,喷洒浓度为0.3%壳聚糖和0.05%柠檬酸配置而成的保鲜液20 次(每次剂量为1 mL)。对照组以蒸馏水喷洒20 次(每次剂量为1 mL)。待银耳表面液体自然吸收沥干后,将其放入PE 材质的塑料保鲜盒中(每个盒子装1 朵银耳),覆上PE保鲜膜,置于室温20 ±2 ℃,相对湿度80%的环境中贮藏22 d,定期观察及取样测定。
1.4 测定方法
1.4.1 银耳发病病情指数测定

0 级:全朵无病;1 级:全朵1/4 以下的耳片有少数病斑;2 级:全朵1/2 以下的耳片有少量病斑或1/4 以下的耳片有较多的病斑数;3 级:全朵3/4 以下的耳片发病或全朵1/4 以下的耳片完全霉变腐烂;4级:全朵3/4 以上的耳片发病或全朵1/2 以下的耳片完全霉变腐烂~整朵霉变腐烂。
1.4.2 过氧化物酶(POD)和多酚氧化酶(PPO)的提取及活力测定
参照Zauberman 的方法测定并改进[6]。取1.0 g 鲜银耳样品,在冰浴条件下研磨成匀浆,于4 ℃、12000 rpm 离心15 min。分别在室温470 nm 和420 nm 时测定吸光值的变化,以每min 吸光值变化0.01 为一个酶活力单位(U)。重复三次。
参照王爱国的方法并作改进测定[7]。称取2.0 g 鲜银耳,在冰浴条件下研磨提取,离心(12000 rpm,20 min,4°C)。取1 mL 上清液,加入0.9 mL 磷酸缓冲液(pH 7.8)和0.1 mL 10 mM 的盐酸轻胺溶液,在25°C 混合并培养30 min。然后加入1 mL 17 mM 对氨基苯磺酸和1 mL α-萘胺,于25 ℃保温40 min。保温后加入4 mL 正丁醇充分摇动,静置分层后取正丁醇相在530 nm 处测定OD 值,重复三次。以KNO2溶液作标准曲线,按浓度的2 倍为的浓度,计算产生的速率,以μmol/min·gFW 表示。
1.4.4 过氧化氢(H2O2)含量测定
H2O2含量的测定参照Patterson 的方法进行测定并改进[8]。取1.0 g 鲜银耳样品,加入6.0 mL 经4 ℃预冷的丙酮,在通风橱中冰浴研磨充分,于4℃、12000 rpm 离心20 min,取0.5 mL 上清液,依次加入0.1 mL 10%四氯化钛-盐酸溶液和0.2 mL 的浓氨水,混合反5 min,于4 ℃、12000 rpm 离心15 min,沉淀用丙酮洗涤3 次,以消除色素干扰。最后将沉淀加入3.0 mL 2 mol/L H2SO4,待沉淀完全溶解后于412 nm 波长处比色。以标准H2O2溶液制作标准曲线。H2O2含量以μmol/g FW 表示。重复三次。
1.4.5 过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)的提取及活力测定
取1.0 g 鲜银耳,加入3.0 mL 经4 ℃预冷的50 mmol/L 磷酸缓冲液(pH 7.5,含5 mmol/L 二硫代苏糖醇和2%聚乙烯吡咯烷酮),在冰浴条件下研磨匀浆,于4 ℃、12000 rpm 离心30 min,收集上清液。
CAT 活性参考Beers、Jr 和Sizer 的方法进行并改进[9]。取0.05 mL 粗酶提取液加入2.95 mL 20 mmol/L H2O2,于波长240 nm 处测吸光度值的变化,以每min 反应体系吸光度值变化0.01 定义为1个酶活性单位(U),CAT 活性单位以U/g FW 表示。重复三次。
APX 活性参考Nakano 的方法进行并改进[10]。取0.05 mL 粗酶提取液依次加入2.65 mL 50 mmol/L 磷酸缓冲液(pH 7.5,含0.1 mmol/L EDTA 和0.5 mmol/L 抗坏血酸)、0.3 mL 0.002 mol/L H2O2,于波长290 nm 处测吸光度值的变化,以每min 反应体系吸光度值变化0.01 定义为1 个酶活性单位(U),APX 活性单位以U/g FW 表示。重复三次。
1.4.6 超氧化物歧化酶(SOD)的提取及活力测定
使用南京建成总超氧化物歧化酶(T-SOD)测试盒测试(货号A001-1-羟胺法)。
酶液制备:取2.0 g 银耳组织,用7 mL 样品提取液(pH 7.2,100 mM 磷酸缓冲液),冰浴研磨匀浆,在4 ℃条件下静置5 h,在4 ℃条件下10000 rpm离心15 min,上清液用于SOD 活性测定。
酶活测定:酶活测定操作步骤见表1。
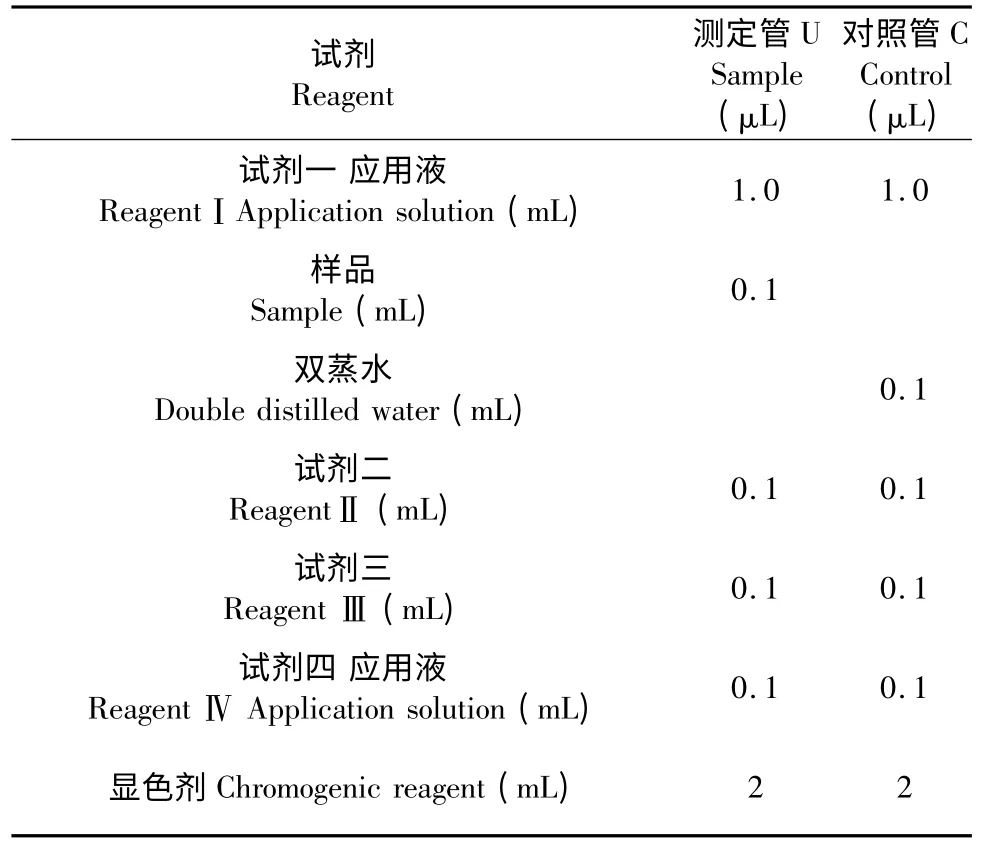
表1 酶活测定试剂Table 1 Reagent for determination of enzyme activity
漩涡混匀器充分混匀,37 ℃水浴40 min 后加入显色剂,混匀,室温放置10 min,于波长550 nm 处,1 cm 光径,双蒸水调零,测各管吸光值。酶活定义:以每克组织在1 mL 反应液中SOD 抑制率大50%所对应的SOD 量定义为1 个酶活性单位(U),SOD 活性单位以U/g FW 表示。重复三次。按如下公式计算酶活性:

式中:反应液总体积为3.4 mL;取样量为0.1 mL;组织湿重为2.0 g;匀浆介质体积为7.0 mL。
1.4.7 抗坏血酸(ASA)含量的测定
ASA 含量测定参考Bulk 等的方法进行[11]。取5.0 g 鲜银耳样品,加入5 mL 2%草酸在冰浴条件下研磨后转入100 mL 容量瓶定容,过滤,取滤液10.0 mL,用已标定的2,6-二氯酚靛酚溶液滴定至微红色,15 s 不褪色,记录消耗的2,6-二氯酚靛酚溶液用量,同时以10.0 mL 2%草酸做空白滴定。鲜银耳中抗坏血酸含量以mg/100 g 表示。重复三次。
1.5 数据统计及图形分析
用Excel2010 统计分析所有数据,计算标准误、制图;并对数据进行方差分析,利用邓肯式多重比较对差异显著性进行分析。P<0.05 表示差异显著。
2 结果与分析
2.1 壳聚糖处理对鲜银耳病情指数的影响
由图1 可知,整个贮藏期间鲜银耳的壳聚糖处理组病情指数显著低于对照组(P<0.05)。新鲜银耳在20 ℃贮藏5 d 时壳聚糖处理组病情指数为0,对照组为2.5;贮藏10 d 时处理组病情指数为1.25,对照组为9.17,对照组病情指数约是处理组的7.3 倍;贮藏15 d 时壳聚糖处理组病情指数为4.17,对照组为17.5,对照组比处理组高4.2 倍。整个贮藏期间,壳聚糖处理都显著降低了新鲜银耳的病情指数。

图1 壳聚糖处理对鲜银耳病情指数的影响Fig.1 Effect of chitosan treatment on disease index of fresh T.fuciformis
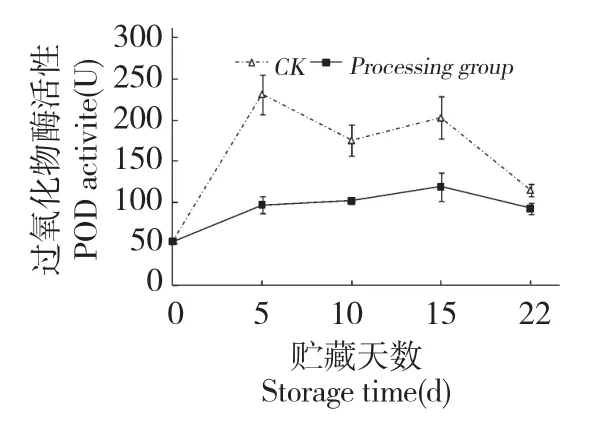
图2 壳聚糖处理对鲜银耳POD 活性的影响Fig.2 Effect of chitosan treatment on POD activities of fresh T.fuciformis
2.2 壳聚糖处理对鲜银耳POD、PPO 活性的影响
过氧化物酶(POD)是植物细胞中主要的氧化酶,在许多果蔬上表现为一种衰老酶,其活性提高是果蔬成熟衰老的体现。本研究结果表明,鲜银耳的POD 活性在贮藏期间成先上升后下降趋势(图2),相比对照组在贮藏5 d 时POD 活性急剧上升,壳聚糖处理明显抑制了鲜银耳的POD 活性,其活性仅为对照组的42.1%,差异显著(P<0.05)。在整个贮藏期内,壳聚糖处理组POD 活性都低于对照组,这表明壳聚糖对鲜银耳POD 活性的上升有抑制作用,从而延缓褐变、衰老,延长鲜银耳的贮藏保鲜期。

图3 壳聚糖处理对鲜银耳PPO 活性的影响Fig.3 Effect of chitosan treatment on PPO activities of fresh T.fuciformis
多酚氧化酶不仅是引起植物体褐变的重要酶之一,而且与植物体的抗病性有关。鲜银耳PPO 活性在贮藏期间呈下降趋势(图3)。但壳聚糖处理可延缓鲜银耳PPO 活性下降,在贮藏5、10、22 d 时均高于对照,这表明壳聚糖处理提高了鲜银耳PPO 活性。
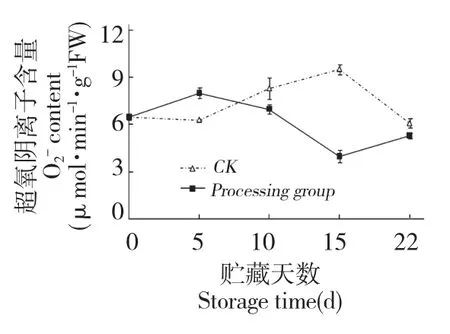
图4 壳聚糖处理对鲜银耳含量的影响Fig.4 Effect of chitosan treatment on content of fresh T.fuciformis
2.3 壳聚糖处理对鲜银耳和H2O2含量的影响
鲜银耳H2O2含量水平在贮藏初期无明显变化(图5),从第10 d 开始下降,15 d 后又有所上升。
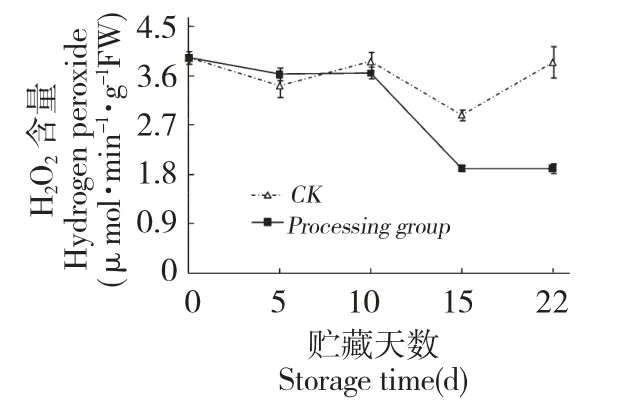
图5 壳聚糖处理对鲜银耳H2O2含量的影响Fig.5 Effect of chitosan treatment on H2O2content of fresh T.fuciformis
壳聚糖处理鲜银耳H2O2含量在贮藏中后期一直低于对照,15 d 和22 d 处理组H2O2含量比对照低33.9%和50.3%,差异显著(P<0.05)。
2.4 壳聚糖处理对鲜银耳CAT、SOD 活性的影响
CAT 和SOD 在生物体清除体内自由基、延缓衰老等方面有着重要的作用。鲜银耳CAT 活性在贮藏期间呈逐渐上升趋势(图6),而壳聚糖处理可显著诱导提高鲜银耳贮藏前期的CAT 活性,第5 d 和第10 d 时其活性分别是是对照组的2.4 和2.9 倍,差异显著(P<0.05)。第15 d 时处理组CAT 活性有所下降,可能与H2O2在后期积累降低有关。
壳聚糖处理有提高鲜银耳SOD 活性提高的作用(图7),贮藏第10 d 及15 d 时,处理组SOD 活性为对照组的2.18 和1.31 倍,差异显著(P<0.05)。SOD 是活性氧清除反应中第一个发挥作用的抗氧化酶,它催化发生歧化反应,生成H2O2和分子氧,从而清除了。处理组SOD 活性在贮藏期间呈上升趋势,与含量在贮藏后期逐渐下降的结果一致。

图6 壳聚糖处理对鲜银耳CAT 活性的影响Fig.6 Effect of chitosan treatment on CAT activities of fresh T.fuciformis
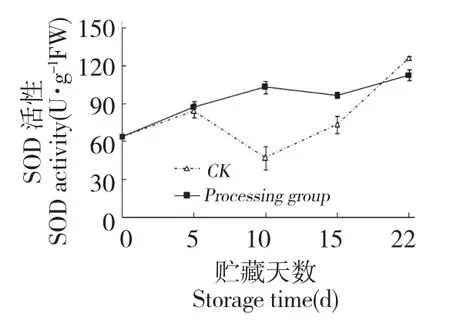
图7 壳聚糖处理对鲜银耳SOD 活性的影响Fig.7 Effect of chitosan treatment on SOD activities of fresh T.fuciformis
2.5 壳聚糖处理对鲜银耳APX 活性及ASA 含量的影响
鲜银耳贮藏期间APX 活性呈先上升后下降趋势(图8)。处理组与对照组的APX 活性分别在第5 d 和第15 d 达到峰值,第5 d 时,处理组银耳APX活性为对照组的1.76 倍,差异显著(P<0.05),说明壳聚糖处理在贮藏初期促进了APX 活性,并将其峰值提前。处理组APX 活性在第5 d 得到诱导提高后,在第10 d 后开始下降,与H2O2在后期积累不断降低的结果一致。
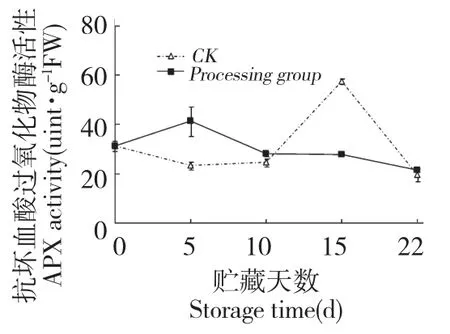
图8 壳聚糖处理对鲜银耳APX 活性的影响Fig.8 Effect of chitosan treatment on APX activities of fresh T.fuciformis
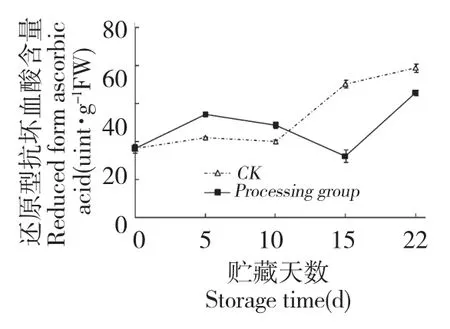
图9 壳聚糖处理对鲜银耳抗坏血酸含量的影响Fig.9 Effect of chitosan treatment on ASA content of fresh T.fuciformis
ASA 作为氧化还原代谢产物,在APX 作用下清除掉果蔬体内多余有害的活性氧。壳聚糖处理鲜银耳ASA 含量在贮藏前期高于对照,贮藏后期低于对照,此趋势与APX 活性相对应(图9)。
3 小结与讨论
银耳是一种采后生理活动旺盛、极易腐烂变质的食用菌,本研究使用壳聚糖对其进行保鲜处理,结果显示壳聚糖处理明显降低了新鲜银耳的腐烂发病程度(图1),这不仅与壳聚糖良好的抗菌作用和成膜性有关,可能还与其诱导活性氧代谢作用有关。有大量研究表明,壳聚糖对诱导提高果蔬活性氧代谢,增强果蔬抗病性有着显著的作用[12,13]。
POD、PPO 都是果蔬体内诱导抗病性的重要酶类。POD 催化可产生自由基产物,造成膜脂过氧化,从而加剧组织褐变。因此,POD 活性可作为果实成熟和衰老的指标之一。PPO 可催化木质素及其它酚类氧化产物的形成,构成保护性屏蔽而抵抗病菌的入侵[14]。PPO 也可将酚类物质氧化成高毒性的醌类物质从而可对入侵病原物进行毒杀[15]。本研究结果表明,壳聚糖提高了鲜银耳PPO 活性(图3),对鲜银耳POD 活性的上升有抑制作用(图2),说明壳聚糖可诱导鲜银耳抗病性增强,延缓褐变、衰老,延长鲜银耳的贮藏保鲜期。
在植物体的抗病反应中,活性氧(reactive oxygen species,ROS)爆发在早期抗病反应中起着重要的作用[16,17],包括直接的抗菌功能,促进细胞壁的木质化等,爆发的活性氧分子如超氧阴离子(superoxide anion,)和过氧化氢(hydrogen peroxide,H2O2)可作为过氧化物合成酶信号途径的第二信使,通过产生其它信号,如水杨酸(salicylic acid,SA),在诱导植保素信号中起作用[18]。H2O2参与细胞壁蛋白的氧化交联和木质素的形成,同时还对微生物有直接的毒性[19,20]。许多研究表明,在诱导处理的前期,果蔬体内的活性氧水平迅速升高[21],本实验研究结果与上述结果相似,壳聚糖处理在贮藏初期即第5 d 时促进了鲜银耳H2O2和的含量的积累(图4、图5),表明壳聚糖处理诱导了鲜银耳体内的活性氧爆发,而H2O2和可能是银耳抗病信号传递途径中的重要组分。
H2O2在CAT、POD 以及抗坏血酸-谷胱甘肽循环系统作用下转变为水和分子氧[22]。本研究结果表明,壳聚糖处理能显著提高新鲜银耳的CAT、SOD活性(图6、图7),这与李成华在用壳聚糖在双孢菇上的研究的结果一致[3]。鲜银耳的SOD 活性被壳聚糖诱导提高,而后在SOD 作用下被歧化分解,所以贮藏后期含量下降;CAT、APX 活性的提高也使H2O2含量逐渐下降。
综上所述,壳聚糖在贮藏初期通过诱导银耳体内的活性氧爆发,激发银耳体内包括SOD、CAT、APX 等一系列酶以清除活性氧,同时提高PPO 活性以增强抗病性,从而达到保鲜新鲜银耳的目的。
1 Wu Z(吴振),Li H(李红),Luo Y(罗杨),et al.Effect of different drying methods on physiochemical properties and antioxidant activities of polysaccharides extracted fromTremella fuciformis.Nat Prod Res Dev(天然产物研究与开发),2014,26:471-474.
2 Tamer CE,Copur OU.Chitosan:an edible coating for freshcut fruits and vegetables.Erkan M,Aksoy U.ISHS Acta Horticulturae877:VI International Postharvest Symposium.Antalya,Turkey,2010.
3 Li CH(李成华).Study on effects of chitosan and its derivatives coating preservation onAgaricus bisporus.Wuhan:Huazhong Agricultural University(华中农业大学),MSc.2009.
4 Xiong QL(熊巧玲).Studies on the phisio-chemical characteristics and fresh keeping technologies of post-harvest inPleurotus nebrodensis.Wuhan:Huazhong Agricultural University(华中农业大学),MSc.2007,26.
5 Li GX(李冠喜).Responses ofAgaricus bisporuson chitosan antistaling agent and optimization of its refreshing technology.J Northeast Agric Univ(东北农业大学),2012,43:110-116.
6 Zauberman G,Ronen R,Akerman M,et al.Postharvest retention of the red color of Litchi fruit pericarp.Sci Hort,1991,47:89-97.
7 Wang AG(王爱国),Luo GH(罗广华).Quantitative relation between the reaction of hydroxylamine and superoxide anion radicals in plants.Plant Physiol Commun(植物生理学通讯),1990,6:55-57.
8 Patterson BD,Mackae EA,Ferguson IB.Estimation of hydrogen peroxide in plant extracts using titanium (IV).Anal Biol,1984,139:487-492.
9 Beers RF Jr,Sizer IW.A Spectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase.JBiol Chem,1952,195:133-140.
10 Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascobate specific peroxidase in spinach chloroplasts.Plant Cell Physiol,1981,22:867-880.
11 El Bulk RE,Babiker EFE,El Tinay AH.Changes in chemical composition of guava fruits during development and ripening.Food Chem,1997,59:395-399.
12 Zeng KF,Deng YY,Ming J,et al.Induction of disease resistance and ROS metabolism in navel oranges by chitosan.Sci Hort,2010,126:223-228.
13 Bautista-Banos S,Hernandez-Lauzardo AN,Velazquez-Del Valle MG,et al.Chitosan as a potential natural compound to control pre and postharvest diseases of horticultural commodities.Crop Protection,2006,25:108-118.
14 Avdiushko SA,Ye XS,Kuc J.Detection of several enzymatic activities in leaf prints cucumber plant.Physiol Mole Plant Pathol,1993,42:441-454.
15 Mohammadi M,Kazemi H.Changes in peroxidase and polyphenol oxidase activities in susceptible and resistant wheat heads inoculated withFusarium graminearumand induced resistance.Plant Sci,2002,162:491-498.
16 Breusegem FV,Vranova E,Dat JF,et al.The role of active oxygen species in plant signal transduction.Plant Sci,2001,161:405-414.
17 Chico JM,Raice SM,Tellez-inon MT,et al.A calcium dependent protein kinase is systemically induced upon wounding in tomato plants.Plant Physiol,2002,128:256-270.
18 Maolepsza U.Induction of disease resistance by acibenzolar-Smethyl and o-hydroxyethylorutin againstBotrytis cinereain tomato plants.Crop Protection,2006,25:956-962.
19 Wu G,Shortt BJ,Lawrence EB,et al.Disease resistance conferred by expression of a gene encoding H2O2gene rating glucose oxidase in transgenic potato plants.Plant Cell Physiol,1995,7:1357-1368.
20 Araceli AC,Elda CM,Edmundo LG,et al.Capsidiol production in pepper fruits (Capsicum annuumL.)induced by arachidonic acid is dependent of an oxidative burst.Physiol Mole Plant Pathol,2007,70(1/3):69-76.
21 Sanchez-Casas P,Klessig DF.A salicylic acid binding activity and a salicylic acid inhibitable catalase activity are present in a variety of plant species.Plant Physiology,1994,106:1675-1679.
22 Mehdy MC.Active oxygen species in plant defense against pathogens.Plant Physiol,1994,105:467-472.
