马铃薯内生拮抗真菌E-19 的分离、鉴定及其次生代谢产物研究
2015-01-08杨曼思王文祥李龙根艾洪莲郭华春
杨曼思,王文祥,李龙根,艾洪莲,郭华春
云南农业大学农学与生物技术学院,昆明 650201
2015年1月6 日,农业部副部长余欣荣在“马铃薯主粮化战略研讨会”上表示,今后要推进马铃薯主粮化,力争通过几年的不懈努力,使马铃薯的种植面积、单产水平、总产量和主粮化产品在马铃薯总消费量中的比重均有显著提升,让马铃薯逐渐成为水稻、小麦、玉米之后的我国第四大主粮作物。随着马铃薯主粮化战略的推出,马铃薯种植过程中所面临的各种病害成为制约马铃薯单产水平和总产量的主要障碍之一。目前,马铃薯最严重的病害为马铃薯晚疫病(Phytophthora infestans),广泛分布于马铃薯各产区,其危害性、防治难度及对社会造成的巨大影响,已超过稻瘟病和小麦锈病,被视为全球第一大作物病害。在全国范围内,特别是降水充沛的西南山区和北方部分潮湿产区,晚疫病几乎每年都有发生,由此造成马铃薯产量损失高达20%~80%。
植物内生菌由于其物种丰富,数量庞大,而且与其它生物之间具有紧密的生态关系,使其成为天然活性物质的丰富来源。Schulz 等报道[1],从内生真菌次生代谢产物中获得了135 个化合物,其中新化合物占51%,而土壤微生物产生的新化合物只占38%。从植物内生菌中寻找新型先导化合物,创制高效、环保的新型农药,已经成为目前国内外研究的热点问题之一。本文报道了从马铃薯健康植株分离、纯化内生真菌,并通过形态学和18S rDNA 序列分析,构建系统发育树,以及对该菌次生代谢产物的分离、纯化、鉴定结果,为开发无污染、低残留并且可以使农业生产种植进入可持续的良性发展的微生物源农药奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
2014年3~4月份分别在大理、德宏、临沧三地采集的马铃薯健康植株,用于内生真菌的分离,均由云南农业大学薯类研究所提供。
1.1.2 试剂
青霉素链霉素混合抗生素、75%无水乙醇、2%次氯酸钠、葡萄糖、猪肉蛋白胨、琼脂、酵母粉、KH2PO4、MgSO4(西陇化工股份有限公司)、柱层析用硅胶80~100 目、200~300 目和预制GF254TLC 板(青岛海洋化工),Sephadex LH-20(瑞典Amersham Biosciences 公司),Chromatorex C-18(日本Fuji Silysia 化学公司)。
1.2 仪器
普通药物天平(上海医疗器械厂),立式压力蒸汽灭菌锅(上海博讯实业有限公司),超净工作台(苏州净化设备有限公司),Bruker AVANCE Ⅲ-600、DRX-500 或AV-400 核磁共振仪,分析型HPLC(Agilent 1100 系列液相色谱仪),半制备HPLC(Agilent Technologies 1200 系列液相色谱仪),Horbia SEPA-300 旋光仪,UV-210A 型分光光度计,Bruker Tensor27 型红外光谱仪,Waters AutoSpec Premier P776 质谱仪。
1.3 内生真菌的分离、纯化
将采集的健康马铃薯植株的根、茎、叶在自来水下冲洗干净,擦干,根茎剪成3 cm 的小段,叶剪成3 cm×3 cm 的小片,按下列程序进行表面消毒:无菌条件下,75%乙醇漂洗1 min,无菌水冲洗3 次;2%次氯酸钠消毒(消毒时间:根3 min;茎2.5 min;叶2 min)、无菌水冲洗3 次;然后置于无菌滤纸上将水分吸干。将表面消毒后的根、茎剪去两端切口,剩余段从中间剖开,剪成(0.3~0.5)cm3的小块,叶剪去四周后将剩余部分剪成0.3 cm×0.3 cm 小块。
消毒有效性评价采取3 种方法:一是取少量第3 次无菌水冲洗液涂抹新的培养基平板;二是用组织印迹法,将消毒好待处理的材料在未使用的培养基平板上轻轻滚动或紧贴培养基放置5 min 后移走;三是在分离操作的同时将未使用的培养基平板打开并暴露在无菌操作台上。将上述3 种处理的培养皿置于22~25 ℃培养箱中培养。
采用顶端菌丝纯化法,每日定期观察内生真菌长出情况,将切口处新长出的菌丝挑取尖端部分转接至PDA 培养基上,纯化培养直至获得纯菌株,放置于4 ℃冰箱保存。
1.4 拮抗菌株的筛选
采用平板对峙拮抗实验法测定上述分离得到的内生真菌的抑菌作用[2,3]。具体操作如下:在9 cm的PDA 平板上,分别接种待测菌株和靶标病原菌,并使其间距为5 cm,置于22~25 ℃培养箱中培养3~5 d,观察并记录菌株生长情况和菌株间的拮抗现象。
1.5 拮抗菌株的发酵
培养基:葡萄糖5%,猪肉蛋白胨0.15%,酵母粉0.5%,KH2PO4和MgSO4各0.05%;培养条件:温度24 ℃;摇床转速150 rpm;暗培养25 d。
1.6 拮抗菌株的鉴定
将内生真菌接种于培养皿中,在靠近培养皿边缘1/3 处45°斜插一个经过灭菌的盖玻片,置于22~25 ℃培养箱中培养3~5 d,待菌丝长至盖玻片上时,取出至显微镜上观察菌丝形态。将内生真菌接种于产孢培养基,诱导产生孢子后,置显微镜观察并照相。
用真菌18S 通用引物,ITS1:(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4:(5'-TCCTCCGCTTATTGATATGC-3'),进行PCR 扩增。PCR 反应体系(20 μL):DNA 模板1 μL,10 ×Buffer 2 μL,dNTPs(2.5 mmol/L)1.6 μL,ITS1 primer(10 μmol/L)0.4 μL,ITS4 primer(10 μmol/L)0.4 μL,HiFi(5 U/μL)0.2 μL,ddH2O 14.4 μL。PCR 反应条件为:94 ℃预变性4 min;94 ℃变性1 min,58 ℃退火45 s,72 ℃延伸40 s,30 个循环;72 ℃延伸10 min;4 ℃保温。用凝胶回收试剂盒纯化PCR 产物,克隆至PCR2.1 载体上,18S rDNA 序列由生物技术有限公司测定。将测得的18S rDNA 序列进行BLAST 分析(http://blast.ncbi.nlm.nih.gov/),并构建系统进化树[4,5]。
1.7 拮抗菌株次生代谢产物的分离、纯化、鉴定
内生真菌E-19 发酵液20 L 减压浓缩至2 L,用乙酸乙酯进行多次萃取,萃取液减压浓缩得到浸膏约26 g。用硅胶(80~100 目)拌样,上正相硅胶柱(200~300 目,CHCl3/MeOH,100∶0~0∶100,V/V)粗分,得到5 个组份。组分1 经反相中压以甲醇-水(85∶15→0∶100)梯度洗脱,得到大量的化合物1(约2 g)。组分2 以石油醚-丙酮(5∶1→1∶1)梯度洗脱得化合物2(10 mg)。组分3 以石油醚-丙酮(5∶1→1∶1)梯度洗脱得亚组分,对亚组分经反相-高效液相色谱法(RP-HPLC)制备柱色谱以(10%~30%,乙腈/水)得化合物4(2.1 mg)、5(12 mg)和6(6 mg)。化合物3(3 mg)来自于组分4,经中压反相柱层析(85%~100%甲醇)和半制备HPLC(70%~100%乙腈,20 min)分离得到。
2 实验结果
2.1 内生真菌E-19 的鉴定
从马铃薯健康植株中分离得到一株对马铃薯晚疫病具有强烈拮抗作用的真菌E-19,经3 种消毒有效性方法检验,在其对照培养皿上未出现菌落,证明其为马铃薯内生真菌。
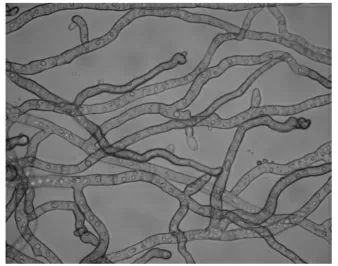
图1 E-19 菌丝在显微镜下的形态图Fig.1 Morphology of endophytic fungi E-19 under microscope
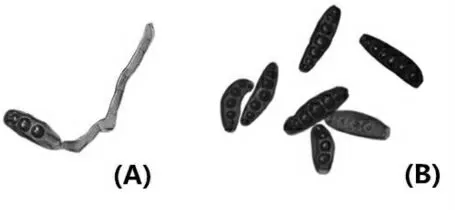
图2 内生真菌E-19 的孢子在显微镜下的形态图Fig.2 Fungal spores of endophytic fungi E-19 under microscope

图3 基于18S rDNA 序列构建的E-19 与其他真菌菌种的分子系统进化树Fig.3 Neighbour-joining tree based on 18S rDNA sequences showing relationships between strain E-19 and closely related members of fungi
内生真菌E-19 在PDA 培养基上生长较快,培养4 d 呈现黑褐色的菌落,直径4.2 cm,背面黑褐色至黑色。气生菌丝较发达,其菌丝和孢子在显微镜下的照片如图1、图2 所示。18S rDNA 序列分析表明内生真菌E-19 与Bipolaris sorokiniana(最大相似度:100%;覆盖度:95%;登录号:KJ909776.1)和Bipolaris eleusines(最大相似度:99%;覆盖度:98%;登录号:KY909768.1)非常接近,其系统发育树见图3。结合其菌丝形态特征和孢子特征,将其确定为Bipolaris eleusines。
2.2 内生真菌E-19 次生代谢产物的结构鉴定

化合物1 分子式C15H24O2,白色无定型粉末。1H NMR (CDCl3,600 MHz)δ:4.99 (1H,s,H-12),4.70 (1H,s,H-12),4.41 (1H,br s,H-14),3.66 (1H,br s,H-15),2.72 (1H,br s,H-1),2.57(1H,br s,H-7),1.76 (1H,br s,H-13),1.55 (1H,m,H-9),1.05 (3H,d,J=7.0 Hz,H-10),0.99(3H,s,H-8),0.93 (3H,d,J=7.0 Hz,H-11);13C NMR (CDCl3,150 MHz)δ:154.4 (C-2),105.5 (C-12),79.1 (C-14),75.3 (C-15),58.1 (C-1),53.9(C-13),46.0 (C-7),43.0 (C-6),40.3 (C-3),37.2(C-4),31.1 (C-9),28.4 (C-8),22.7 (C-5),21.4(C-10),21.0 (C-11)。以上数据与文献[6]报道一致,故化合物1 鉴定为Isosativenediol。
化合物2 分子式C15H26O2,白色无定型粉末。1H NMR (CDCl3,600 MHz)δ:4.90 (1H,d,J=3.0 Hz,H-12),4.79 (1H,d,J=3.0 Hz,H-12),3.68 (1H,dd,J=11.0,6.0 Hz,H-15),3.66 (1H,dd,J=11.0,6.5 Hz,H-14),3.46 (1H,dd,J=11.0,9.0 Hz,H-15),3.25 (1H,dd,J=11.0,9.0 Hz,H-14),2.52 (1H,br t,J=8.0 Hz,H-1),2.37(1H,s,H-7),1.57 (1H,br t,J=8.0 Hz,H-13),0.99 (3H,s,H-8),0.96 (3H,d,J=7.0 Hz,H-10),0.84 (3H,d,J=7.0 Hz,H-11);13C NMR(CDCl3,150 MHz)δ:158.9 (C-2),104.9 (C-12),66.8 (C-14),63.5 (C-15),57.6 (C-7),49.4 (C-1),47.5 (C-3),45.8 (C-13),42.9 (C-4),38.1(C-6),30.9 (C-9),25.2 (C-5),21.6 (C-10),20.9(C-11),20.3 (C-8)。以上数据与文献[6]报道一致,故化合物2 鉴定为Dihydroprehelminthosporol。
化合物3 分子式C15H24O2,白色无定型粉末。1H NMR (CDCl3,600 MHz)δ:10.03 (1H,s,H-15),3.65 (1H,dd,J=10.8,5.4,H-14),3.32(1H,dd,J=10.8,8.7 Hz,H-14),3.19 (1H,br s,H-7),2.00 (3H,s,H-12),1.66 (1H,dd,J=8.0,5.0 Hz,H-13),1.08 (3H,d,J=5.4 Hz,H-10),1.02 (3H,s,H-8),0.75 (3H,d,J=5.4 Hz,H-11);13C NMR (CDCl3,150 MHz)δ:188.7 (C-15),167.0 (C-2),137.3 (C-1),62.1 (C-14),61.1 (C-13),50.8 (C-3),44.8 (C-6),41.1 (C-7),34.2(C-4),31.9 (C-9),25.3 (C-5),21.8 (C-10),20.8(C-11),18.4 (C-8),10.8 (C-12)。以上数据与文献[6,7]报道一致,故化合物3 鉴定为Helminthosporol。
化合物4 分子式C14H24O2,白色无定型粉末。1H NMR (CDCl3,600 MHz)δ:3.84 (1H,dd,J=10.7,5.1 Hz,H-12),3.49 (1H,dd,J=10.7,7.1 Hz,H-12),2.09 (1H,br q,J=7.1 Hz,H-14),1.08 (3H,s,H-8),1.01 (3H,d,J=6.6 Hz,H-10),0.95 (3H,d,J=7.1 Hz,H-14),0.81 (3H,d,J=6.6 Hz,H-11),;13C NMR (CDCl3,150 MHz)δ:221.0 (C-1),62.0 (C-12),54.9 (C-2),51.3 (C-7),50.6 (C-13),50.1 (C-6),41.9 (C-3),36.1(C-4),29.9 (C-9),26.0 (C-5),22.0 (C-8),21.4(C-10),20.3 (C-11),6.3 (C-14)。以上数据与文献[7]报道一致,故化合物4 鉴定为Drechslerines C。
化合物5 分子式C14H24O2,白色结晶。1H NMR (CDCl3,600 MHz)δ:5.56 (1H,br d,J=1.5 Hz,H-1),4.08 (1H,dd,J=14.3,1.1 Hz,H-12),4.02 (1H,dd,J=14.3,1.5 Hz,H-12),3.64 (1H,dd,J=10.6,5.3 Hz,H-14),3.36 (1H,dd,J=10.6,9.4 Hz,H-14),2.76 (1H,br s,H-7),1.00(3H,s,H-8),0.99 (3H,d,J=6.8 Hz,H-10),0.89(3H,d,J=6.8 Hz,H-11);13C NMR (CDCl3,150 MHz)δ:147.2 (C-2),124.2 (C-1),63.9 (C-13),62.7 (C-14),60.0 (C-12),47.7 (C-3),45.5 (C-6),43.9 (C-7),35.8 (C-4),33.9 (C-9),26.5 (C-5),21.7 (C-10),21.4 (C-11),19.1 (C-8)。以上数据与文献[7]报道一致,故化合物5 鉴定为Drechslerine A。
化合物6 分子式C15H26O2,白色无定型粉末。1H NMR (CD3OD,600 MHz)δ:5.75 (1H,br s,H-1),4.07 (1H,dd,J=14.9,1.7 Hz,H-12),4.00(1H,dd,J=14.9,1.7 Hz,H-12),3.65 (1H,m,H-15),3.56 (1H,m,H-15),2.02 (1H,m,H-13),1.06(3H,s,H-8),0.97 (3H,s,H-10),0.98 (3H,s,H-11);13C NMR (CD3OD,150 MHz)δ:147.9 (C-2),128.3 (C-1),62.1 (C-15),59.8 (C-12),58.9 (C-9),51.4 (C-3),47.1 (C-13),45.8 (C-4),42.8(C-6),36.7 (C-7),35.2 (C-14),32.7 (C-10),28.0 (C-11),22.3 (C-8),21.9 (C-5)。以上数据与文献[7]报道一致,故化合物6 鉴定为Secolongifolene diol。
3 结论
随着人们对环境污染、食品安全和人类自身健康的重视,以及抗药菌株的出现,寻找新的具有抑菌活性的天然产物已成为农药及抗生素领域的重要课题。植物内生真菌在与宿主植物协同进化过程中,能够合成活性物质协助宿主抵御外来病原菌的侵染。本课题以采自大理、德宏、临沧三地的马铃薯健康植株为材料,分离内生真菌。结合形态学特征和18S rDNA 序列分析结果,将菌株E-19 鉴定为B.eleusines。为了进一步探索其化学物质基础,我们从B.eleusines的发酵液中分离出6 个Sativene 骨架类型的倍半萜类化合物,均是首次从该菌中分离得到。本研究将为马铃薯内生真菌活性物质的开发奠定化学物质基础。
1 Schulz B,Boyle C.The endophytic continuum.Mycol Res,2005,109:661-686.
2 Lu SY (鲁素云).Biological Control of Plant Diseases (植物病害生物防治学).Beijing:Beijing Agricultural University Press,1993,243-254.
3 Wang JH (王家和).Isolation and screening of antagonistic fungi against tobacco root diseases.Chin J Biol Control(中国生物防治),1998,14:28-31.
4 White TJ,Bruns TD,Lee SB.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics.In:Innis MA,Gelfand DH,Sninsky JJ,White TJ,eds.PCR protocols:a guide to methods and applications.San Diego:Academic Press,1990,315-322.
5 Ko Ko TW,Stephenson SL,Bahkali AH,et al.From morphology to molecular biology:can we use sequence data to identify fungal endophytes?Fungal Divers,2011,50:113-120.
6 Pena-rodriguez,LM,Armingeon NA,Chilton WS.Toxins from weed pathogens,I.phytotoxins fromAbipolaris pathogenof Johnson grass.J Nat Prod,1988,51:821-828.
7 Osterhage C,König GM,Höller U,et al.Rare sesquiterpenes from the Algicolous fungusDrechslera dematioidea.J Nat Prod,2002,65:306-313.
