oleosin-MT融合蛋白在拟南芥中的表达及鉴定
2015-01-07官丽莉韩怡来李海燕李校堃
官丽莉,陈 昱,朱 栋,韩怡来,崔 琪,李海燕,李校堃,姜 潮
(吉林农业大学 a 生物反应器与药物开发教育部工程研究中心,b 生命科学学院,吉林 长春 130118)
oleosin-MT融合蛋白在拟南芥中的表达及鉴定
官丽莉a,b,陈 昱a,b,朱 栋a,b,韩怡来a,b,崔 琪a,b,李海燕a,b,李校堃a,姜 潮a
(吉林农业大学 a 生物反应器与药物开发教育部工程研究中心,b 生命科学学院,吉林 长春 130118)
【目的】 获得转金属硫蛋白(MT)基因的拟南芥植株,为利用植物生物反应器规模化生产MT奠定基础。【方法】 利用融合PCR方法,扩增拟南芥MT基因与油体蛋白oleosin基因的融合基因,将融合基因克隆至表达载体pOP上,构建重组质粒pOP-oleosin-MT。采用冻融法将质粒pOP-oleosin-MT转入根癌农杆菌EHA105中,通过农杆菌介导法转化拟南芥,用PCR检测并筛选转基因拟南芥阳性植株,采用SDS-PAGE法检测oleosin-MT融合蛋白的表达,用邻苯三酚自氧化法和结晶紫法测定融合蛋白的体外抗氧化活性。【结果】 成功构建了植物油体特异表达载体pOP-oleosin-MT,融合蛋白oleosin-MT在拟南芥种子中成功表达,其分子质量为26 ku;总蛋白质量浓度达到50 μg/μL时,超氧阴离子的清除率最高,为58.5%;总蛋白质量浓度为10 μg/μL时,羟自由基清除率可达69.7%。【结论】 成功获得转MT基因的拟南芥株系,并证明融合蛋白oleosin-MT在拟南芥中具有良好的体外抗氧化活性。
金属硫蛋白;拟南芥;油体蛋白;基因表达
金属硫蛋白(Metallothionein,MT)是一类低分子质量(6~7 ku)、富含半胱氨酸、可与大量金属离子(如Zn2+、Cd2+和 Cu2+)相结合的独特蛋白质或活性肽,是机体内惟一一种在金属代谢中起重要调节作用的小分子蛋白[1]。1957年,富含Cd的金属蛋白首次在马肾脏细胞中被发现[2]。对金属硫蛋白进行提纯,发现其含有大量的半胱氨酸残基和金属,并因此将其命名为“Metallothionein”[3]。研究证实,植物MT的高巯基含量使其在空气中极不稳定,导致分离困难,目前仅在小麦Ec蛋白[4]和拟南芥MT1、MT2和MT3[5]中分离纯化获得,MT基因的表达可增强植物在重金属胁迫过程中的抗逆作用,对组织细胞损伤修复具有显著功效[6-10]。同时研究还发现,MT2可与金属结合,具有清除自由基、防辐射、加速皮肤炎症修复和延缓衰老等功效[11-12]。
近年来,随着植物基因工程技术的不断发展,植物表达系统日益受到重视,其中植物油体表达系统已成为现阶段植物生物反应器研究的热点之一,已有多种蛋白或多肽在植物中成功表达,但有关MT在植物油体中的表达研究尚未见报道。本研究通过构建MT油体特异性表达载体,转化拟南芥获得转基因阳性植株,并对MT蛋白的体外抗氧化活性进行测定,旨在为研究MT蛋白功能及其在化妆品、药物开发中的应用提供理论参考。
1 材料与方法
1.1 材 料
1.1.1 植物材料 哥伦比亚生态型拟南芥(Arabidopsisthalianaecotype Columbia)种子,由吉林农业大学生物反应器与教育部工程研究中心保存。
1.1.2 质粒与菌株 农杆菌菌株EHA105、植物表达载体pOP(以pCAMBIA1390载体骨架为蓝图进行改造后获得)、pUC19-oleosin、大肠杆菌菌株DH5α,均由吉林农业大学生物反应器与药物开发教育部工程研究中心构建及保存;pEASY-Blunt Cloning Kit ,购自北京全式金生物技术有限公司。
1.1.3 试 剂 限制性内切酶、PfuDNA聚合酶、DNA分子质量标准Marker(DL2000)、DNA Fragment Purification Kit Ver.2.0试剂盒、DNA小量提取试剂盒、Agarose Gel DNA Purification Kit试剂盒、Mini BEST Plasmid Purification Kit Ver.2.0试剂盒及DNA Ligation Kit Ver.2等,均购自大连宝生物工程有限公司。其他常规试剂均为国产或进口分析纯试剂。
1.2 方 法
1.2.1 引物设计 根据GenBank上的拟南芥MT2基因和oleosin基因碱基序列,利用Primer Primier 5.0引物设计软件,分别设计MT(M1/M2)和oleosin(Y1/Y2)特异性引物,引物合成及测序均由金唯智生物科技(北京)有限公司完成。所设计的引物及序列如下。
M1:5′-ATGTCTTGCTGTGGTGGAAGCTG-3′;
M2:5′-CAAGCTTATTTGCAGGTGCAGGT-GCAAGGGTT-3′。下划线部分为Hind Ⅲ的酶切位点和保护碱基。
Y1:5′-CATGCCATGGCGGATACAGCTAG-AGGAACCCAT-3′,下划线部分为NcoⅠ的酶切位点和保护碱基;
Y2:5′-CTCCATCCTCTGGCAAAGCTGGC-ATAGTAGTGTGCTGGCCACCACG-3′。
1.2.2MT及oleosin基因的PCR扩增 从拟南芥叶片中提取RNA,反转录为cDNA,以此为模板,利用MT基因特异性引物进行PCR扩增,50 μL PCR 反应体系如下:10×PfuBuffer(含MgSO4) 5 μL,5′端引物M1(10 μmol/L) 1 μL,3′端引物M2(10 μmol/L) 1 μL,模板1 μL (500 ng/μL),PfuDNA聚合酶1 μL, dNTP (25 mmol/L)4 μL,去离子水37 μL。PCR反应程序为:95 ℃变性4 min;95 ℃变性30 s,56 ℃退火1 min,72 ℃延伸2 min, 31个循环;72 ℃延伸10 min,4 ℃终止反应。以pUC19-oleosin质粒为模板,Y1、Y2 为引物,利用PCR扩增得到目的基因oleosin,体系及反应程序同上。PCR 产物在1%琼脂糖凝胶中电泳,检测并回收目的片段,于-20 ℃保存。
最后将3个年级的数据进行合并,利用基于K-means算法的评选方法和传统评选方法的结果对比。见表11。
1.2.3oleosin-MT基因的PCR扩增 以PCR扩增得到的oleosin片段和MT片段为模板,Y1和M2分别为上、下游引物,扩增得到oleosin-MT融合基因片段,反应体系及程序同1.2.2节。PCR 产物在1%琼脂糖凝胶中电泳,检测并回收目的片段,于-20 ℃保存。
将融合目的基因片段oleosin-MT与pEASY-Blunt 克隆载体连接、转化大肠杆菌DH5α,阳性克隆经PCR 鉴定和酶切鉴定后,将阳性克隆摇菌保种命名为pEASY-oleosin-MT,送测序公司进行分析。
1.2.4 含oleosin-MT植物表达载体的构建NcoⅠ和Hind Ⅲ双酶切测序正确的pEASY-oleosin-MT重组子经1%琼脂糖凝胶电泳后,割胶回收目的片段。利用SolutionⅠ连接酶将目的基因与酶切回收的pOP植物表达载体连接,转化大肠杆菌DH5α,阳性克隆经PCR 鉴定和酶切鉴定后获得重组pOP-oleosin-MT质粒,利用冻融法将测序正确的pOP-oleosin-MT转化农杆菌EHA105,获得用于侵染用的工程菌株。
1.2.5oleosin-MT基因转化拟南芥 侵染前1 d给予待侵染拟南芥充足的水分,转化前剪掉种荚、开花和露白的花芽。将农杆菌工程菌株接种于YEP液体培养基(50 μg/mL Kan、100 μg/mL Rif)中,28 ℃、180 r/min进行过夜培养。将菌液转移至离心管中,4 ℃、4 000 r/min离心10 min收集菌体,用Floral-Dip Buffer重悬菌体。将拟南芥全部浸入重悬的农杆菌菌液中,静置7 min,放平转化后的营养钵,用保鲜膜包裹保湿过夜,第2天可稍露一小缝,第3天正常放置。待种子成熟后收获种子,即为T0代。
1.2.6 拟南芥阳性植株的筛选 将收获得到的拟南芥T0代种子进行播种,待拟南芥幼苗长出4~6片叶时,用体积分数 1% Basta喷洒幼苗,每隔1 d 1次,共3次。此时依然能够生长的幼苗即为阳性苗。将生长状况良好的阳性拟南芥幼苗进行移栽,每盆5株,2个月后可收获T1代种子。对收获的T1代种子进行播种和筛选,方法同T0代;2个月后可收获T2代种子,对T2代种子进行后续的外源蛋白检测。
1.2.7 转基因拟南芥外源蛋白表达的检测 取40粒T2代拟南芥种子,放到特制的拟南芥研磨专用EP管中,将30 μL 50 mmol/L Tris-HCl(pH=8.0)加入EP管内,用小研棒充分研磨,研磨后用4 ℃、12 000 r/min离心10 min,离心后液体分3层:表层白色油膜层、中间层油液体和底层沉淀。弃沉淀,将上2层液体混匀后即为油体蛋白提取液。取30 μL油体蛋白样品和6 μL 5×Loading Buffer,混合均匀后,沸水中煮10 min,取10 μL进行上样,用12%SDS-PAGE鉴定。
清除率=(ΔOD0-ΔOD)/ΔOD0×100%。
上述体系在加入H2O2之前,加入0.05,0.10,0.15,0.20,0.25,0.30,0.35,0.40,0.45,0.50 mL的转MT基因及野生型拟南芥种子油体蛋白溶液,测定吸光度ODa,计算表观抗羟自由基氧化率(S),即:
S=(ODa-ODb)/(OD0-ODb)×100%。
2 结果与分析
2.1 MT基因的克隆
以拟南芥叶片RNA反转录的cDNA为模板,利用M1和M2特异性引物进行PCR扩增,结果(图1)显示,在238 bp左右位置扩增出目的片段,经DNA测序分析,同源性为100%,说明成功从拟南芥中克隆出MT基因。

图1MT基因的PCR扩增
M.DL2000 DNA Marker;1.阴性对照;2.MT基因
Fig.1 PCR amplification ofMTgene M.DL2000 DNA Marker;1.Negative control;2.MTgene
2.2 oleosin-MT融合基因的克隆及验证
以pUC19-oleosin质粒为模板,Y1、Y2 为引物,通过PCR扩增目的基因oleosin,PCR扩增结果(图2)显示,在约762 bp处扩增出目的片段;以MT和oleosin2个目的基因为模板,Y1、M2 为引物,通过
PCR扩增得取融合基因oleosin-MT,结果(图3)显示,在1 000 bp左右位置扩增出目的片段。将融合目的基因片段oleosin-MT与pEASY-Blunt 克隆载体连接、转化后,构建pEASY-oleosin-MT。对含有融合基因的大肠杆菌菌液进行摇菌及PCR验证,然后用试剂盒提取pEASY-oleosin-MT质粒,进行质粒的NcoⅠ和Hind Ⅲ双酶切鉴定,结果如图4,5所示。由图4,5可知,PCR和酶切鉴定均释放出 1 000 bp左右的目的条带。送至测序公司进行分析,结果正确,表明融合基因已融合成功。
2.3 植物表达载体pOP-oleosin-MT的构建
将融合后的oleosin-MT基因与植物表达载体过夜连接,转入到农杆菌EHA105感受态细胞中。将含有pOP-oleosin-MT重组质粒的菌液过夜摇床培养,对培养好的农杆菌菌液进行PCR鉴定,结果(图6)显示,在1 000 bp处出现目的条带,表明融合基因已成功插入到pOP载体中,植物表达载体构建成功。

图2 oleosin基因的PCR扩增M.DL2000 DNA Marker;1.阴性对照;2.oleosin基因Fig.2 PCR amplification of oleosin geneM.DL2000 DNA Marker;1.Negative control;2.oleosin gene
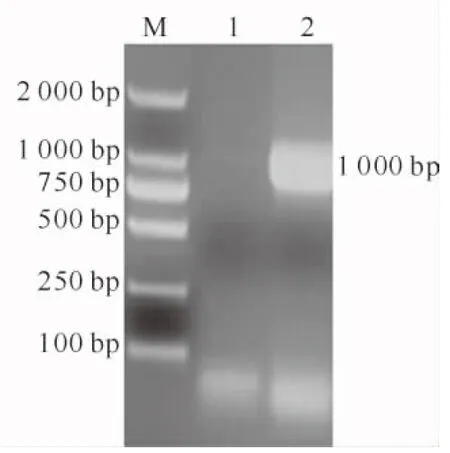
图3 oleosin-MT基因的PCR扩增M.DL2000 DNA Marker;1.阴性对照;2.oleosin-MT基因Fig.3 PCR amplification of oleosin-MT geneM.DL2000 DNA Marker;1.Negative control;2.oleosin-MT gene
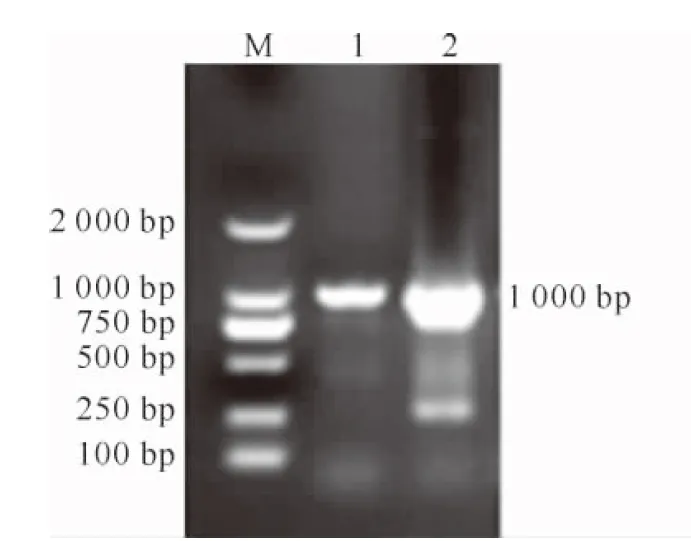
图4 pEASY-oleosin-MT菌液的PCR鉴定M.DL2000 DNA Marker;1.oleosin-MT基因;2.阳性对照Fig.4 PCR amplification of pEASY-oleosin-MTM.DL2000 DNA Marker;1.oleosin-MT gene;2.Positive control

图5 pEASY-oleosin-MT的双酶切鉴定M.DL2000 DNA Marker;1~3.质粒酶切Fig.5 Restriction digestion analysis of pEASY-oleosin-MTM.DL2000 DNA Marker;1-3.Plasmid digest
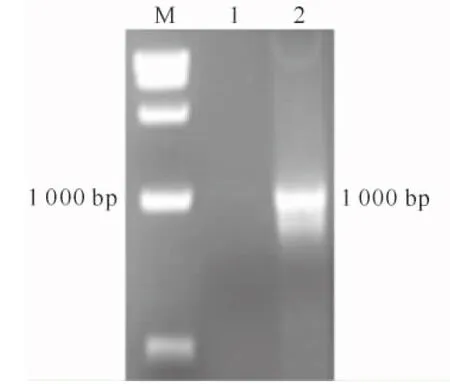
图6 pOP-oleosin-MT菌液的PCR鉴定
M.DL2000 DNA Marker;1.阴性对照2.oleosin-MT基因
Fig.6 PCR amplification of plasmids pOP-oleosin-MT
M.DL2000 DNA Marker;1.Negative control;2.oleosin-MTgene

图7 转基因拟南芥植株种子目标蛋白的SDS-PAGE电泳
M.蛋白Marker;1.非转基因植株;2~5.转基因植株
Fig.7 SDS-PAGE analysis of transgenic plant seeds
M.Protein marker;1.Wild type plant;2-5.Transgenic plants
2.4 转基因拟南芥目标蛋白的表达
经过Basta抗性筛选,初步筛选出17株拟南芥抗性植株。分别提取4株阳性拟南芥T2代种子的油体蛋白,以野生型拟南芥种子的油体蛋白作阴性对照,进行SDS-PAGE分析。由图7可见,转基因植株oleosin-MT 2~5号在26 ku处都有条带,初步证明oleosin-MT基因已在拟南芥T2代种子中得到表达。
2.5 MT蛋白的抗氧化活性检测
2.5.1 超氧阴离子清除能力 邻苯三酚吸光度值的测定结果见表1。

表1 邻苯三酚自氧化速率及其吸光值的变化Table 1 Changes of autoxidation rate and absorption value of pyrogallol
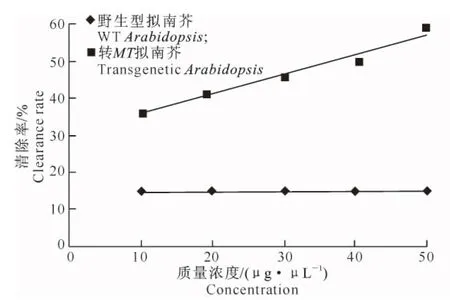
图8 转基因拟南芥植株中MT蛋白的超氧阴离子清除活性Fig.8 Scavenging effect of MT protein from transgenetic Arabidopsis on superoxide anion free radical
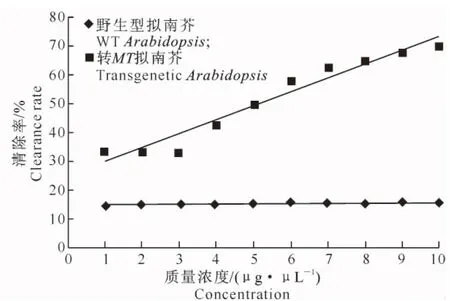
图9 转基因拟南芥植株中MT蛋白对羟自由基的清除能力Fig.9 Hydroxyl radical scavenging activity of MT protein from transgenic Arabidopsis
2.5.2 羟自由基清除能力 以野生型拟南芥作为对照,考察金属硫蛋白清除羟自由基(·OH)的能力。由图9可以看出,随金属硫蛋白质量浓度的升高,转MT基因拟南芥的油体蛋白对·OH的清除能力亦逐渐增强。当金属硫蛋白的质量浓度增加至10 μg/μL时,清除率可达到69.7%。而在野生型拟南芥中,金属硫蛋白对羟自由基仅有微弱的清除能力,且随着金属硫蛋白质量浓度的升高,清除率变化并不明显。
3 结论与讨论
金属硫蛋白含有丰富的半胱氨酸残基,能通过半胱氨酸 (Cys)上的巯基 (-SH) 与金属离子结合,具有解除金属离子毒害以及调节体内金属离子平衡的作用[17-18]。目前,对植物金属硫蛋白功能的研究正在逐步深入。金属硫蛋白基因中丰富的巯基及其与重金属的结合能力,决定了其功能的多样性[19]。Xue等[20]在筛选棉花(Gossypiumhirsutum)cDNA 文库时发现,MT基因GhMT3a能在氧化胁迫的逆境条件下上调表达;但当有外源抗氧化物质存在时,GhMT3a在逆境条件下的上调表达会受到抑制,暗示GhMT3a可能具有抗氧化功能。植物金属硫蛋白所具有的抗氧化活性受到广泛关注,预示在植物中可能存在另一种新型高效的抗氧化系统,且其在植物中发挥着重要作用。
吉林农业大学生物反应器与药物开发教育部工程研究中心保存的pOP质粒(含有Basta筛选标记基因)是植物油体蛋白特异性表达载体,该载体加入了特异性的菜豆启动子和终止子、35S启动子、oleosin基因、Bar基因等作用原件。首先,利用此载体将oleosin基因编码的终止子TAA密码子修饰去除,使得油体蛋白与目的蛋白更易于融合表达;然后,选用菜豆特异性启动子和终止子(phaP、phaT),使转基因种子中的目的基因可以更好地特异性表达;最后,添加Bar基因的35S启动子和NOS poly A终止子,以Bar基因作为抗性筛选标记,便于转基因植株的筛选,为后续转基因植株的培育提供了便利条件。
目前,商品化的MTs 大多从兔肝中诱导提取,其生产成本高、价格昂贵,寻找廉价且含有丰富MTs 的新资源是降低生产成本及扩大其应用领域的重要途径。本研究对转MT基因拟南芥种子与野生型拟南芥种子的总蛋白进行SDS-PAGE分析,初步证实融合蛋白oleosin-MT在拟南芥种子中有表达。野生型拟南芥中金属硫蛋白对超氧自由基虽然有微弱的清除能力,但是随着蛋白质量浓度的升高,清除率变化不明显,且均小于20%,而转MT基因拟南芥总蛋白质量浓度达到50 μg/μL时,超氧阴离子的清除率达到最高,为58.5%。转MT基因拟南芥总蛋白质量浓度增加至10 μg/μL时,羟自由基清除率可达69.7%,表明转MT基因拟南芥具有较高的抗氧化活性。研究拟南芥种子中表达的金属硫蛋白的生物学活性,为下一步将融合基因导入红花油体系统表达奠定了理论基础。
[1] 李晓伟,鲁 曼.金属硫蛋白对铅中毒儿童临床干预观察研究 [J].中国儿童保健杂志,2008(4):391-393.
Li X W,Lu M.Prospective study on effect of complement of metallothionein on lead poisoning children [J].Chinese Journal of Child Health Care,2008(4):391-393.(in Chinese)
[2] Margoshes M,Valleeb L.A cadmium protein from equine kidney cretex [J].J Am Chem Soc,1957,79(17):4813-4814.
[3] Kagi J H R.Evolution,structure and chemical activity of class Ⅰmetallothioneins:An overview [C]//Suzuki K T,Imura N,Kimura M.Metallothionein Ⅲ:Biological Roles and Medical Implications.Basel,Switzerland:Birkhäuser Verlag,1993:29-55.
[4] 代 勋,龚 明.植物金属硫蛋白在植物抗逆性中的作用 [J].宁夏师范学院学报:自然科学版,2011,32(3):47-51.
Dai X,Gong M.The function of plant metallothioneins in plant resistence [J].Journal of Ningxia Teachers University:Natural Science,2011,32(3):47-51.(in Chinese)
[5] Mariana O,Luis W,Laurent L,et al.Functional analysis of the metallothionein genecgMT1 isolated from the actinorhizal treeCasuarinaglauca[J].Mol Plant Microbe Interact,2007,20(10):1231-1240.
[6] Lane B,Kajioka R,Kennedy T.The wheat-germ Ec protein is a zinc-containing metallothionein [J].Biochemistry and Cell Biology,1987,65(11):1001-1005.
[7] Zhou J,Goldsbrough P B.Structure,organization and expression of the metallothionein gene family inArabidopsis[J].Molecular and General Genetics MGG,1995,248(3):318-328.
[8] Lee J,Shim D,Song W Y,et al.Arabidopsismetallothioneins 2a and 3 enhance resistance to cadmium when expressed inViciafabaguard cells [J].Plant Mol Biol,2004,54(6):805-815.
[9] Evans K M,Gate house J A,Lindsay W P,et al.Expression of the pea metallothionein-like genePsMTAinE.coliandArabidopsisthalianaand analysis of trace metal accumulation:Implications forPsMTAfunction [J].Plant Mol Biol,1992,20(6):1019-1028.
[10] Kille P,Winge D R,Harwood J L,et al.A plant metallothionein produced inE.coli[J].FEBS Lett,1991,12(295):171-175.
[11] 张晓钰,茹炳根.植物类MT与植物络合肽 [J].生命科学,2000,12(4):170-172.
Zhang X Y,Ru B G.Plant metallothionein and phytochelatins [J].Life Sciences,2000,12(4):170-172.(in Chinese)
[12] 张博润,蔡向荣,怀文辉,等.金属硫蛋白的研究进展及应用前景 [J].微生物学通报,1999,26(5):355-357.
Zhang B R,Cai X R,Huai W H,et al.Research progress and application prospects of metallothionein [J].Microbiology,1999,26(5):355-357.(in Chinese)
[13] 韩少华,朱靖博,王妍妍.邻苯三酚自氧化法测定抗氧化活性的方法研究 [J].中国酿造,2009(6):155-157.
Han S H,Zhu J B,Wang Y Y.Measurement of antioxidant activity by pyrogallol autoxidation [J].China Brewing,2009(6):155-157.(in Chinese)
[14] 玄红专,桑 青,麻建军.邻苯三酚法自氧化法测定不同蜂产品抗氧化活性的研究 [J].食品科技,2008(4):137-139.
Xuan H Z,Sang Q,Ma J J.Anti-oxidation study of different bee products measured by pyrogalbl autoxidation method [J].Food Science and Technology,2008(4):137-139.(in Chinese)
[15] 李连平,黄志勇,王志聪,等.小球藻锌结合金属硫蛋白Zn-MT-like的抗氧化活性研究 [J].中国食品学报,2009,8(4):24-27.
Li L P,Huang Z Y,Wang Z C,et al.Study on anti-oxidation activity of Zn-MT-like induced fromC.vulgaris[J].Journal of Chinese Institute of Food Science and Technology,2009,8(4):24-27.(in Chinese)
[16] 王晓宇,杜国荣,李 华.抗氧化能力的体外测定方法研究进展 [J].食品与生物技术学报,2012,31(3):247-250.
Wang X Y,Du G R,Li H.Progress of analytical methods for antixidant capacityinvitro[J].Journal of Food Science and Biotechnology,2012,31(3):247-250.(in Chinese)
[17] Kawashima I,Inokuchi Y,Chino M,et al.Isolation of a gene for a metallothionein protein from soybean [J].Plant Cell Physiol,1991,32:913-916.
[18] 全先庆,高成香,王兴军,等.花生金属硫蛋白基因AhMT3a的克隆及其表达 [J].生物技术通报,2012(3):75-79.
Quan X Q,Gao C X,Wang X J,et al.Cloning and expression analysis ofAhMT3ain peanut [J].Biotechnology Bulletin,2012(3):75-79.(in Chinese)
[19] 王 巍,谢 波,刘 芳,等.九州虫草中金属硫蛋白的诱导、提纯及性质研究 [J].安徽医药,2013,17(3):373-375.
Wang W,Xie B,Liu F,et al.Induction,purification and nature of metallothionein in Kyushu Cordyceps [J].Anhui Medical and Pharmaceutical Journal,2013,17(3):373-375.(in Chinese)
[20] Xue T,Li X,Zhu W,et al.Cotton metallothioneinGhMT3a,a reactive oxygen species scavenger,increased tolerance against abiotic stress in transgenic tobacco and yeast [J].Journal of Experimental Botany,2009,60:339-349.
Expression and identification of oleosin-MT fusion protein inArabidopsis
GUAN Li-lia,b,CHEN Yua,b,ZHU Donga,b,HAN Yi-laia,b,CUI Qia,b,LI Hai-yana,b,LI Xiao-kuna,JIANG Chaoa
(aMinistryofEducationBioreactorandDrugDevelopmentReseachCenter;bCollegeofLifeScience,JilinAgriculturalUniversity,Changchun,Jilin130118,China)
【Objective】 This study obtainedMTgene transgenicArabidopsisthaliana plants to improve the plant bioreactor technology and reduce the cost of separation and purification of therapeutic proteins.【Method】 Molecular biology method (PCR) was used to amplifyMTandoleosinfusion gene.Then,oleosin-MTgene was cloned into the expression vector pOP to construct recombinant plasmid pOP-oleosin-MT and the freeze-thaw method was used to transfer plasmid pOP-oleosin-MT intoAgrobacteriumtumefaciensEHA105.It was transformed intoArabidopsisbyAgrobacterium-mediated.Positive transgenic plants were determined by PCR analysis and SDS-PAGE.Antioxidant activity analysis of MT protein was also detected by pyrogallol autoxidation method and crystal violet method.【Result】 Plant binary expression vector pOP-Oleosin-MT was successfully constructed.SDS-PAGE showed that the fusion protein expressed inArabidopsisseeds with a molecular weight of 26 ku.Invitroantioxidant activity assay showed that the superoxide anion free radical clearance rate was the highest of 58.5% when MT protein concentration was 50 μg/μL.Total protein concentration was 10 μg/μL and hydroxyl radical scavenging rate was 69.7%,indicating that transgenicArabidopsishad high antioxidant activity.【Conclusion】Arabidopsislines withMTgene were successfully obtained,and it was proved that recombinant protein had good antioxidant activity.
MT protein;Arabidopsisthaliana;oleosin protein;gene expression
时间:2015-09-09 15:41
10.13207/j.cnki.jnwafu.2015.10.021
2014-03-11
国家高技术研究发展计划(863)项目(2011AA100606);国家自然科学基金项目(31201237,31101172);吉林省科技厅中青年领军人才及优秀创新团队项目(20111815);教育部博士点基金青年教师基金项目(20122223120002);吉林省科技型中小企业创新基金项目(13C26212201223)
官丽莉(1982-),女,吉林梅河口人,实验师,主要从事药用植物与生物技术研究。 E-mail:guanll2004@163.com
姜 潮 (1955-),男,加拿大人,博士,研究员,主要从事植物生物反应器研究。E-mail:chaojiang10@hotmail.com
Q943.2
A
1671-9387(2015)10-0155-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150909.1541.042.html
