紫苏内生真菌Penicillium sp.12Y25化学成分及抑菌活性研究
2015-01-07李晓君李梦雪李会珍张志军
李晓君,陈 铁,李梦雪,李会珍,张志军
(中北大学 化工与环境学院,山西 太原 030051)
紫苏内生真菌Penicilliumsp.12Y25化学成分及抑菌活性研究
李晓君,陈 铁,李梦雪,李会珍,张志军
(中北大学 化工与环境学院,山西 太原 030051)
【目的】 研究紫苏内生真菌Penicilliumsp.12Y25的化学成分及其抑菌活性,为开发新型天然药物提供参考。【方法】 以分离自山西太原健康紫苏茎秆的内生真菌为研究对象,采用硅胶柱层析和Sephadex LH-20凝胶柱层析等分离手段和现代光谱学技术,对其液体发酵产物的乙酸乙酯提取物进行了分离和结构鉴定;采用菌丝速率法,测试了分离化合物对番茄灰霉病菌、西瓜枯萎病菌和小麦赤霉病菌等植物病原菌的抗菌活性。【结果】 从紫苏茎秆内生真菌Penicilliumsp.12Y25发酵产物的乙酸乙酯提取物中分离鉴定了10个化合物,分别为麦角甾醇过氧化物麦角甾-4,6,8,22-四烯-3-酮、9(11)-去氢麦角甾醇过氧化物、22E,24R-7,22-麦角甾二烯-3β,5α,6β-三醇、22E,24R-7,22-麦角甾二烯-3β,5α,6β,9α-四醇、麦角甾醇、单油酸甘油酯、α-亚麻酸、对甲氧基苯乙酸和对氨基苯乙酸,均为首次从该菌种中分离得到,其中22E,24R-7,22-麦角甾二烯-3β,5α,6β-三醇和22E,24R-7,22-麦角甾二烯-3β,5α,6β,9α-四醇对番茄灰霉菌和西瓜枯萎菌有中等强度的抑制活性。【结论】 紫苏内生真菌Penicilliumsp.12Y25化学成分多样,部分化合物具有植物病原菌抗菌活性。
紫苏;内生真菌;化学成分;抗菌活性
植物内生真菌是指寄生于健康植物中,并在其各种组织、器官和细胞间隙中度过全部或近乎全部生活周期而不使寄主表现任何症状的一类真菌。目前已知的植物中几乎都发现有内生真菌的存在,且从不同植物体内或同一植物不同时期分离到的内生真菌数量差异性较大[1]。在长期的演化过程中,植物内生真菌与寄主植物形成了互利共生关系,一方面植物内生真菌可以利用寄主植物提供的生长环境,吸收寄主植物的营养物质供自己生长;另一方面,内生真菌在植物生长发育尤其是逆境生长过程中发挥着重要作用,而维持这种关系的物质基础最重要的就是由植物内生真菌产生和(或)由其诱导刺激宿主植物合成的次生代谢产物。因此,对于药用植物资源而言,研究其内生真菌既可以避免大规模采摘对植物资源的破坏,也可以解决某些植物生长周期漫长、资源紧缺等因素带来的药源紧张问题,利用植物内生真菌进行工业化发酵将为某些重要天然药物的开发与研究提供新思路和新方法[1]。
紫苏(Perillafrutescens)系唇形科紫苏属一年生草本植物,为我国传统的药食、油料作物,作为一种多用途的经济植物其在我国已有2 000余年的栽培历史,现广泛分布于东亚各国[2]。紫苏是卫生部第一批规定的既是药物又是食品的60种作物之一,其环境适应性强,耐贫瘠耐寒,非常适于在土壤干旱和贫瘠地区大面积种植。现代医学研究表明,紫苏具有降血脂血压、保护肝脏、抑制血小板凝集、预防癌变、减少血栓形成、提高记忆能力、抗过敏、抗炎、抗微生物和保护视力等功效[2]。本课题组已经对分离自健康紫苏叶子的曲霉属真菌Aspergillussp.12Y03的化学成分进行了研究,鉴定出的化合物包括环肽、甾醇和脂肪酸3种类型,并测试了相关化合物的海虾致死活性[3]。本研究对另一株紫苏内生真菌Penicilliumsp.12Y25的次生代谢产物进行了分离鉴定研究,并分析了所分离化合物对部分植物病原菌的抑制活性,以期为该内生真菌的开发利用提供支持。
1 材料与方法
1.1 材料与仪器
紫苏内生真菌Penicilliumsp.12Y25自山西太原的健康紫苏(P.frutescens)茎秆中分离得到,经过形态学鉴定为曲霉属,菌种保藏于中北大学生物资源化工研究所。
主要仪器有Avance Ⅲ 500MHz核磁共振波谱仪、Thermo DSQ-Ⅱ和Thermo Fisher LTQ Fleet型质谱仪、Rudolph Autopol Ⅲ型旋光仪、XRG-1显微熔点仪(温度计未校正)、柱层析硅胶和薄层层析硅胶(均购自青岛海洋化工厂)、Sephadex LH-20和RP-18(均为Merk公司产品)。
1.2 内生真菌代谢产物的提取与分离
将保藏菌种在PDA培养基(土豆 200 g,葡萄糖 20 g,琼脂粉 16 g,用水定容至1 L)上进行活化。将活化好的菌种接入发酵培养基(土豆 200 g,葡萄糖 20 g,KH2PO40.5 g,MgSO40.5 g,用水定容至1 L,pH 6.5~7.0),28 ℃、120 r/min 培养7 d,总计发酵30 L。发酵结束后,过滤得菌丝体与发酵液。将菌丝体用甲醇超声(15 min)提取3次,浓缩有机相得甲醇浸膏,适量温水溶解后用等体积乙酸乙酯萃取3次,回收有机相得乙酸乙酯浸膏10.8 g;发酵液用等体积乙酸乙酯萃取3次,回收有机相得乙酸乙酯浸膏8.3 g,合并两部分浸膏。浸膏经过硅胶粗分、氯仿-甲醇梯度洗脱,得到6个组分(Fr.A~F)。其中Fr.A组分经反复硅胶柱层析、Sephadex LH-20甲醇凝胶柱层析和重结晶,得到化合物1(30 mg)、2(35 mg)、3(30 mg)、4(50 mg);Fr.B组分经过硅胶柱层析和重结晶得到化合物5(30 mg)和6(60 mg);Fr.C组分经Sephadex LH-20甲醇凝胶柱层析和硅胶柱层析得到化合物7(100 mg)和8(150 mg);Fr. E组分经硅胶柱层析和PTLC制备得到化合物9(10 mg)和10(15 mg)。
1.3 分离化合物的抗菌活性测试
采用菌丝生长速率法,测定了10种化合物在100 μg/mL质量浓度下对番茄灰霉病菌(Botrytiscinerea)、西瓜枯萎病菌(Fusariumoxysporiumf.sp.Niveum)和小麦赤霉病菌(Gibberellasaubinetti)3种植物病原菌的抗菌活性。用PDA培养基配制含测试样品(丙酮溶解)的无菌带药平板,用直径4 mm的打孔器在预先培养好的植物病原真菌菌落边缘制取菌饼,分别接种到带药平板,每皿接种3个,每处理重复3次,以等量溶解化合物所用的丙酮为空白对照,以相同质量浓度的多菌灵为阳性对照。(28±0.5) ℃下培养3 d,十字交叉法测定菌落直径,计算相对抑制率(I)[4]。计算公式为:
I=[(C-T)/C]×100%。
式中:I为菌丝生长相对抑制率,C为空白对照的菌落直径,T为处理的菌落直径。
2 结果与分析
2.1 分离化合物的结构鉴定
通过正相硅胶、反相硅胶和凝胶柱层析等分离技术,从紫苏内生真菌Penicilliumsp.12Y25发酵产物的乙酸乙酯提取物中共分离得到10个化合物,借助核磁共振(NMR)和质谱(MS)等波谱学方法,并参考相关文献[5-14]对化合物的结构进行了鉴定,具体鉴定结果如下:

图1 化合物1~10的化学结构
化合物8:黄色油状物;1H-NMR (500 MHz,CDCl3)δ2.33 (2H,t,J=7.4 Hz,H-2),1.70~1.56 (2H,m,H-3),1.40~1.15 (8H,m,H-4~H-7),1.93 (4H,m,H-8,17),5.59~5.13 (6H,m,H-9,10,12,13,15,16),2.85 (4H,m,H-11,14),0.97 (3H,t,J=7.3 Hz,H-18);13C-NMR (125 MHz,CDCl3)δ180.1 (C-1),34.2 (C-2),24.5 (C-3),29.1 (C-4),29.2 (C-5),29.3 (C-6),30.0 (C-7),27.5 (C-8),130.5 (C-9),127.9 (C-10),25.5 (C-11),128.6 (C-12,13),26.0 (C-14),127.7 (C-15),132.7 (C-16),20.4 (C-17),14.6 (C-18)。以上数据与文献[12]报道一致,鉴定化合物8为α-亚麻酸(图1-(8))。
化合物9:白色粉末;mp.84~86 ℃;ESI-MS (negative)m/z165 [M-H]-;1H-NMR (500 MHz,CDCl3) δ 7.20 (2H,d,J=8.5 Hz,H-2,6),6.75 (2H,d,J=8.5 Hz,H-3,5),3.70 (3H,s,OMe),3.60 (2H,s,H-7);13C-NMR (125 MHz,CDCl3)δ130.5 (C-1),125.6 (C-2,6),115.5 (C-3,5),155.0 (C-4),40.5 (C-7),173.0 (C-8),52.0 (OMe)。以上数据与文献[13]报道一致,将化合物9鉴定为对甲氧基苯乙酸(图1-(9))。
化合物10:白色结晶;mp.200~202 ℃;ESI-MS (positive)m/z152 [M+H]+,174 [M+Na]+;1H-NMR (500 MHz,C5D5N) δ 7.40 (2H,d,J=8.5 Hz,H-2,6),7.15 (2H,d,J=8.5 Hz, H-3,5),3.72 (2H,s,H-7),7.78 (2H,s,NH);13C-NMR (125 MHz,C5D5N) δ 127.5 (C-1),131.0 (C-2,6),116.5 (C-3,5),157.7 (C-4),43.0 (C-7),174.3 (C-8)。以上数据与文献[14]报道一致,鉴定化合物10为对氨基苯乙酸(图1-(10))。
2.2 化合物1~10的生物活性测试
采用菌丝生长速率法测试化合物1~10对3种植物病原菌的生物活性,结果(表1)显示,与阳性对照多菌灵相比,10个化合物(100 μg/mL)对3种植物病原菌菌丝生长的抑制作用都较低。6个甾醇类化合物(化合物1~6)中,化合物4和5对番茄灰霉病菌和西瓜枯萎病菌菌丝生长的相对抑制率分别为52.3%,55.1%和55.6%,50.8%;而其余4个化合物的抗菌活性较弱,对上述2种病菌菌丝生长的相对抑制率为15.1%~18.1%和13.4%~21.3%。分析其结构可知,在甾体母环上化合物4和5均连有羟基,而其他4个化合物则没有,由此可以推测羟基的存在对甾醇类化合物的抗植物病原菌活性有增强作用。
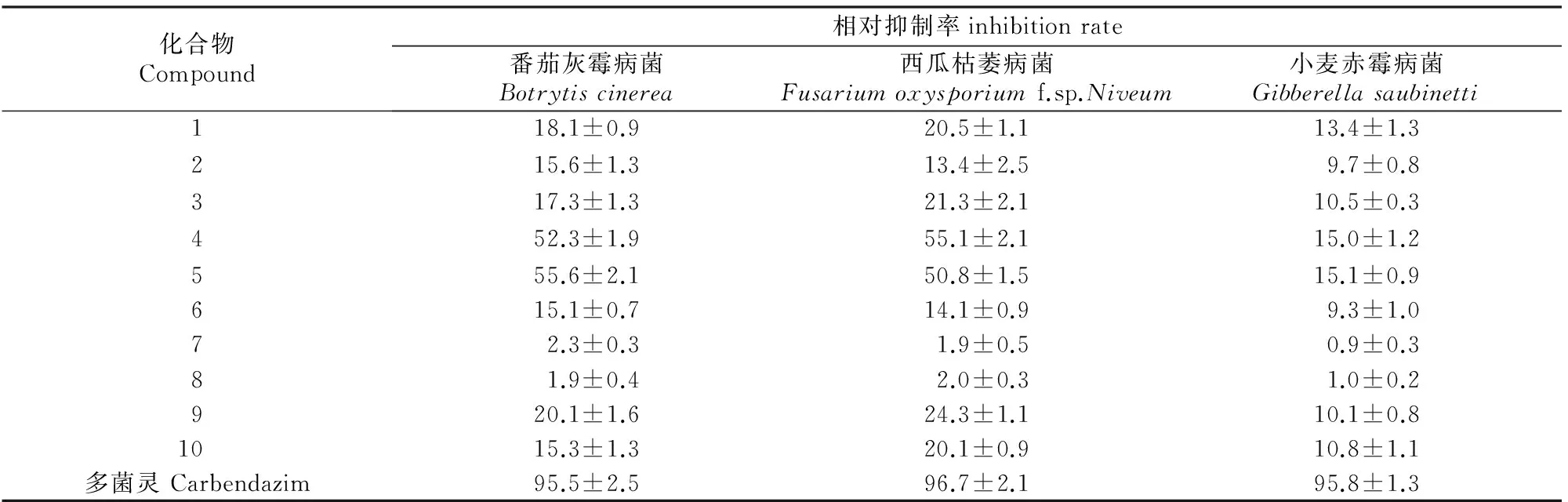
表1 100 μg/mL化合物1~10对3种植物病原菌的抗菌活性Table 1 Inhibitory effects of compounds 1-10 against three phytopathogenic fungi (100 μg/mL) %
3 讨 论
本研究从紫苏内生真菌Penicilliumsp.12Y25液体发酵产物的乙酸乙酯提取物中分离鉴定了10个化合物,分别为麦角甾醇过氧化物、麦角甾-4,6,8,22-四烯-3-酮、9(11)-去氢麦角甾醇过氧化物、22E,24R-7,22-麦角甾二烯-3β,5α,6β-三醇、22E,24R-7,22-麦角甾二烯-3β,5α,6β,9α-四醇、麦角甾醇、单油酸甘油酯、α-亚麻酸、对甲氧基苯乙酸和对氨基苯乙酸,均为首次从该菌种中分离得到。在鉴定的化合物中,化合物1~6为甾醇类化合物,广泛分布于植物、大型真菌和丝状真菌中,该类化合物大多具有生物活性,包括抗菌和细胞毒活性[15]等,具有广泛的开发应用前景。
分离自紫苏内生真菌Aspergillussp.12Y03的10个化合物中,有6个环二肽类、2个脂肪酸类和2个甾醇类化合物[3];而本研究表明,分离自Penicilliumsp.12Y25的10个化合物中有6个甾醇类、2个脂肪酸类和2个苯乙酸类化合物,二者仅有2个化合物相同。鉴于两者的次生代谢产物类型不同,结合相关文献,本研究对分离得到的化合物进行了植物病原菌抗菌活性测试,结果显示,仅有22E,24R-7,22-麦角甾二烯-3β,5α,6β-三醇(化合物4)和22E,24R-7,22-麦角甾二烯-3β,5α,6β,9α-四醇(化合物5)对番茄灰霉病菌和西瓜枯萎病菌有中等强度的抗菌活性,其在100 μg/mL质量浓度下对菌丝生长的相对抑制率为50.8%~55.6%,其余化合物的抗菌活性较弱。Aspergillussp.12Y03和Penicilliumsp.12Y25 2株内生真菌虽然均来自于山西太原地区的紫苏,但分别分离于健康紫苏的茎秆和叶子,导致两者分属不同的种属,进而其次生代谢产物也具有很大的差异,这与银杏内生真菌化学成分的研究结果类似[16-20],分离植物的地域、采集时期和分离部位等的差异将导致植物内生真菌种属和次生代谢产物的不同。所以在不同条件下多次进行同一种植物内生真菌的分离和筛选,不仅有利于全面了解植物内生真菌的生物多样性,而且对植物内生菌来源的新型和高活性天然产物的获得具有重要意义。
[1] Strobel G A.Rainforest endophytes and bioactive products [J].Critical Reviews in Biotechnology,2002,22(4):315-333.
[2] Zhang Z J,Li H Z,Qiao S J,et al.Effect of salinity on seed germination,seedling growth,and physiological characteristics ofPerillafrutescens[J].Plant Biosystems,2012,146(2):245-251.
[3] 高 义,李虎强,张志军,等.紫苏内生真菌Aspergillussp.12Y03化学成分研究 [J].西北植物学报,2013,33(7):1473-1477.
Gao Y,Li H Q,Zhang Z J,et al.Chemical constituents from an endophytic fungusAspergillussp.12Y03 isolated fromPerillafrutescens[J].Acta Bot Boreal-Occident Sin,2013,33(7):1473-1477.(in Chinese)
[4] Zhang J W,Gao J M,Xu T,et al.Antifungal activity of alkaloids from the seeds ofChimonanthuspraecox[J].Chemistry & Biodiverstiry,2009,6(6):838-845.
[5] 高锦明,董泽军,刘吉开.蓝黄红菇的化学成分 [J].云南植物研究,2000,22(1):85-89.
Gao J M,Dong Z J,Liu J K.Constituents of basidiomycetesRussulacyanoxantha[J].Acta Botanica Yunnanica,2000,22(1):85-89.(in Chinese)
[6] Chobot V,Opletal L,Jahodar L,et al.Ergosta-4,6,8,22-tetraen-3-one from the edible fungus,Pleurotusostreatus(oyster fungus) [J].Phytochemistry,1997,45(8):1669-1671.
[7] Fujimoto H,Nakayama M,Nakayama Y,et al.Isolation and characterization of immunosuppressive components of three mushrooms,Pisolithustinctorius,MicroporusflabelliformisandLenzitesbetulina[J].Chemical & Pharmaceutical Bulletin,1994,42(3):694-697.
[8] Gao J M,Hu L,Liu J K.A novel sterol from Chinese trufflesTuberindicum[J].Steroids,2001,66(10):771-775.
[9] Yue J M,Chen S N,Lin Z W,et al.Sterols from the fungusLactariumvolemus[J].Phytochemistry,2001,56(8):801-806.
[10] 安熙强,李宗主,沈连刚,等.阳春砂仁的化学成分研究 [J].天然产物研究与开发,2011,23(6):1021-1024.
An X Q,Li Z Z,Shen L G,et al.Chemical constituents ofAmomumvillosumLour. [J].Natural Product Research and Development,2011,23(6):1021-1024.(in Chinese)
[11] Li X J,Gao J M,Chen H,et al.Toxins from a symbiotic funus,Leptographiumqinlingensisassociated withDendroctonusarmandiand theirinvitrotoxicities toPinusarmandiseedings [J].European Journal of Plant Pathology,2012,134(2):239-247.
[12] 喻晓雁.鸡矢藤化学成分研究 [J].中草药,2011,42(4):661-663.
Yu X Y.Chemical constituents ofPaederiascandens[J].Chinese Traditonal and Herbal Drugs,2011,42(4):661-663.(in Chinese)
[13] 白玉华,于 辉,孙世芹,等.日本苦苣菜化学成分研究 [J].药学与临床研究杂志,2008,16(6):444-445.
Bai Y H,Yu H,Sun S Q,et al.Study on chemical constituents of Japanese herbSonchusoleraceus[J].Pharmaceutical and Clinical Research,2008,16(6):444-445.(in Chinese)
[14] Ahmed H B,Fawzy M A,Ahmed M E A,et al.Preparation of 4-aminophenylacetic acid derivatives with promising antimicrobial activity [J].Acta Pharmaceutica,2006,56(3):273-284.
[15] Takei T,Yoshida M,Ohnishi-Kameyyama M,et al.Erogosterol peroxide,an apoptosis-inducing component isolated fromSarcodonaspratus(Berk.) S.Ito [J].Bioscience Biotechnology and Biochemistry,2005,69(1):212-215.
[16] Qin J C,Gao J M,Zhang Y M,et al.Polyhydroxylated steroids from an endophytic fungus,ChaetomiumglobosumZY-22 isolated fromGinkgobiloba[J].Steroids,2009,74(9):786-790.
[17] Yan T,Guo Z K,Jiang R,et al.New flavonol and diterpenoids from the endophytic fungusAspergillussp.YXf3 [J].Planta Medica,2013,79(5):348-352.
[18] Li H Q,Li X J,Wang Y L,et al.Antifungal metabolites fromChaetomiumglobosum,an endophytic fungus inGinkgobiloba[J].Biochemical Systematics and Ecology,2011,39(4/5/6):876-879.
[19] Li X,Tian Y,Yang S X,et al.Cytotoxic azaphilone alkaloids fromChaetomiumglobosumTY1 [J].Bioorganic Medicinal Chemistry Letters,2013,23(10):2945-2947.
[20] Liu X,Dong M,Chen X,et al.Antimicrobial activity of an endophyticXylariasp.YX-28 and identification of its antimicrobial compound 7-amino-4-methylcoumarin [J].Applied Microbiology and Biotechnology,2008,78(2):241-247.
Chemcial constituents and antimicrobial activities of endophytic fungusPenicilliumsp.12Y25 isolated fromPerillafrutescens
LI Xiao-jun,CHEN Tie,LI Meng-xue,LI Hui-zhen,ZHANG Zhi-jun
(CollegeofChemicalandEnvironmentalEngineering,NorthUniversityofChina,Taiyuan,Shanxi030051,China)
【Objective】 This study investigated the chemical constituents and antimicrobial active metabolites of endophytic fungusPenicilliumsp.12Y25 fromPerillafrutescensto provide reference for the development of new natural products.【Method】 This study used an endophytic fungus isolated from healthy stem ofP.frutescensin Taiyuan,Shanxi.The leavening ofPenicilliumsp.12Y25 was extracted with EtOAc,and the EtOAc extract was separated by silica gel CC and Sephadex LH-20.The structures of compounds were elucidated by spectroscopic methods,andinvitroantifungal activities of isolated compounds againstBotrytiscinerea,Fusariumoxysporiumf.sp.NiveumandGibberellasaubinettiwere evaluated by mycelial growth inhibitory rate method.【Result】 A total of ten compounds were isolated from the EtOAc extract ofPenicillumsp.12Y25 including ergosterol peroxide,such as ergosta-4,6,8,22-tetraen-3-one,9(11)-dehydroergosterol peroxide,cerevisterol,22E,24R-ergosta-7,22-diene-3β,5α,6β,9α-tetraol,ergosterol,glycerol-1-monooleate,α-linolenic acid,4-methoxyphenylacetic acid,and 4-aminophenylacetic acid.All compounds were isolated from this fungus for the first time.Compounds cerevisterol and 22E,24R-ergosta-7,22-diene-3β,5α,6β,9α-tetraol had moderate inhibitory effects againstB.cinereaandF.oxysporiumf.sp.Niveum.【Conclusion】 There were various chemical components from the endophytic fungusPenicilliumsp.12Y25,and some of them showed moderate inhibitory activities against phytopathogenic fungi.
Perillafrutescens;endophytic fungus;chemical constituents;antimicrobial activities
时间:2015-09-09 15:41
10.13207/j.cnki.jnwafu.2015.10.009
2014-03-10
山西省回国留学人员科研资助项目(2013-080);山西省国际科技合作项目(2013081004)
李晓君(1983-),男,山西忻州人,讲师,博士,主要从事天然产物化学研究。E-mail:xiaojunfeiyan@163.com
张志军(1973-),男,山西盂县人,教授,博士,博士生导师,主要从事天然产物化学研究。 E-mail:zjzhang@nuc.edu.cn
Q501;Q503
A
1671-9387(2015)10-0064-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150909.1541.018.html
