Graves′病患者CD4+CD25+调节性T细胞功能初探
2015-01-07孙伟莉李卫鹏张林杰
孙伟莉,申 勇,李卫鹏,袁 媛,张林杰
Graves′病患者CD4+CD25+调节性T细胞功能初探
孙伟莉1,2,申 勇2,李卫鹏2,袁 媛2,张林杰1
目的探讨调节性T细胞(Treg)在Graves’病(GD)发生中所起的作用。方法流式细胞术检测20例GD患者(GD组)和10例健康对照者(健康对照组)外周血Treg数量。3H掺入试验测定Treg与效应T细胞(Teff)共培养环境中的Treg对其增殖抑制作用,ELISA法测定白细胞介素-10(IL-10)、白细胞介素-2(IL-2)等细胞因子的浓度。结果Treg所占CD4+细胞的比例在GD组与健康对照组中差异无统计学意义。GD组的Treg抑制功能与健康对照组相比显著降低。两组之间的细胞因子浓度有一定的差异,GD组IL-10水平显著低于健康对照组,IL-2和白细胞介素-17(IL-17)水平显著高于健康对照组。结论 GD患者的Treg有功能缺陷,与甲状腺自身免疫性疾病的发病有一定的关系。Treg在GD中的诊断价值以及病理生理机制值得进一步探讨。
Graves’病;调节性T细胞;效应T细胞
Graves’病(Graves’disease,GD)是一种常见的甲状腺疾病,主要表现为机体对甲状腺抗原的免疫耐受消失、淋巴细胞浸润甲状腺组织。GD作为一种自身免疫性甲状腺疾病(autoimmune thyroid disease,AITD)是由于免疫调节失衡所致。调节性T细胞(regulatory T cells,Tregs)是具有免疫调节功能的细胞亚群,该细胞亚群具有维持免疫耐受作用:抑制免疫反应,防止自身免疫疾病的发生。Tregs通过细胞与细胞的直接接触[1],或通过产生具有免疫抑制的细胞因子如转化生长因子-β(transforming growth factor β,TGF-β)和白细胞介素-10(interleukin-10,IL-10),抑制抗原特异性T细胞,发挥免疫抑制作用[2-3]。该研究旨在通过检测分析GD患者外周血Tregs的数量以及功能状况,探讨该细胞亚群在GD发生发展中所起的作用,为该疾病的临床诊治提供参考。
1 材料与方法
1.1 病例资料GD患者20例作为GD组,其中男5例,女15例,年龄20~57(41.1±10.1)岁。诊断标准为甲状腺激素的血清学指标,即依据游离三碘甲状腺原氨酸(free iodine thyoid three original acid,FreeT3)、游离甲状腺素(free thyroxine,FreeT4)、促甲状腺激素(thyroid-stimulating hormone,TSH)以及促甲状腺激素受体抗体(thyrotropin receptor antibody,TRAB)检测结果。患者排除心、肝、脾、肺、肾等脏器病变。健康体检者10例作为健康对照组,其中男3例,女7例,年龄18~59(37.7±12.7)岁,无家族病史,排除重要脏器病变;甲状腺球蛋白抗体和甲状腺过氧化物酶抗体均为阴性。两组之间年龄、性别相匹配,差异无统计学意义。
1.2 试剂和仪器异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的鼠抗人CD4抗体、藻红蛋白(P-phycoerythrin,PE)标记的鼠抗人CD25抗体及其相匹配的同型对照、FACS Aria型流式细胞仪均购自美国BD公司;RPMI 1640培养液及胎牛血清购自美国Hyclone公司;3H胸腺嘧啶核苷(3H-thymidine,3H-TdR)购自中国科学院上海核技术开发公司;TGF-β、IL-10等细胞因子ELISA试剂盒购自美国R&D公司。
1.3 细胞分离与流式分析采集实验对象外周静脉血,肝素钠抗凝。加入Ficoll分离液,密度梯度离心(2 000 r/min、20 min)获得单个核细胞(peripheral blood mononuclear cells,PBMCs)。其中一部分PBMCs接受30 Gy的137Cs照射,作为后续免疫学试验的抗原递呈细胞(antigen-presenting cells,APC);另一部分采用FITC标记anti-CD4,PE标记anti-CD25,流式细胞仪分选,CD4+CD25+细胞作为试验中的Tregs,CD4+CD25-细胞作为试验中的效应T细胞(T effector,Teff),纯度均>95%。
1.4 细胞增殖试验新鲜分离的Teff(CD4+CD25-)和Tregs(CD4+CD25+)按照不同比例(20 000∶0,20 000∶5 000以及20 000∶10 000)在含有完全RPMI 1640培养液(含有10%的胎牛血清)的96孔圆底培养板中共培养。培养板采用抗CD3(每孔0.2 μg)包板,每孔含有可溶性anti-CD28为0.05 μg,同时每孔加入辐照的PBMCs 50 000个,作为实验的APC。置于37℃、5%CO2的湿润环境中培养。于培养第4天,收集培养液上清液用于细胞因子检测。同时,每孔加入3H-TdR 18 500 Bq,继续培养16~18 h。收集细胞,β液体闪烁仪检测,通过每分钟计数值(counts per minutes,cpm)判定细胞增殖程度。增殖百分率(%)=(共培养孔的cpm值/单独Teff的cpm值)×100%。
1.5 细胞因子检测收集各个培养孔中的培养液上清,检测TGF-β、IL-10、IL-4、IL-17、IL-5、IL-2以及干扰素-γ(interferon-γ,IFN-γ)。试验设置复孔。严格按照说明书进行操作。
1.6 统计学处理应用SPSS 16.0统计软件进行分析,数据以±s表示。两组之间的比较采用Mann-Whitney检验,多组之间比较采用单因素方差分析。
2 结果
2.1 基本临床资料比较GD组与健康对照组相比,GD组FreeT3、FreeT4、TRAB水平明显高于健康对照组(P<0.01),TSH水平明显低于健康对照组(P<0.01)。两组年龄、性别比较,差异无统计学意义。见表1。
表1 基本临床资料比较(±s)
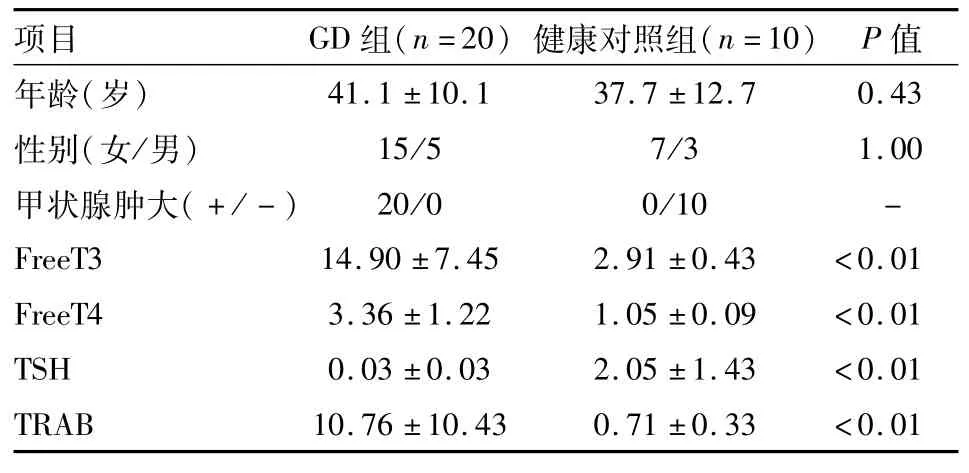
表1 基本临床资料比较(±s)
2.2 两组外周血CD4+CD25+占CD4+百分比比较GD组和健康对照组外周血CD4+细胞比例及CD4+CD25+细胞数占CD4+细胞比例比较,两组之间差异无统计学意义。见表2、图1。
表2 两组外周血CD4+细胞及CD4+CD25+/CD4+百分率的比较(%,±s)

表2 两组外周血CD4+细胞及CD4+CD25+/CD4+百分率的比较(%,±s)
2.3 CD4+CD25+Tregs对Teff的抑制功能Tregs的抑制功能体现在对Teff增殖的抑制上。实验结果显示,GD组和健康对照组的Teff在单独培养的情况下,经过anti-CD3、anti-CD28及自身APC的共同作用,两组的cpm值分别为(34 152± 5 836)、(33 286±6 820),差异无统计学意义(P=0.783)。当比例为20 000∶10 000时,GD组的Teff增殖率为(75.53±6.49)%,而健康对照组Teff增殖率为(33.50±6.82)%,GD组增殖率明显增高(P=0.001)。当比例为20 000∶5 000时,GD组的Teff增殖率为(79.61±8.12)%,而健康对照组Teff增殖率为(38.54±6.78)%,GD组增殖率明显增高(P=0.001)。提示GD组患者的Tregs的抑制功能低于健康对照组。见图2。
2.4 细胞因子浓度检测通过检测培养液中的细胞因子的浓度,健康对照组的IL-10水平显著高于GD组(P<0.05),健康对照组的IL-2、IL-17水平显著低于GD组(P<0.05);两组间其他细胞因子差异无统计学意义。见表3。提示IL-10、IL-2和IL-17有可能与Tregs发挥抑制作用有一定关系。
3 讨论
Tregs在维持免疫耐受、抑制过度免疫应答中起到至关重要的作用[4-5]。研究[6-7]报道Tregs在1型糖尿病、多发性硬化病、风湿性关节炎等自身免疫性疾病中存在缺陷,而对于AITD中的Tregs的研究较少,且观点不一。
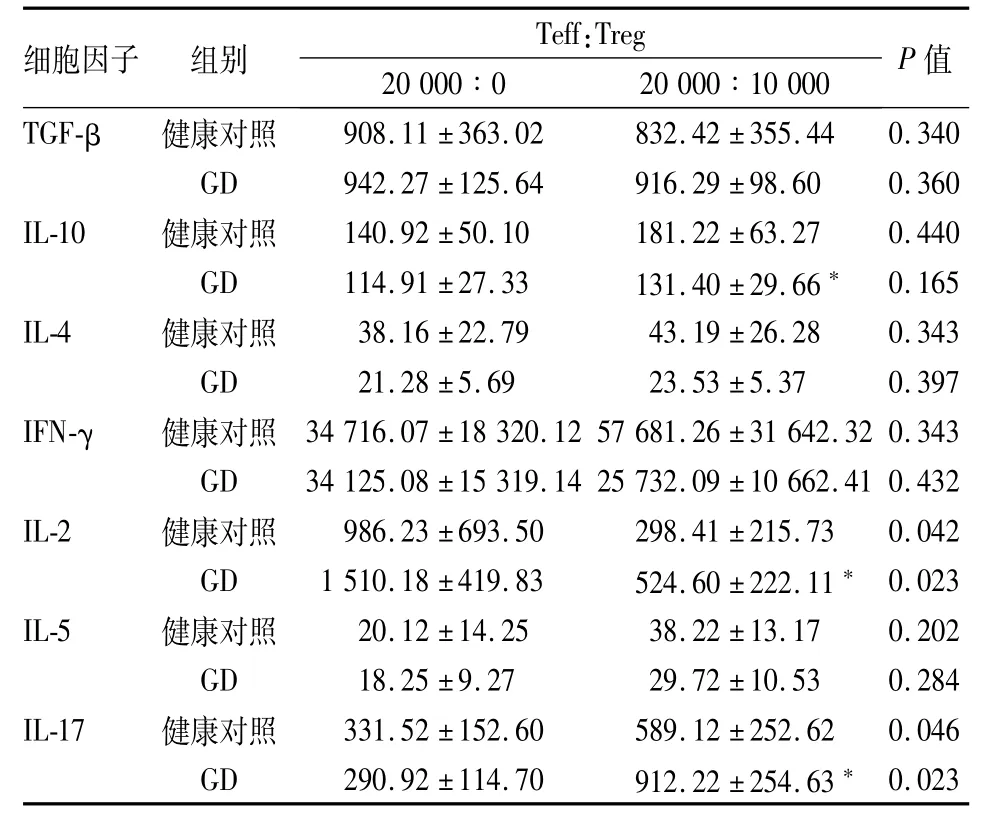
表3 培养液中的细胞因子浓度(pg/ml)
本研究GD组外周血Tregs占CD4+细胞的百分比与健康对照组相比差异无统计学意义,提示GD的发病并非是由于Tregs的数量改变所导致。本研究以Tregs对Teff增殖的影响分析了GD患者外周血中的Tregs功能,结果显示GD组与健康对照组的Teff在单独培养时其增殖程度是相当的;然而当将Teff与Tregs混合培养时,GD组Teff的增殖率明显高于健康对照组,提示GD患者的Tregs对淋巴细胞增值的控制抑制作用显著降低,淋巴细胞的增值活化能力活跃,对自身抗原的耐受降低,这可能是GD发病的重要因素之一。
研究[1-3]报道Tregs通过细胞-细胞接触以及分泌细胞因子发挥抑制作用。故而本研究进一步探讨了细胞因子TGF-β、IL-10、IL-4、IL-17、IL-5、IL-2和IFN-γ与Tregs功能之间的可能关系。在本实验中分别检测了GD组和健康对照组中的Teff单独培养以及Teff与Tregs混合培养时这些细胞因子的水平,结果显示IL-10、IL-2以及IL-17在GD组和健康对照组的Teff与Tregs混合培养中差异有统计学意义。GD组的IL-10明显低于健康对照组,IL-10作为一种负性调节因子,具有较强的免疫抑制以及免疫调控作用,主要可以抑制Teff的增殖和抑制Teff产生细胞因子如IL-2,提示GD组的Tregs功能降低与IL-10水平下降有一定的关系。IL-2作为重要的细胞生长因子,可以促进细胞增殖。当GD组的Tregs功能降低,分泌的IL-10减少,不能有效抑制Teff的活化,产生IL-2,从而促进Teff的增值,又产生更多的IL-2。本研究中GD组的IL-2明显高于健康对照组也论证了此机制。IL-17是由最新发现的一类辅助型T细胞(helper T cell,Th)17分泌的,能诱导炎症因子以及趋化因子的表达,使得更多的免疫细胞到达炎症部位加剧机体的炎症反应,较高水平的IL-17提示Tregs对Th17的抑制作用减弱[8-9]。在本研究中,观察到GD组IL-17水平高于健康对照组,也证实了GD组的Tregs存在功能缺陷。
在分析Tregs抑制功能的Teff增殖试验中,本研究采用的刺激物有anti-CD3、anti-CD28,同时采用辐照的PBMCs作为APC,即GD组采用GD患者自身的PBMCs作为APC,而健康对照组采用健康个体自身的PBMCs用做APC,APC在细胞增殖中起至关重要的作用,而且不同个体APC的主要组织相容性复合体不尽相同。有研究[10-11]报道显示,APC与自身免疫疾病有一定的关系,主要组织相容性复合体分子表型可以影响细胞的增殖以及细胞因子的生成[12-14]。GD组与健康对照组的Teff增殖是否与APC有一定关系,有待于在以后的GD动物模型试验中进一步探讨。
本研究显示GD患者外周血中的Tregs数量并未发生明显改变,而GD患者的Tregs功能存在缺陷,提示这可能与GD发生有一定关系。对于GD患者,针对性的采取纠正Tregs的靶向治疗,能否使得GD患者好转乃至痊愈,值得进一步探讨。
[1] Shevach E M.Mechanisms of foxp3+T regulatory cell mediated suppression[J].Immunity,2009,30(5):636-45.
[2] Piccirillo C A.Regulatory T cells in health and disease[J].Cytokine,2008,43(3):395-401.
[3] Tang Q,Bluestone J A.The Foxp3+regulatory T cell:a jack of all trades,master of regulation[J].Nat Immunol,2008,9(3):239-44.
[4] Brusko T M,Putnam A L,Bluestone J A.Human regulatory T cells:role in autoimmune disease and therapeutic opportunities[J].Immunol Rev,2008,223:371-90.
[5] Chatenoud L,Salomon B,Bluestone J A.Suppressor T cellsthey’re back and critical for regulation of autoimmunity[J].Immunol Rev,2001,182:149-63.
[6] Marazuela M,García-López M A,Figueroa-Vega N,et al.Regulatory T cells in human autoimmune thyroid disease[J].J Clin Endocrinol Metab,2006,91(9):3639-46.
[7] Mao C,Wang S,Xiao Y,et al.Impairment of regulatory capacity of CD4+CD25+regulatory T cells mediated by dendritic cell polarization and hyperthyroidism in Graves’disease[J].J Immunol,2011,186(8):4734-43.
[8] Voo K S,Wang Y H,Santori F R,et al.Identification of IL-17-producing FOXP3+regulatory T cells in humans[J].Proc Nati Acad Sci U S A,2009,106(12):4793-8.
[9] Beriou G,Costantino C M,Ashley C W,et al.IL-17-producing human peripheral regulatory T cells retain suppressive function[J].Blood,2009,113(18):4240-9.
[10]Brusko T M,Hulme M A,Myhr C B,et al.Assessing the in vitro suppressive capacity of regulatory T cells[J].Immunol Invest,2007,36(5-6):607-28.
[11]Jin Y,Chen X,Podolsky R,et al.APC dysfunction is correlated with defective suppression of T cell proliferation in human type 1 diabetes[J].Clin Immunol,2009,130(3):272-9.
[12]Hashimoto S,Michalski J P,Berman M A,et al.Mechanism of a lymphocyte abnormality associated with HLA-B8/DR3:role of interleukin-1[J].Clin Exp Immunol,1990,79(2):227-32.
[13]Walldén J,Ilonen J,Roivainen M,et al.Effect of HLA genotype or CTLA-4 polymorphism on cytokine response in healthy children[J].Scand J Immunol,2008,68(3):345-50.
[14]Lio D,Candore G,Romano G C,et al.Modification of cytokine patterns in subjects bearing the HLA-B8,DR3 phenotype:implications for autoimmunity[J].Cytokines Cell Mol Ther,1997,3(4):217-24.
Study on the function of CD4+CD25+regulatory T cells in patients with Graves’disease
Sun Weili1,2,Shen Yong2,Li Weipeng2,et al
(1Dept of Immunology,Anhui Medical University,Hefei 230032;2Dept of Nuclear Medicine,The First Affiliated Hospital of Bengbu Medical College,Bengbu 233004)
ObjectiveTo investigate the role of regulatory T cells(Tregs)in Graves’disease(GD).MethodsTreg number was assessed by flow cytometric analysis in samples from 20 GD patients and 10 healthy controls.The inhibitory effect of Treg on T effector cells(Teff)was assayed by3H thymidine proliferation experiment.IL-10,IL-2 and other cytokine levels were determined by ELISA in conditioned media from the co-cultures.ResultsNo differences were found in the frequency of Tregs as a percentage of CD4+cells between GD and healthy controls.Compared with the healthy controls,inhibitory function of Treg from patients with GD decreased significantly.Cytokine secretion between two groups also had significant difference.IL-10 secretion of healthy control group was significantly higher than patients group,while secretion of IL-2 and IL-17 was significantly lower than patients group.ConclusionTregs from GD patients are partly dysfunctional,possibly explaining their autoimmunity.Future work will elucidate the diagnostic potential and pathophysiology of Tregs in GD.
Graves’disease;regulatory T cells;T effector cells
R 392.6
1000-1492(2015)02-0202-04
2014-10-15接收
安徽省高校省级自然科学基金(编号:KJ2011A167)
1安徽医科大学基础医学院免疫学教研室,合肥 2300322安徽蚌埠医学院第一附属医院核医学科,蚌埠 233004
孙伟莉,女,主管技师,硕士研究生;张林杰,男,教授,硕士生导师,责任作者,E-mail:zlj33@sina.com
