酒精性脂肪肝中库普弗细胞表型变化的探讨
2015-01-07胡超杰李晚霞
程 希,胡超杰,李晚霞,黄 成,李 俊
酒精性脂肪肝中库普弗细胞表型变化的探讨
程 希1,2,3,胡超杰1,2,3,李晚霞1,2,3,黄 成1,2,3,李 俊1,2,3
目的通过建立小鼠酒精性脂肪肝(AFL)的模型,并采用肝脏原位灌流,分离出形态良好、具有生物学活性的库普弗细胞(KCs),研究其在AFL中的作用。方法采用Lieber-DeCarli液体饮食加一次急性酒精灌胃,建立小鼠AFL模型。造模周期为16 d,于第16天灌胃9 h后处死小鼠,取小鼠肝脏、血清及KCs。检测各组血清谷丙转氨酶/谷草转氨酶(ALT/AST)、肝匀浆、血清中总胆固醇/三酰甘油(TG/TC)水平变化和肝脏病理切片HE、油红染色。选取原位灌流的方法分离KCs,采用流式细胞术分析KCs表型及组成的改变。荧光实时定量PCR(qRT-PCR)检测组织及提取细胞中各细胞因子水平。结果ALT/AST、TG/TC等反应肝损伤的指标模型组显著高于对照组,HE及油红染色结果与之一致,表明小鼠AFL模型建立成功。肝脏原位灌流每只小鼠细胞得率约1.5×106~2.0×106个。以小鼠巨噬细胞表面标记分子F4/80及白细胞共同抗原CD45双标设门,流式细胞术分析F4/80和CD45双阳性细胞,在模型中肝脏固有CD68+细胞显著降低,并出现大量的浸润单核细胞。qRTPCR结果显示,在肝组织及原代KCs中细胞因子,肿瘤坏死因子(TNF-α)、白介素-6(IL-6)、单核细胞趋化蛋白(MCP-1)水平显著升高。结论 小鼠AFL模型建立成功,肝脏原位灌流法细胞得率较高,AFL的发病可能与KCs构成、表型改变,与细胞因子升高介导外周单核细胞浸润有关。
酒精性脂肪肝;原位灌流;库普弗细胞;细胞因子
酒精性肝病(alcoholic liver disease,ALD)是全球发病率和死亡率较高的慢性肝病。文献[1-2]报道,大部分的酗酒者都会形成脂肪肝,其中有20%~40%会发展为更严重的ALD。饮酒所造成酒精性肝损伤比较显著[3]。然而,饮酒如何影响ALD进展的机制尚不明确。库普弗细胞(kupffer cells,KCs)作为肝脏内定居的巨噬细胞主要功能是清除病原体,产生各种促炎因子[4],其在酒精性脂肪肝(alcoholic fatty liver,AFL)发病过程中起到了非常重要的作用。一方面,血液中的酒精能够刺激KCs;另一方面,内毒素也能够刺激KCs活化,释放细胞因子及氧自由基。文献[5-7]报道,KCs可以分为炎性浸润(CD11b+)与组织固有(CD68+)两群,共同参与机体炎症和疾病的调控。CD11b+主要功能是分泌各种细胞因子,CD68+主要功能则是修复和吞噬[8]。KCs在疾病发展中的作用不同,且在AFL中这两群细胞是如何变化还鲜少有报道。该研究建立AFL模型,提取原代KCs,旨探讨CD11b+与CD68+两群细胞和AFL发病的关系。
1 材料与方法
1.1 实验动物健康的40只C57BL/6雄性小鼠,清洁级,9~10周龄(体重≥20 g),由安徽医科大学实验动物中心提供。饲养于安徽医科大学药学院动物房。
1.2 试剂标准型Lieber-DeCarli酒精液体饲料和匹配的对照液体饲料(南通特洛菲饲料科技有限公司);丙氨酸氨基转移酶(alanine aminotransferase,ALT)测试盒、天冬氨酸氨基转氨酶(aspartate aminotransferase,AST)测试盒(南京建成生物工程研究所);总胆固醇/三酰甘油(total cholesterol/triglycerides,TG/TC)(长春汇力生物技术有限公司);Ⅳ型胶原酶、蛋白酶E、Percoll、DNA酶Ⅰ(美国Sigma公司);流式抗体Anti-Mouse F4/80 Antigen FITC、Anti-MouseCD11bPerCP-Cy5.5、Anti-MouseCD16/CD32、Anti-Mouse CD68 PE(美国Biolegend公司)。
1.3 仪器FA2004A电子天平(上海精天电子仪器厂);BT002100M型蠕动泵(保定兰格恒流泵有限公司);Napco 26100型CO2培养箱(美国杜邦公司);低速冷冻离心机(美国贝克曼公司);显微镜(日本Olympus公司);超净台(苏州净化有限公司);FACS CantoⅡ流式细胞仪(美国BD公司)。
1.4 方法
1.4.1动物模型的建立与处理 C57BL/6小鼠40只,随机分为正常组和模型组。模型组喂食Lieber-DeCarli酒精液体饲料,含67.4 ml/L的无水乙醇(药用级),对照组喂匹配的对照液体饲料。每只小鼠喂食30 ml/d。于第16天上午7~9 h酒精灌胃,9 h后处死取肝脏标本。小鼠取血后静置,3 000 r/min离心20 min,收集血清。按试剂盒说明检测ALT/AST、TG/TC含量。油红染色观察肝组织中脂肪沉积,HE染色观察肝脏病变程度。
1.5 KCs的提取
1.5.1灌流液的配制 灌注缓冲液浓缩液(perfusion buffer concentrate,PBC)(NaCl 103.75 g,KCl 6.25 g,Hepes 28.7 g,水350 ml+4%NaOH溶液75 ml加水至终体积为500 ml);灌注缓冲液(perfusion buffer,PB)(稀释40 ml已提前配好的PBC至1 L);保存缓冲液(含1%牛血清蛋白PB);酶液(加1 ml 5.474%CaCl2溶液至99 ml PB中,用前再加入胶原酶Ⅳ和蛋白酶E各35 mg);“100%”Percoll(Percoll原液13.5 ml+10×PBS 1.5 ml),50%Percoll(100%Percoll 10 ml+1×PBS 10 ml),25%Percoll(100%Percoll 5 ml+1×PBS 15 ml)。
1.5.2 肝脏灌流及细胞离心 水合氯醛(1%)麻醉小鼠、固定,小鼠背部用纸卷垫住,打开腹腔暴露肝脏,游离出门静脉和下腔静脉,穿线。从门静脉插入针头,确保针头与血管平行,结扎。剪断下腔静脉,调大灌流泵流速。待肝脏变白,将灌流液换成0.035%酶液,一般25~30 ml,消化至肝脏表面有裂纹时,游离肝脏、撕碎、过滤后离心。4℃,697 r/min离心2 min,重复离心后取上清液;换3 487 r/min离心10 min,弃上清液,用25%的Percoll重悬,铺于50%的Percoll上;4℃,3 487 r/min离心30 min。离心结束后,吸取两层不同浓度Percoll中间的液体至于50 ml离心管中,加入PBS重悬,4℃,3 487 r/min离心10 min。弃上清液,并在沉淀中加入10 ml培养基。重悬后,待检测。
1.6 流式细胞术检测细胞得率和比例取灌流所得细胞,离心后用少量生理盐水重悬,加入到流式管中,用抗小鼠CD16/CD32包被细胞,避光孵育15 min后,标记F4/80、CD45、CD68及CD11b流式抗体,孵育15 min后对各细胞群进行检测。
1.7 荧光实时定量PCR(florescent real-time quantitative PCR,qRT-PCR)检测肝组织和细胞中各细胞因子mRNA表达水平应用TRIzol试剂盒提取肝组织及原代提取KCs中总RNA,通过分光光度法测定RNA溶液的吸光度(optical density,OD)来测定RNA的含量和纯度(OD260/OD280>1.8)逆转录成cDNA后,用qRT-PCR仪检测其中各细胞因子的mRNA表达水平。IL-6上游引物:5′-GAGGATACCACTCCCAACAGACC-3′,下游引物:5′-AAGTGCATCATCGTTGTTCATACA-3′;TNF-α上游引物:5′-TGTCCCTTTCACTCACTGGC-3′,下游引物:5′-CATCTTTTGGGGGAGTGCCT-3′;磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydro genase,GAPDH)上游引物:5′-GGACCTCATGGCCTACATGG-3′,下游引物:5′-TAGGGCCTCTCTTGCTCAGT-3′;转录生长因子(transforming growth factor,TGF-β)上游引物:5′-GGACTCTCCACCTGCAAGAC-3′,下游引物:5′-CTGGCGAGCCTTAGTTTGGA-3′;白介素-10(interleukin-10,IL-10)引游引物:5′-GCTGCCTGCTCTTACTGACT-3′,下游引物:5′-CTGGGAAGTGGGTGCAGTTA-3′;单核细胞趋化蛋白(monocyte chemoattractant protein,MCP-1)上游引物:5′-TCAGCCAGATGCAGTTAACGC-3′,下游引物:5′-TGATCCTCTTGTAGCTCTCCAGC-3′。
1.8 统计学处理采用SPSS 16.0统计软件进行分析,数据以±s表示,组间比较采用t检验。
2 结果
2.1 小鼠肝体比、肝匀浆及血清中TC、TG水平变化 造模完成后分别称取对照组和模型组的小鼠体重、肝重,计算小鼠肝体比。模型组肝体比明显高于对照组,提示肝脏有病变,差异有统计学意义(P<0.01)。造模完成后,收集肝组织及血清。检测肝匀浆(肝组织匀浆后收集的上清液)及血清中TC、TG水平。模型组肝匀浆血清中TC、TG水平明显高于对照组,差异有统计学意义(t=4.144,P<0.01),见表1。
表1 小鼠肝脏体重比、肝匀浆、血清中TC/TG水平(±s,n=40)
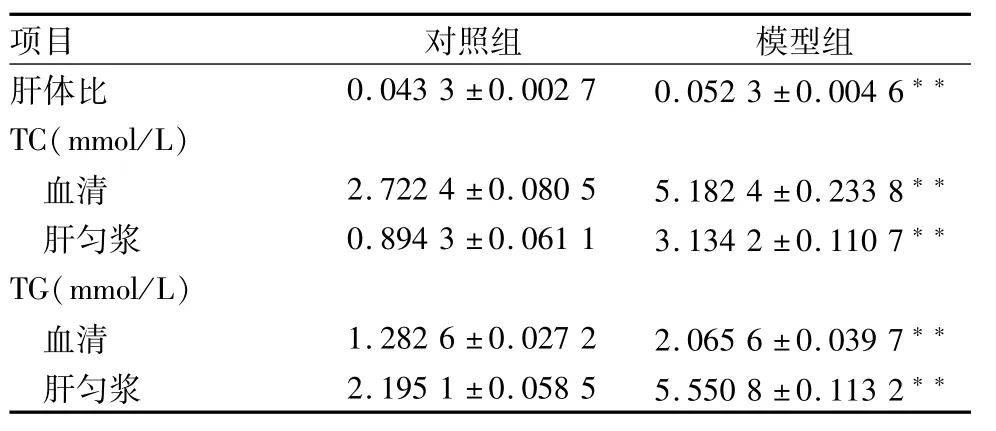
表1 小鼠肝脏体重比、肝匀浆、血清中TC/TG水平(±s,n=40)
与对照组比较:**P<0.01
2.2 小鼠血清ALT、AST变化检测血清中酶的活性的改变可以反映肝脏的功能情况,当肝细胞受损时,肝细胞内的ALT、AST释放入血,血清ALT、AST活性会升高。因此,这两种酶的活性升高成为肝功能受损的特异性指标。结果显示,模型组较对照组血清ALT、AST水平明显升高,差异有统计学意义(t=6.055,P<0.01),见图1。
2.3 肝脏油红染色及HE染色取小鼠肝组织,用OCT冰冻包埋剂包埋,-80℃保存。切片后油红染色,苏木精复染;蓝色部分为细胞核,红色部分为脂肪。对照组油红染切片中基本不见红色脂肪组织部分,而模型组中可见大量红色脂肪组织,提示肝脏脂肪病变明显,造模成功。HE染色结果显示,正常组肝小叶结构完整,肝细胞排列整齐;模型组肝脏可见明显脂肪空泡,肝脏结构紊乱。见图2。
2.4 流式细胞术检测CD11b+、CD68+两群细胞比例用小鼠巨噬细胞表面标记分子F4/80及白细胞共同抗原标记分子CD45双标提取的原代KCs,方框中为F4/80+和CD45+。流式细胞术结果显示,模型组中KCs比例明显减少。选取对照组和模型组中F4/80、CD45双阳性的细胞分析。对照组CD11b+CD68+的细胞占全部巨噬细胞的90.1%,模型组双阳性的细胞占53.7%,同时存在CD11b+CD68-细胞,比例约45.2%。见图3。
2.5 肝组织及原代KCs细胞因子mRNA表达水平收集肝组织及原代提取KCs,提取各自mRNA,采用qRT-PCR检测对照组和模型组中各细胞因子mRNA表达水平。肝组织中TNF-α、IL-6、MCP-1 mRNA的表达水平均有明显升高,其中MCP-1的升高显著(P<0.01)。在原代提取的KCs中,TNF-α、IL-6、MCP-1 mRNA的表达水平也都有升高,且MCP-1 mRNA的水平也升高(P<0.01)。而IL-10、TGF-β的mRNA表达水平则有少量降低或者无明显变化。见图4。
3 讨论
采用Lieber-DeCarli液体饲料造模,因其在造模过程中由小鼠自行取食,建立小鼠AFL模型较传统连续灌胃6周的AFL模型[8]更加方便、易行,造成的AFL模型比较明显,并且这种模型与长期饮酒造成的肝脏疾病患者很相似。实验中反映肝损伤的指标肝体比、TG/TC、ALT/AST的水平,在造模16 d时,模型组明显高于对照组。同时,油红及HE染色中模型组可见明显脂肪沉积和空泡,组织疏松。通过在经典的KCs提取的方法[9-10]上进行了改进:一方面在操作过程中,减少了酶的用量,节约了试剂;并且在实际操作中发现,可将方法中分离后再消化的步骤省略,仅需在体灌注即可获得很好的消化结果。另一方面,将3层的密度梯度离心中将细胞悬液铺于25%的Percoll后再铺于50%的Percoll上,改进为将细胞直接与25%的Percoll混匀后铺于50%的Percoll上,将3层梯度离心改为3层,离心过后可见明显的3层分层,吸取中间层,可明显提高细胞得率。
KCs发育来源于骨髓,在炎症和防御的过程中起重要作用,在组织中可根据对环境的应答获得不同的功能表型。文献[5]报道,在正常与病理状态下,KCs中CD68+及CD11b+这两群的比例功能并不完全相同。流式细胞术结果显示,通过原位灌流提取KCs,AFL模型中F4/80+与CD45+细胞,以及各自CD68+、CD11b+两群细胞比例较对照组发生了很大变化,与文献[6]报道一致。两组共表达F4/80+和CD45+细胞提示,在正常情况下,CD68+的肝脏巨噬细胞占到了绝大多数,达90.1%;而在AFL模型中,CD68+的细胞减少至53.7%,CD68-细胞则明显上升,这群CD68-细胞主要为浸润的单核细胞。
肝组织qRT-PCR结果显示,在模型中促炎的细胞因子,例如TNF-α、IL-6、MCP-1 mRNA表达水平明显升高,提示酒精刺激可引起机体的炎症反应。同时,原代提取KCs的qRT-PCR结果表明在AFL模型中,KCs分泌促炎因子,例如TNF-α、IL-6、MCP-1mRNA的水平明显升高;而相对抑炎的细胞因子如IL-10、TGF-β的mRNA表达水平就有少量降低或无明显变化。肝组织、原代KCs中MCP-1 mRNA的水平均有显著升高,作为诱导单核细胞浸润的细胞因子,其升高可能与模型中CD11b+及CD68+细胞增加有关。本研究显示,AFL模型中CD68+这群细胞可能在进行吞噬和修复功能后自身发生了凋亡,也有可能是在疾病的发展过程中MCP-1等促炎因子分泌增加介导外周单核浸润,但还未来得及转化为巨噬细胞,因而仅表现为CD11b+、CD68-。
综上所述,CD68及CD11b两群的比例改变以及各自不同的功能在AFL的疾病过程中起到了非常重要的作用。然而AFL的发病具体机制,尚待进一步研究。
[1] Gao B,Bataller R.Alcoholic liver disease:pathogenesis and new therapeutic targets[J].Gastroenterology,2011,141(5):1572-85.
[2] 朱仁敏,张 程,陈 熙,等.Kupffer细胞在果糖引起的非酒精性脂肪肝中的作用[J].安徽医科大学学报,2012,47(3):257-60.
[3] Lachenmeier D W,Monakhova Y B,Rehm J.Influence of unrecorded alcohol consumption on liver cirrhosis mortality[J].World J Gastroenterol,2014,20(23):7217-22.
[4] 黄 艳,黄 成,李 俊.肝纤维化病程中Kupffer细胞分泌的细胞因子对肝星状细胞活化增殖、凋亡的调控[J].中国药理学通报,2010,26(1):9-13.
[5] Davies L C,Rosas M,Jenkins S J,et al.Distinct bone marrowderived and tissue-resident macrophage lineages proliferate at key stages during inflammation[J].Nat Commun,2013,4:1886.
[6] Ikarashi M,Nakashima H,Kinoshita M,et al.Distinct development and functions of resident and recruited liver Kupffer cells/macrophages[J].J Leukoc Biol,2013,94(6):1325-36.
[7] Zimmermann H W,Trautwein C,Tacke F.Functional role of monocytes and macrophages for the inflammatory response in acute liver injury[J].Front Physiol,2012,3:56.
[8] Ramachandran P,Pellicoro A,Vernon M A,et al.Differential Ly-6C expression identifies the recruited macrophage phenotype,which orchestrates the regression of murine liver fibrosis[J].Proc Natl Acad Sci U S A,2012,109(46):E3186-95.
[9] 张劲松,吴 铁,邹丽宜.小鼠酒精性脂肪肝模型的建立[J].中外健康文摘,2011,8(30):96-8.
[10]朱荣涛,魏思东,李培志,等.小鼠Kupffer细胞分离及细胞培养[J].医学分子生物学杂志,2011,8(6):484-8.
The study of kupffer cells phenotypic changes in alcoholic fatty liver
Cheng Xi1,2,3,Hu Chaojie1,2,3,Li Wanxia1,2,3,et al
(1School of Pharmacology,2Institute for Liver Diseases of Anhui Medical University,Hefei 230032;3Anhui Innovative Drug Research Institute of Industry Common,Hefei 230032)
ObjectiveEstablish the model of alcoholic fatty liver in mice and isolate the biological activity kupffer cells(KCs),in order to study its role in the alcoholic fatty liver disease.MethodsC57BL/6 mice were fed with the Lieber-DeCarli diet for 16 days plus one time of acute alcohol lavage,to establish the model of alcoholic fatty liver.Tissue specimens were collected on the sixteenth day after gastric lavage 9 h later.To verify whether the model was established successfully by detecting the level of serum alanine aminotransferase/glutamic oxalacetic transaminase(ALT/AST)and total cholesterol/triglycerides(TG/TC),the level of TG/TC of liver tissue homogenate and liver pathological section HE and oil red staining.KCs were isolated by in situ perfusion,and the cell yield and cell changes were detected by flow cytometry.Cytokine levels of organization and the primary cell were detected by qRT-PCR.ResultsThe model response to liver injury index of ALT/AST was higher than that of control group,meanwhile HE and oil red stainingResultswere consistent with that.So the alcoholic fatty liver model was successfully established in mice.Cell yield of each mouse was about 1.5×106~2.0×106,KCs were doublelabeled by murine macrophage cell surface marker F4/80 molecule and white blood cells surface antigen molecules CD45,F4/80 and CD45 double positive cells were selected to flow analysis.Data showed that natural CD68+was significantly lower in the model,a large number of the infiltration of mononuclear cells were elevated.Florescent real-time quantitative RT-PCR(qRT-PCR)Resultsshowed that cytokine,tumor necrosis factor(TNF-α),interleukin-6(IL-6),monocyte chemoattractant protein(MCP-1)level increased significantly in liver tissue and primary cell.ConclusionThe model of alcoholic fatty liver is successfully established and there is a high yield of cells in situ perfusion.The incidence of alcoholic fatty liver may be relative to hepatic macrophages constitute and phenotypic changes,associated with elevated cytokine mediated infiltration of peripheral mononuclear cells.
alcoholic fatty liver;in situ perfusion;kupffer cells;cytokines
R 967;R 965.2
1000-1492(2015)02-0149-05
2014-10-15接收
国家自然科学基金(编号:81273526);安徽省教育厅基金项目(编号:KJ2012A156);安徽省自然科学基金(编号:1308085MH145);安徽医科大学博士科研启动基金(编号:XJ201118)
安徽医科大学1药学院、2肝病研究所,合肥 2300323安徽省创新药物产业共性研究院,合肥 230032
程 希,女,硕士研究生;李 俊,男,教授,博士生导师,责任作者,E-mail:lj@ahmu.edu.cn
