瘦素(Leptin)受体基因敲除小鼠繁育及子代小鼠基因型鉴定
2015-01-06季爱兵严亮彭文书刘聪龚婉莹王桥美
季爱兵,严亮,彭文书,刘聪,龚婉莹,王桥美
(普洱茶研究院,云南普洱 665000)
瘦素(Leptin)受体基因敲除小鼠繁育及子代小鼠基因型鉴定
季爱兵,严亮,彭文书,刘聪,龚婉莹,王桥美
(普洱茶研究院,云南普洱 665000)
将瘦素(Leptin,LP)受体基因杂合型小鼠按4种方式进行配对,从子鼠鼠尾中提取基因组DNA,用PCR方法扩增LP受体基因片段,琼脂糖凝胶电泳后观察。结果表明,LP+/+、LP+/-、LP-/-各表型小鼠互交繁殖结果基本符合孟德尔遗传规律,且雌、雄性LP-/-小鼠(即DB/DB小鼠)无繁殖能力。雌、雄性LP+/-小鼠交配能高效地繁殖LP-/-小鼠;PCR方法能够精确地鉴定LP-/-小鼠。
瘦素(Leptin,LP);DB/DB小鼠;基因型
瘦素(Leptin,LP)是一种由脂肪组织分泌的肽类激素,人们之前普遍认为它进入血液循环后会参与糖、脂肪及能量代谢的调节,促使机体减少摄食,增加能量释放,抑制脂肪细胞的合成,进而使体重减轻[1~2]。LP受体基因可以通过旁分泌与自分泌方式作用于脂肪、胰腺等多种组织,还可通过各种内分泌机制作用下丘脑特异性受体;不但可以调节机体的性生殖功能,而且是摄食反馈通路中的传入饱食信号,可直接作用于脑的摄食和饱食中枢,抑制食物摄取,减少能量摄入,增加能量消耗,调控体内的脂肪组织消长[3],以保证机体不发生过度肥胖或消瘦[4~5]。同时还可直接或间接调节体内的胰岛素水平与活性,从而在机体摄食、能量代谢、神经内分泌调控及性生殖等方面均有着非常重要的作用[6~8]。LP受体基因敲除小鼠会表现为饮食无节制,长期暴饮暴食后导致肥胖并引发糖尿病,这种模型与Ⅱ型糖尿病症状吻合,且该小鼠终身高血糖,所以DB/DB(LP-/-)小鼠是用来研究糖尿病和肥胖症等疾病的理想动物模型。我们从美国杰克逊实验室(Jackson Laboratory)引入LP受体基因杂合型小鼠,在SPF级(无特定病原体动物)动物房中饲养、繁殖,鉴定出一批DB/DB纯合子小鼠,为糖尿病和肥胖症的研究提供了理想的动物模型。
1 材料与方法
1.1 试验材料
1.1.1 试验动物LP受体基因敲除杂合子(LP+/-)小鼠从美国Jackson Laboratory购买,雄鼠5只,雌鼠10只,品系为C57BL/KsJ。使该品系小鼠在特异性基因位点发生基因变异,从而得到基因背景为LP受体基因敲除杂合子(LP+/-)。
1.1.2 主要试剂KOD FX酶购自东洋纺生物科技有限公司;DNA marker DL 2000购自大连宝生物工程有限公司;PCR引物由上海捷瑞生物工程有限公司合成;其他试剂NaOH、Tris、HCl均为分析纯。
1.1.3 仪器与设备PCR仪(英国基因公司),凝胶成像仪(英国基因公司),电流仪(北京六一仪器厂),离心机(美国贝克曼库尔特有限公司),微量移液器[大龙兴创实验仪器(北京)有限公司],独立通气笼(IVC,苏杭科技器材有限公司),超净工作台(苏州净化设备有限公司)。
1.2 小鼠的繁殖方式
1.2.1 配对情况将小鼠按下列4种方式2∶1配对:LP+/-雌性与LP+/-雄性,LP-/-雌性与LP+/-雄性,LP+/-雌性与LP-/-雄性,LP+/+雌性与LP+/-雄性,每组配对4对,均交配2个月。
1.2.2 饲养条件在动物实验室的IVC中饲养,在超净工作台中操作,喂以SPF级饲料,保证试验在SPF级条件下进行。室温恒定为24 ℃,空气湿度保持在45%~65%,白天给予12 h光照。
1.3 子代小鼠基因型的鉴定
1.3.1 小鼠DNA模板的提取剪1~3 mm鼠尾于PCR管中,将其剪碎后加入180 μL 50 mmol/L NaOH溶液,充分振荡,用PCR仪95 ℃孵育10 min,再加入20 μL pH 8.0的Tris-HCl溶液,充分振荡后,12 000 r/min离心5 min。上清即粗DNA模板。
1.3.2 PCR反应①引物。引物共有3对,小鼠通用引物序列为CTRL-R:5′-CAGAAATCGAGGAAGAAATG-3′,CTRL-F:5′-CAGAAATCGAG GAAGAAATG-3′,正常PCR条件下,得到549 bp;LP-基因特异性引物,DB-SCRN-R:5′-CTAATATGGAAGCTTTCACA-3′,DB-SCRN-F:5′-GTTTACTTTTGATGGAGGT-3′,在同样条件下能得到394 bp;LP+基因特异性引物,序列为DB-SCRN-R:5 ′-CTAATATGGAAGCTTTCACA-3 ′,DB-SCRN-F-N:5′- GTTTACTTTTGATGGAGGG -3′,在同样条件下能得到394 bp。②PCR体系。H2O 12 μL,2 mmol/L dNTP 10 μL,2×PCR buffer 25 μL,引物1 μL,DNA模板1 μL,KOD-FX酶1 μL。③PCR反应条件。预变性:94 ℃5 min;变性:94 ℃30 s;退火:60 ℃60 s;延伸:72 ℃50 s,40个循环;最后延伸:72 ℃10 min,4 ℃保存。
1.3.3 1%琼脂糖凝胶电泳0.35 g琼脂糖,1× TBE 35 mL,GoldviewⅠ2 μL,用5 μL产物与1 μL 5×loading buffer混合上样,电泳电压110 V,时间30 min。
2 结果与分析
8对亲本均为杂合体的小鼠交配后,2个月得到45只小鼠。通过PCR基因鉴定,其中有9只DB/DB小鼠(LP-/-基因纯合子),占总数的20%;50只为LP+/-基因杂合小鼠,占总数的56.7%;野生型(WT)C57小鼠有22只,占总数的23.3%。而亲本中有任何一方为LP-/-基因纯合子的小鼠组均表现出不育,这与DB/DB小鼠是不育的报道相一致[1]。8对亲本中有野生型(WT)C57小鼠组中得到了60只小鼠,其中杂合体小鼠为33只,占总数的55%;野生型(WT)C57小鼠为27只,占总数的45%。PCR电泳结果见图1。
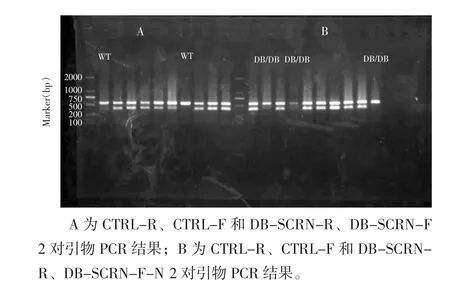
图1 PCR方法进行小鼠基因型鉴定的结果
由CTRL-R、CTRL-F和DB-SCRN-R、DB-SCRN-F 2对引物只扩增到549 bp条带的基因型为野生型(WT)C57小鼠,因其引物未扩增到LP-基因;而由CTRL-R、CTRL-F和DB-SCRN-R、DB-SCRN-F-N 2对引物只扩增到549 bp条带的基因型为LP-/-基因纯合子(DB/DB)小鼠,因其引物未扩增到LP+基因。而当由上述2对引物分别2次扩增都得到549 bp条带和394 bp条带时,该小鼠基因型为LP+/-基因杂合小鼠。
3 讨论
基因敲除技术是借助分子生物学、细胞生物学和动物胚胎学的方法,将小鼠体内的某种基因的功能缺失,用以揭示基因功能最直接的手段之一,因此成为现代生物技术的重要研究方法和内容[9~10]。为了更好地进行LP受体基因的功能和糖尿病药物的研究,我们引进了LP受体基因敲除小鼠。由于使用LP+/-基因杂合小鼠,其子代中常出现LP+/-、LP+/+、LP-/-3种基因型,该研究是将这3种基因型小鼠分开,从结果看,大致还是符合孟德尔遗传定律,亲代中有LP-/-基因纯合小鼠均不能受孕,而用野生型小鼠参与繁殖则得不到LP-/-基因纯合(DB/DB)小鼠。因此只能通过LP+/-基因杂合小鼠进行交配,由于LP+/-和LP+/+在表现型上是一致的,而且小鼠的生长周期较短,如果不及时将子代小鼠的基因型区分开来,将造成资源的极大浪费,而且还不容易得到相应能用于试验的小鼠。我们目前通过合理安排动物生产,能得到相应的DB/DB小鼠,以满足实验室的试验需求。
要想得到用来做试验的大量相近出生日期的DB/DB小鼠,只有通过扩大繁殖来实现。试验结果也表明,LP+/-基因杂合小鼠交配繁殖得到的小鼠数量不多,有时1只雌鼠1次分娩才产下4~6只小鼠,而野生型小鼠交配时,1只雌鼠1次分娩能得到6只以上小鼠,对此还需要深入研究。带有LP-基因对小鼠生育是否有影响尚不清楚,还需要进一步的研究。总之,掌握对小鼠基因型的鉴定能合理地利用有限的资源,来繁殖我们所需要的试验小鼠。
[1]ISRAEL D,CHUA S JR.Leptin receptor modulation of adiposity and fertility[J].Trends Endocrinol Metab,2010,21(1):10.
[2]DENVER RJ,BONETT RM,BOORSE GC.Evolution of leptin structure and function[J].Neuroendocrinology,2011,94(1):21-38.
[3]SILVA BA,BJOTHAEK C,UOTANI S,et al.Functional properties of leptin receptor isoforms containing the Gln→Pro extracellular domain mutation of the fatty rat[J].Endocrinology,1998,139(9):3681-3690.
[4]GHILARDI N,ZIEGLER S,WIESTUER A,et al.Defective STAT signaling by the leptin receptor in diabetic mice[J].Proc Natl Acad Sci USA,1996,93(13):6231-6235.
[5]YMASHITA T,MURUKAMI T,OTANI S,et al.Leptin receptor signal transduction:OBRa and OBRb of fa type[J].Biochem Biophys Res Cornrnun,1998,246(3):752-759.
[6]MCCOWEN KC,CHOW JC,SMITH RJ.Leptin signaling in the hypothalamus of normal rats in vivo[J].Endocrinology,1998,139(11):4 442-4 447.
[7]CARPENTER LR,FARRUGGELLA TJ,SYMES A,et al.Enhancing leptin response by preventing SH2-containing phosphatase 2 interaction with Ob receptor[J]. Proe Natl Aead Sci USA,1998,95(11):6061-6066.
[8]CHUNG CD,LIAO J,LIU B,et al.Specific inhibition of STAT-3 signal transduction by PIAS[J].Science,1997,278:1 803-1 805.
[9]GUAN C,YE C,YANG X,et al.A review of current large-scale mouse knockout efforts[J].Genesis,2010,48:73-85.
[10]王强,钱文溢,刘景丽,等.ERα基因敲除小鼠的繁育及子代小鼠基因型的鉴定[J].中国实验动物学报,2011,19(2):100-102.
(本文责编:郑丹丹)
Breeding of Leptin Receptor Gene Knockout Mice and Genotype Identification of Their Filial Generation
JI Ai-bing,YAN Liang,PENG Wen-shu,LIU Cong,GONG Wan-ying,WANG Qiao-mei
(Puer Institute of Pu-erh Tea,Pu'er Yunnan 665000,China)
The leptin receptor gene heterozygous mice were matedin four ways.Genomic DNA was isolated from tails and analyzed by PCR.The result showed that the ratio of the offspring genotypes fit the Mendel’s laws.The male and female LP-/-mice were infertile.It was efficient to breed leptin receptor gene knockout homozygote mice by inbreeding of the heterozygotes.PCR methods could be used to identify the genotype of the LP-/-mice precisely.
Leptin;DB/DB mouse;Genotype
Q953,R392
A
1001-1463(2015)01-0009-03
10.3969/j.issn.1001-1463.2015.01.004
2014-12-09
季爱兵(1980—),男,安徽无为人,助理研究员,硕士,主要从事普洱茶功效研究工作。联系电话:(0879)2886111。E-mail:42883876@qq.com。
