Ⅳ和Ⅳ+Ⅴ型狼疮性肾炎患者血清microRNA标志物的芯片初筛*
2015-01-06张志恒肖红波熊祖应
张志恒,肖红波,王 琪,王 艳,熊祖应△
(安徽医科大学北京大学深圳医院:1.临床学院;2.肾内科,广东深圳 518036)
·论 著·
Ⅳ和Ⅳ+Ⅴ型狼疮性肾炎患者血清microRNA标志物的芯片初筛*
张志恒1,2,肖红波2,王 琪2,王 艳2,熊祖应1,2△
(安徽医科大学北京大学深圳医院:1.临床学院;2.肾内科,广东深圳 518036)
目的应用微小核糖核酸(microRNA)芯片技术初步筛选Ⅳ、Ⅳ+Ⅴ型狼疮性肾炎患者血清microRNA,探讨血清microRNA在狼疮性肾炎病理分型中的作用。方法从北京大学深圳医院肾内科生物标本库中选取Ⅳ、Ⅳ+Ⅴ型狼疮性肾炎血清各4例,作为试验组;同时选取4例健康人血清作为对照组,使用microRNA芯片技术筛选差异表达的血清microRNA。结果Ⅳ型和Ⅳ+Ⅴ型共有部分microRNA,其中22个有显著差异,Ⅳ型特异性microRNA有29个,Ⅳ+Ⅴ型特异性microRNA有3个。结论血清microRNA具有作为鉴别Ⅳ、Ⅳ+Ⅴ型狼疮性肾炎生物标志物的潜能。
狼疮肾炎;肾脏病理分型;微RNAs;microRNA芯片
狼疮性肾炎(lupus nephritis,LN)是临床上继发性肾病的常见病因。肾活检可以明确LN肾脏病理分型,从而指导治疗和判断预后,但肾活检是一项有创性操作,具有一定风险,不易重复检测。为此,探寻可部分替代重复肾活检,对鉴别LN病理类型有一定临床价值的生物标志物显得极为重要。
微小核糖核酸(microRNA,简称miRNA)是一类非编码、由19~23个核苷酸组成的小分子单链RNA,它们通过与靶目标mRNA的3′-UTR及5′-UTR区碱基互补配对,进而调节mRNA降解或抑制mRNA翻译,参与多种生理和病理过程[1]。近年来研究表明,miRNA可稳定存在于血清、血浆、尿液等体液中[2-3],且与许多病理、生理过程密切相关,具有作为肿瘤、肾病综合征等多种疾病生物标志物的潜能[4-7]。血清miRNA在LN及其肾脏病理分型中是否可作为生物标志物目前还不清楚。本课题采用miRNA芯片技术检测并比较Ⅳ型、Ⅳ+Ⅴ型LN及健康对照组miRNA差异性表达,初步探讨血清miRNA在LN肾脏病理分型中作用。
1 材料与方法
1.1 一般资料 选取2013年1月至2014年1月在本医院肾内科经肾活检确诊为Ⅳ型和Ⅳ+Ⅴ型LN患者各4例,且近3个月内未经过免疫抑制剂及激素冲击治疗,前者标记为A1、A2、A3和A4,后者标记为B1、B2、B3和B4,共8例作为试验组。研究对象纳入标准:年龄大于或等于18周岁,排除LN外的慢性疾病,包括原发性高血压、糖尿病、其他结缔组织病等,肾脏病理符合2003年国际肾脏病学会/肾脏病理学会(ISN/RPS)LN分类标准[8]。同时选取年龄、性别等匹配的健康人作为对照组,分别标记为C1、C2、C3和C4。本研究经医院伦理委员会审核同意,所有患者均签订知情同意书。
1.2 血清采集 试验组用无肝素真空管采集患者血液,室温下2 500 r/min离心15 min后收集血清。将血清储存在-80 ℃冰箱至试验时取用。对照组血清采集方法相同。
1.3 miRNA芯片扫描和数据分析 样品采用miRNA标记试剂盒miRCURYTM Array Power Labeling Kit标记样本RNA,与第7代Exiqon miRCURY LNATM(V18.0版本)杂交并洗涤。该芯片包括3 100个捕获探针覆盖miRBase数据库18.0版本人、小鼠和大鼠3个物种全部miRNA,同时覆盖与上述物种相关的所有病毒miRNA。芯片杂交实验及后续结果分析在上海康成生物技术公司完成。对Ⅳ型、Ⅳ+Ⅴ型LN与对照组血清差异表达miRNA进行筛选,经中位数法标准化后,计算各miRNA差异倍数,筛选上调和下调miRNA。
1.4 统计学处理 选取芯片读数原始值大于或等于100,同时差异倍数大于或等于3或小于或等于1/3为显著差异,其中前者为上调,后者为下调,采用t检验,以P<0.01为差异有统计学意义。用MEV4.9版本软件对差异表达miRNA进行聚类分析。
2 结 果
2.1 一般资料 本研究中12个样本临床资料结果见表1。
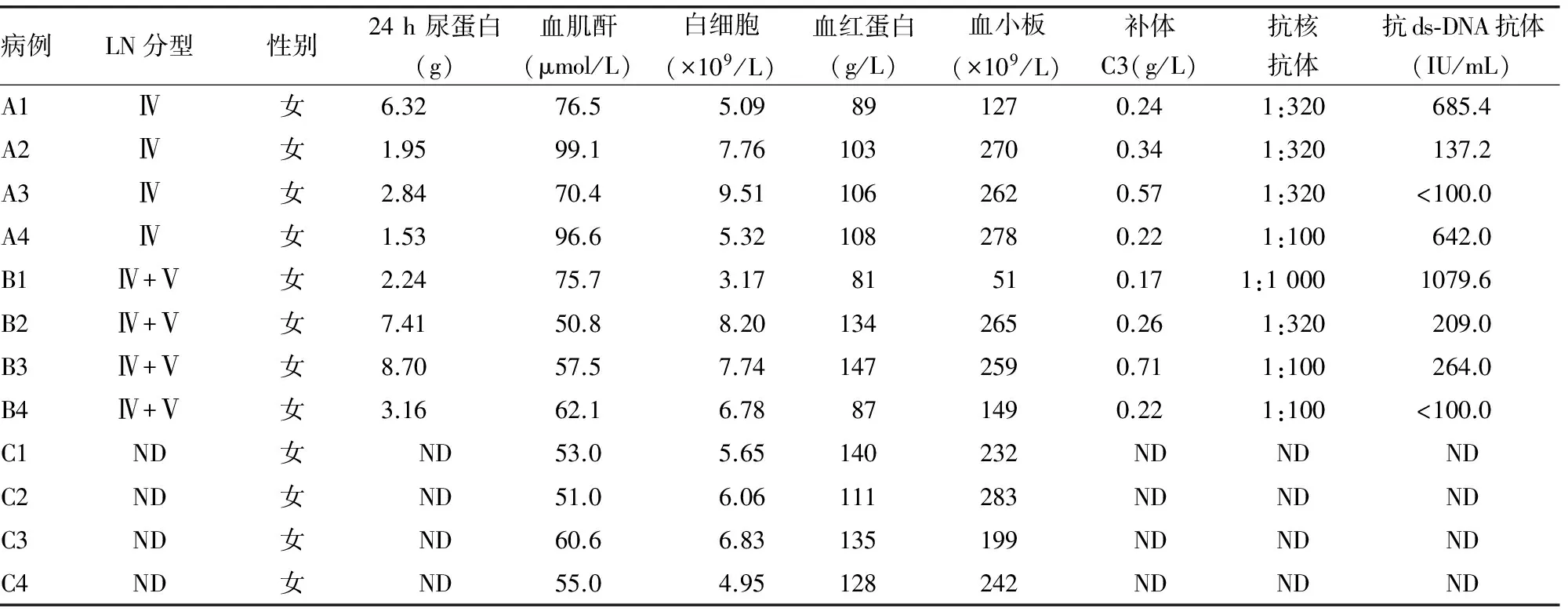
表1 所有入选对象临床资料
2.2 肾脏病理结果 经肾活检证实为Ⅳ型和Ⅳ+Ⅴ型LN患者,两组患者的肾脏病理见图1。
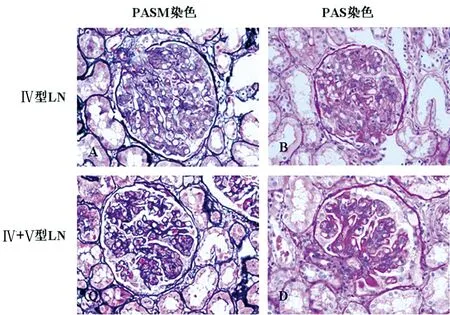
A、B分别代表Ⅳ型LN的PASM染色和PAS染色,C、D分别代表Ⅳ+Ⅴ型LN的PASM染色和PAS染色。PASM染色提示Ⅳ+Ⅴ型LN基底膜病变较Ⅳ型LN明显。PAS染色提示两种类型LN肾组织都有增生性病变。
图1 患者肾活检组织六胺银染色(PASM染色)和过碘酸雪夫染色(PAS染色)病理图片
2.3 miRNA芯片检测结果如下 Ⅳ型、Ⅳ+Ⅴ型两组有部分相同miRNA表达,且表达差异符合筛选要求者22个,其中上调17个,下调5个,见表2、3;两组不同病理类型Ⅳ型和Ⅳ+Ⅴ型间特异性miRNA筛选比较发现,Ⅳ型有29个,其中上调22个,下调7个,见表4、5;Ⅳ+Ⅴ型有3个,均为下调,见表6。
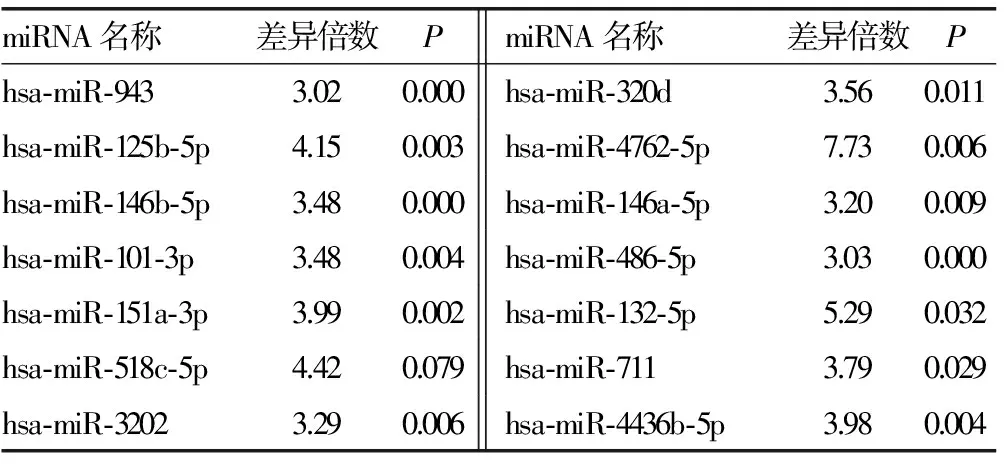
表2 Ⅳ型和Ⅴ+Ⅳ型LN共有部分miRNA及其表达上调情况
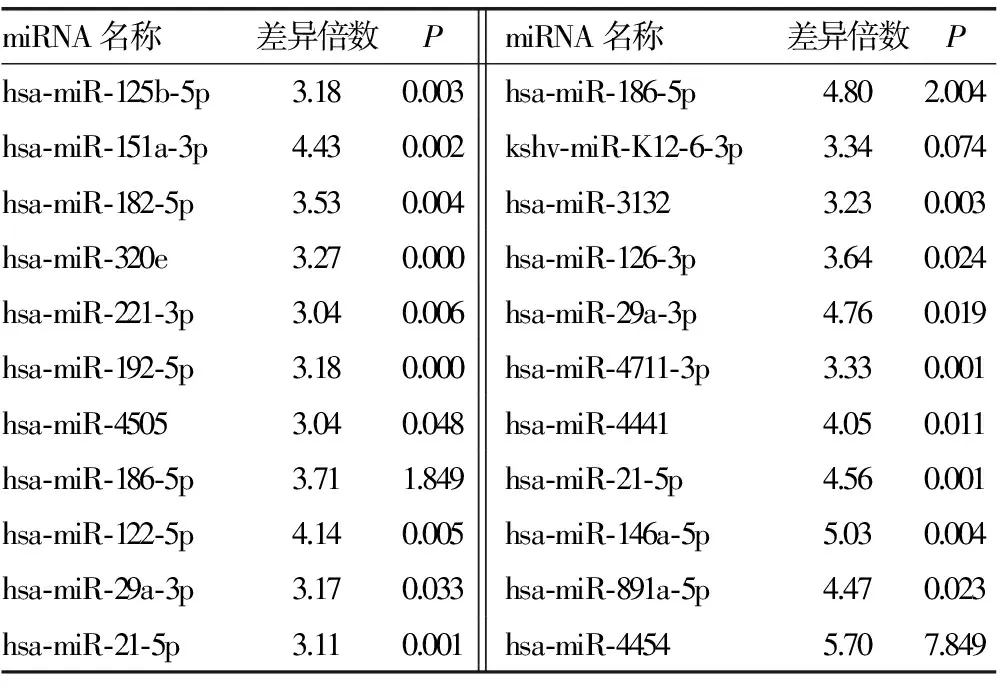
续表2 Ⅳ型和Ⅴ+Ⅳ型LN共有部分miRNA及其表达上调情况
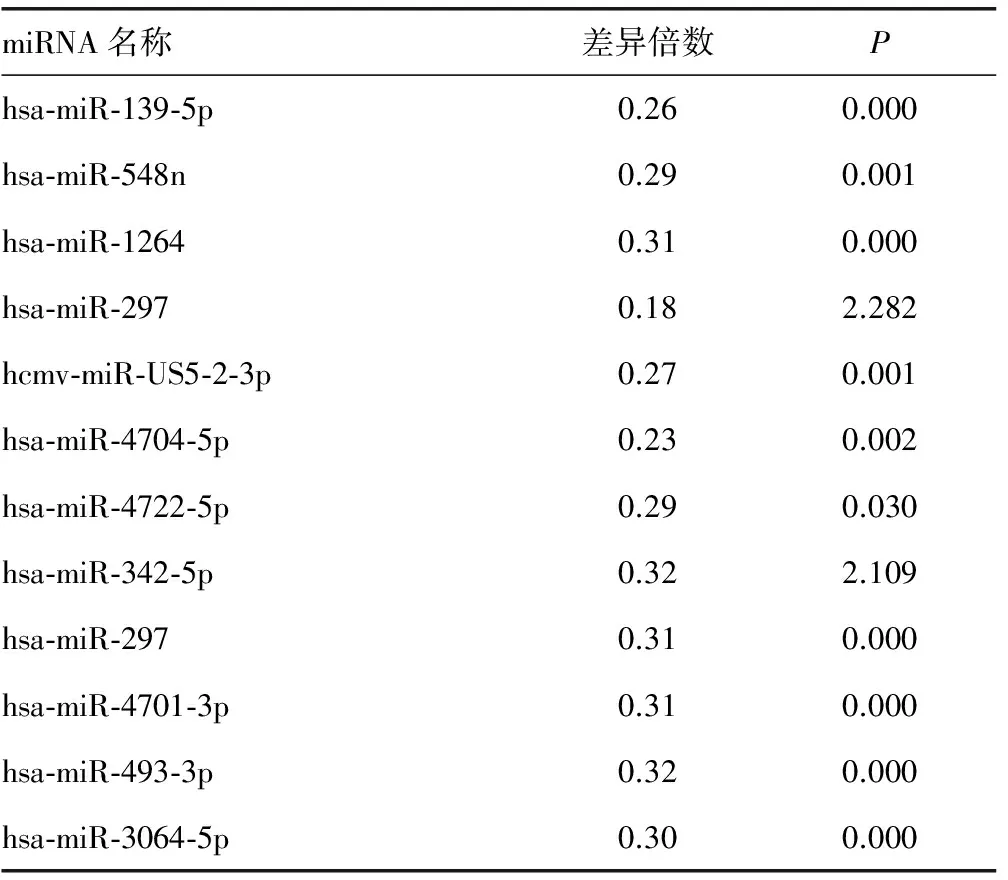
表3 Ⅳ型和Ⅴ+Ⅳ型LN共有部分miRNA及其表达下调情况
2.4 聚类分析 将血清miRNA在Ⅳ型和Ⅳ+Ⅴ型LN患者表达的聚类图进行双层聚类分析,可直观观察到同一血清miRNA在不同样本中表达情况。见图2。
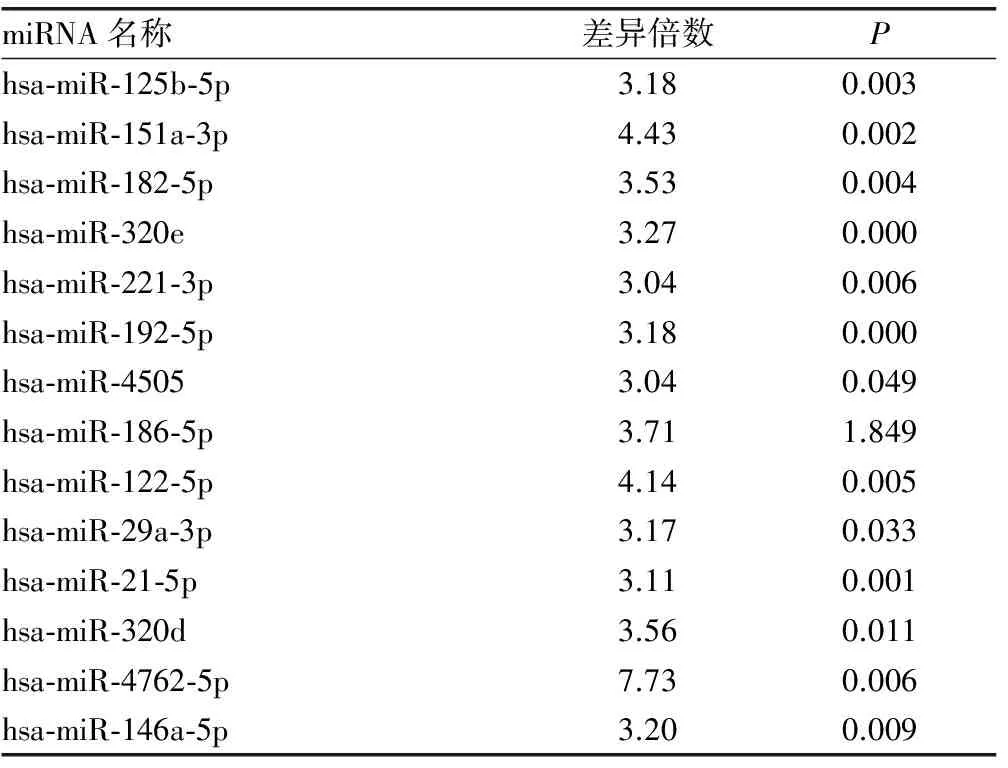
表4 Ⅳ型LN患者特异性miRNA及其表达上调情况
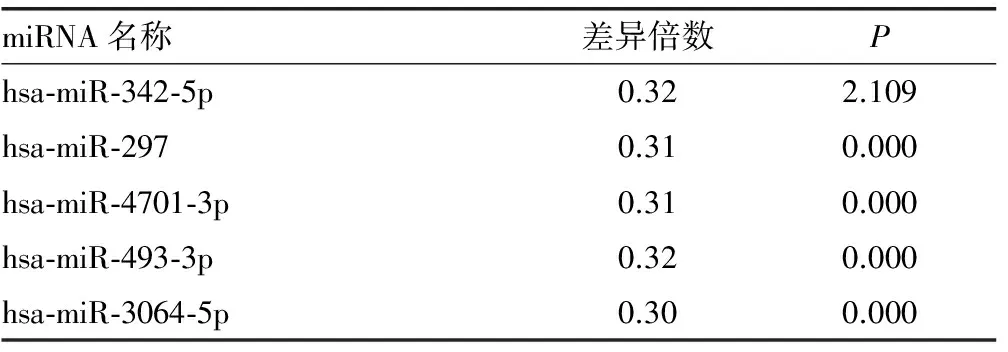
表5 Ⅳ型LN患者特异性miRNA及其表达下调情况

表6 Ⅳ+Ⅴ型LN患者特异性miRNA及其表达下调情况

A1、A2、A3、A4代表Ⅳ型LN患者,B1、B2、B3、B4代表Ⅳ+Ⅴ型LN患者;“has”表示人类种族;其中每一列代表一个样本,每一行代表一种miRNA,根据不同miRNA在不同样本的表达量进行聚类分析,红色代表高表达,绿色代表相对较低的表达。
图2 血清miRNA在Ⅳ型和Ⅳ+Ⅴ型LN患者表达的聚类图
3 讨 论
miRNA是一类非编码、内源性小单链RNA分子。1993年Lee等[9]首次在线虫体内发现第一个miRNA(lin-4),随后,科学家们应用随机克隆、测序和生物信息学预测等多种手段,发现miRNA在细胞分裂、凋亡、伤口愈合和免疫应答等多种生理和病理过程中发挥重要作用[10-13]。同时因其在体液中具有高稳定性和疾病特异性,相比传统蛋白质类生物标志物,其低复杂性、无后加工修饰、可合成高亲和“捕获”试剂、能进行“信号”扩增特性,使其成为生物标志物研究热点[14]。
体液miRNA作为生物标志物研究,在肾脏病、系统性红斑狼疮和LN方面均有报道。研究发现血清miR-106a、miR-17、miR-20a、miR-203、miR-92a等具有作为诊断系统性红斑狼疮的潜能,miR-342-3p、miR-223、miR-20a在活动性LN患者中表达下调,与LN相关[15];尿miR-155与LN患者蛋白尿程度和狼疮活动指数相关,miR-146a与狼疮患者肾小球滤过率相关[16];血浆miR-126 在系统性红斑狼疮患者中表达上调,在类风湿关节炎患者中无此现象,提示其可作为狼疮患者诊断标志物。这些研究发现部分miRNA具有成为系统性红斑狼疮和LN生物标志物的潜力,但未见miRNA与LN病理类型关系研究报道。
miRNA芯片是大规模筛选组织、体液miRNA的有效检测手段,具有高特异度、高灵敏度、样本用量少等特点,目前已被广泛采用。本研究采用第7代Exiqon miRCUY LNATM(V18.0版本)miRNA表达谱芯片,相比普通miRNA芯片,其特异度、灵敏度更高,可更广泛筛选血清中miRNA,减少miRNA漏筛发生率。
本研究所选患者的临床与病理资料结果显示(表1和图1),试验组A组为Ⅳ型LN,B组为Ⅳ+Ⅴ型LN,均为本院肾内科确诊LN患者;对照组中4例入选者为健康志愿者。本研究发现,Ⅳ型、Ⅳ+Ⅴ型LN患者血清中有部分相同miRNA,其中22个有显著差异,并且最高差异率达7倍以上;Ⅳ型特有miRNA 29个,Ⅳ+Ⅴ型miRNA特有3个(特有指Ⅳ型与Ⅳ+Ⅴ型之间比较)。推测以上54个miRNA可能有鉴别Ⅳ型及Ⅳ+Ⅴ型LN的潜能,并且差异miRNA数量较多,差异性非常显著,说明LN患者血清miRNA可能是很好的生物标志物。上述数据中,两组之间差异最为明显者如hsa-miR-4762-5p、hsa-miR-297,利用miRNA靶基因在线预测软件MIRDB对上述靶基因进行预测,发现包括FAT1、JAG1、SSBP2等在内的基因均可影响肾脏功能,但目前未见其与LN相关的研究。实验结果中还有其他部分miRNA,文献报道也较少,这些miRNA的作用尚不清楚,值得探讨。另外这54个miRNA相对于对照组均有显著差异性,这些miRNA是否参与系统性红斑狼疮或LN发病过程,也需要进一步研究。
本研究中采用的芯片技术筛查只是初步研究,且可能会有假阳性或假阴性结果。另有药物、狼疮并发症等可能也对实验结果造成影响,因此需要采用实时荧光定量PCR技术或其他方法进行较大样本验证,从而判断上述miRNA是否有助于鉴别Ⅳ和Ⅳ+Ⅴ型LN患者病理分型,或采用更大样本量判断多种类型LN,将是未来研究的方向之一。
[1]Moss EG,Poethig RS.MicroRNAs:something new under the sun[J].Curr Biol,2002,12(20):R688-R690.
[2]De Guire V,Robitaille R,Tétreault N,et al.Circulating miRNAs as sensitive and specific biomarkers for the diagnosis and monitoring of human diseases:promises and challenges[J].Clin Biochem,2013,46(10/11):846-860.
[3]Mitchell PS,Parkin RK,Kroh EM,et al.Circulating microRNAs as stable blood-based markers for cancer detection[J].Proc Natl Acad Sci U S A,2008,105(30):10513-10518.
[4]Weber JA,Baxter DH,Zhang SL,et al.The MicroRNA spectrum in 12 body fluids[J].Clin Chem,2010,56(11):1733-1741.
[5]Wang G,Kwan BC,Lai FM,et al.Urinary sediment miRNA levels in adult nephrotic syndrome[J].Clin Chim Acta,2013,418:5-11.
[6]Erener S,Mojibian M,Fox JK,et al.Circulating miR-375 as a biomarker of β-cell death and diabetes in mice[J].Endocrinology,2013,154(2):603-608.
[7]Lv LL,Cao YH,Ni HF,et al.MicroRNA-29c in urinary exosome/microvesicle as a biomarker of renal fibrosis[J].Am J Physiol Renal Physiol,2013,305(8):F1220-F1227.
[8]Weening JJ,D′agati VD,Schwartz MM,et al.The classification of glomerulonephritis in systemic lupus erythematosus revisited[J].Kidney Int,2004,65(2):521-530.
[9]Lee RC,Feinbaum RL,Ambros V.The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843-854.
[10]Pauley KM,Cha S,Chan EK.MicroRNA in autoimmunity and autoimmune diseases[J].J Autoimmun,2009,32(3/4):189-194.
[11]Lu LF,Liston A.MicroRNA in the immune system,microRNA as an immune system[J].Immunology,2009,127(3):291-298.
[12]Liang TJ,Qin CY.The emerging role of microRNAs in immune cell development and differentiation[J].APMIS,2009,117(9):635-643.
[13]Xiao X,Huang C,Zhao C,et al.Regulation of myofibroblast differentiation by miR-424 during epithelial-to-mesenchymal transition[J].Arch Biochem Biophys,2015,566:49-57.
[14]孙士鹏,李金明.循环microRNA的研究现状与展望[J].分子诊断与治疗杂志,2010,2(6):361-366.
[15]Carlsen AL,Schetter AJ,Nielsen CT,et al.Circulating microRNA expression profiles associated with systemic lupus erythematosus[J].Arthritis Rheum,2013,65(5):1324-1334.
[16]Wang G,Tam LS,Kwan BC,et al.Expression of miR-146a and miR-155 in the urinary sediment of systemic lupus erythematosus[J].Clin Rheumatol,2012,31(3):435-440.
The screen of serum microRNA in Ⅳand Ⅳ+Ⅴ lupus nephritis patients*
ZhangZhiheng1,2,XiaoHongbo2,WangQi2,WangYan2,XiongZuying1,2△
(1.ClinicalCollege;2.DepartmentofNephrology,PekingUniversityShenzhenHospitalofAnhuiMedicalUniversity,Shenzhen,Guangdong518036,China)
ObjectiveTo preliminary screen serum microRNA which was related to class Ⅳ and class Ⅳ+Ⅴ lupus nephritis(LN) by using microRNA array technology,and explore the role of serum microRNA in renal pathological classification of lupus nephritis.MethodsEight serum samples of lupus nephritis patients from biological specimen library in our hospital were enrolled.Experimental group was composed of 4 class Ⅳ cases and 4 class Ⅳ+Ⅴ cases,control group was composed of 4 healthy persons.MicroRNA array was used to screen the differentially expressing microRNA.ResultsThere were part of same miRNA in class Ⅳ and classⅣ+Ⅴ LN,among which expression of 22 miRNA were significantly different,29 miRNA of classⅣ was unique,3 miRNA of class Ⅳ+Ⅴ was unique.ConclusionSerum miRNA has a potential to serve as a biomarker to identify class Ⅳ and classⅣ+Ⅴ lupus nephritis.
lupus nephritis;renal pathology;microRNAs;microRNA array
10.3969/j.issn.1671-8348.2015.27.001
广东省自然科学基金博士启动项目资助(S2013040015040)。
:张志恒(1989-),在读硕士。主要从事狼疮性肾炎病理工作。△
,E-mail:xiongzy2005@163.com。
R692
A
1671-8348(2015)27-3745-03
2015-03-07
2015-06-03)
