一种罗丹明-氨乙基邻苯二甲酰胺衍生物的设计合成及其对Cr3+离子的荧光-比色检测
2015-01-05杨运旭许太林盛瑞隆李斌莲朱海波
韩 文,杨运旭*,许太林,盛瑞隆,李斌莲,朱海波
(1.北京科技大学 化学与化学工程系,北京100083;2.中国科学院 上海有机化学研究所,上海200032)
Cr3+是人体中重要的微量元素[1],其对生命过程具有重要的调节作用。体内Cr3+的缺乏可导致诸如糖尿病、心血管疾病等病症的产生[2],而Cr3+的浓度过高亦会对细胞生长及生物形态结构产生抑制[3]。此外,在环境保护分析中,环境水体中的Cr3+浓度也是金属离子污染的重要检测指标之一。因此,开发廉价、灵敏、高选择性的Cr3+检测方法具有重要理论意义和实用价值。荧光探针(传感器)因具有较高的灵敏度、可快速响应等特点而被广泛应用于多种阳离子、阴离子及中性物种的检测[4-6]。然而,Cr3+具有的顺磁特性使其检测探针多为“荧光猝灭”型而灵敏度较低;并且迄今为止已发展的专一性识别Cr3+的配体尚为数不多,因此,如何发展“荧光增强”响应型的Cr3+探针或检测试剂成为了目前研究的热点之一。

图1 罗丹明螺内酰胺类光化学探针和Cr3+以及其它金属离子结合的可能模式
近年来,研究者发现多种化学物种可诱导罗丹明酰胺螺环结构开环-闭环[7-9],从而产生显著的比色变化及荧光开关(“OFF-ON”)效应,基于上述效应人们开始发展此类荧光探针应用于细胞内/外Cr3+的检测。在以前的报道中,Li等[10]设计合成了荧光-电化学双重响应型探针(图1a),对水溶液中直至细胞内的Cr3+进行了高效识别,加入Cr3+后,一方面通过配位诱导罗丹明螺酰胺开环,进而产生显著的比色变化及荧光增强效应;另一方面,Cr3+的配位使得邻近二茂铁的氧化-还原电位升高,从而产生荧光-电化学双重响应识别的效果。Sinn和 Niu等[11,12]采用噻吩或呋喃对罗丹明修饰,实现了对Cr3+的有效识别和成像。Liu等[13]在罗丹明分子中引入三乙撑四胺,发现其在水溶液中(pH =7.2)可识别Cr3+,但Fe3+有干扰,随后作者通过将识别基团调变为二乙撑三胺,实现了对Fe3+的选择性、高灵敏(检出限为1μmol/L)的识别(图1b)。Prasenjit等[14]合成了罗丹明-萘二甲酰亚胺肼衍生物,其在水溶液中可同时对Cr3+和Hg2+离子产生较明显的识别响应(图1c),但专一性不高。除上述罗丹明螺酰胺开-闭环荧光探针外,Sarkar等[15]也发现Cr3+的配位可部分阻断配体中S、N等杂原子对二(2-乙基硫烷基)胺荧光主体产生的PET荧光猝灭效应,然而上述Cr3+荧光识别的定量性不佳 (图2)。
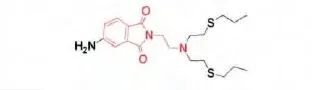
图2 Sarkar等设计合成的邻苯二酰胺类Cr3+荧光探针
因此,通过合理的分子设计将荧光发色团与Cr3+配体相连接,实现专一性荧光检测Cr3+,其中有两个因素在设计中值得关注:(1)螺酰胺邻位原子(基团)的引入,如在Prasenjit的工作[14]中采用双氮原子共轭连接的肼基结构,通过调控金属离子配位点邻近的氮原子的电子云密度,可改变该配体与离子的结合能力。(2)连接单元的柔性和适应性。如将罗丹明螺酰胺环与邻苯二酰胺之间的两个氮原子用距离为两个碳原子的柔性链相连接,可改变荧光主体-配体之间的微环境,从而调控Cr3+的结合性能[13]。
在上述研究的基础上,结合作者此前对罗丹明螺环荧光化学传感器的研究[16],本工作中我们将罗丹明B和氨乙基邻苯二甲酰亚胺通过两个碳的桥链相偶联,设计合成了一种结构简单的探针分子RP1(图3)。在丙酮/水混合溶液中,采用吸收光谱与荧光光谱对该探针与Cr3+及其他常见金属阳离子的相互作用进行了研究,评价了其识别选择性、化学计量比、结合常数和检测灵敏度,发现RP1对Cr3+具有专一性识别性能,其识别后吸收与荧光光谱变化非常明显,且溶液颜色变化(无色到粉红色)也可方便地用肉眼直接观察到,由此实现了对Cr3+离子的选择性比色-荧光识别。

图3 用于Cr3+识别的罗丹明螺内酰胺衍生物RP1的合成路线
1 实验部分
1.1 试剂与仪器
1HNMR 采 用 400MHz的 Varian Gemini-400进行测量。质谱和IR分别采用TRIO 2000质谱仪和Shimadzu IR-8400S红外光谱仪进行测量。紫外-可见吸收光谱采用Pgeneral TU-1901紫外-可见分光光度计测定,荧光光谱采用Hitachi F-4500分光光度计进行测定。金属离子 K+、Li+、Cs+、Ag+、Na+、Cu2+、Ba2+、Be2+、Ca2+、Cd2+、Fe2+、Hg2+、Mg2+、Mn2+、Ni2+、Pb2+、Sr2+、Zn2+、Co2+、Cr3+和 Fe3+的高氯酸盐(AR级)购于北京国药集团化学试剂有限公司。罗丹明B(AR级)购于北京恒普高化工有限公司,氨基乙基邻苯二甲酰胺(CP级)购自北京裕融科技有限公司。实验中使用的其它化学品均为分析纯,未经进一步处理直接使用。
1.2 罗丹明-邻苯二甲酰胺衍生物RP1的合成
在50mL三口烧瓶中,将200mg罗丹明B溶解于12mL 1,2-二氯乙烷中,然后缓慢滴加0.2 mL的POCl3。反应混合物回流4h后,冷却,减压蒸馏除去溶剂,得到罗丹明B酰氯。该粗产品无需进一步纯化,直接用于下一步反应。
将100mg氨基乙基邻苯二甲酰胺溶解在10 mL无水乙腈中,然后加入1mL三乙胺于室温下搅拌1h后,将其缓慢滴入溶解有前述制备的罗丹明B酰氯的乙腈溶液(25mL)中,滴加完毕后回流4h。通过薄层色谱法(TLC)监测反应,待反应完全后减压蒸馏除去溶剂,残余物用硅胶柱快速分离纯化(洗脱溶剂:乙酸乙酯/甲醇,V∶V=6∶1),得到白色固体,即为罗丹明-邻苯二甲酰胺衍生物RP1(0.13g,产率47.6%)。
相关表征结果如下:mp:141.7~142.5℃。IR(KBr)ν:1687cm-1(—CONH—);1774cm-1,1716cm-1(—C O);1220cm-1(—OC—N)。1HNMR (400MHz,CDCl3):1.09~1.13 (t,12H,J=6.8Hz,NCH2CH3),3.23~3.24(q,8H,J=6.8Hz,NCH2CH3),3.40(m,2H,NCH2—CH2N),3.63 (m,2H,NCH2—CH2N),6.11~6.13(d,1H,ArH),6.33(s,1H,ArH),6.43~6.46(d,1H,ArH),7.00~7.02(m,1H,ArH),7,39(m,2H,ArH),7.61~7.62(2H,ArH),7.70~7.71 (2H,ArH),7.84 (1H,ArH).Element analysis calculated for C38H38N4O4:C 74.27,H 6.19,N 9.12。Found C 74.57,H 6.30,N 9.33。MALDI-TOFMS:[M+H]+615。Found 615.65。
1.3 罗丹明-邻苯二甲酰胺衍生物RP1对Cr3+的识别性能测试
用丙酮溶解0.005mmol的 RP1,然后用Tris-HCl/丙酮缓冲溶液(V∶V=1∶1,pH=7.2)将其稀释,配制成浓度为1.0×10-4mol/L的待测储备液。金属离子 K+、Li+、Cs+、Ag+、Na+、Cu2+、Ba2+、Be2+、Ca2+、Cd2+、Fe2+、Hg2+、Mg2+、Mn2+、Ni2+、Pb2+、Sr2+、Zn2+、Co2+、Cr3+和Fe3+的高氯酸盐分别用二次蒸馏水溶解,制得浓度为1.0×10-3mol/L的金属离子待测储备液。荧光测量时激发/发射波长为540nm/560nm。
2 结果与讨论
2.1 RP1与不同金属离子作用后的紫外-可见吸收光谱与荧光发射光谱
首先,在RP1的 Tris-HCl/丙酮缓冲溶液(V∶V=1∶1,1.0×10-4mol/L,pH=7.2)中,分别加入 1.0×10-3mol/L 金属离子 K+、Li+、Cs+、Ag+、Na+、Cu2+、Ba2+、Be2+、Ca2+、Cd2+、Fe2+、Hg2+、Mg2+、Mn2+、Ni2+、Pb2+、Sr2+、Zn2+、Co2+和Fe3+的高氯酸盐后测试其紫外-可见吸收光谱与荧光发射光谱。
如图4a所示,加入上述金属阳离子后,其紫外-可见吸收光谱及荧光发射光谱均没有产生明显的变化。当加入1.0×10-3mol/L(10eq)Cr3+时,其紫外-可见吸收光谱在560nm处出现了明显的吸收峰,溶液颜色由无色变为粉红色(图5),同时在峰值为588nm处可以清楚地观察到有一明显的荧光吸收峰(图4b)。上述结果表明RP1对Cr3+具有较好的专一性识别能力。在常见重金属离子中,通常Hg2+、Pb2+等软Lewis酸倾向与S、P等软Lewis碱配位,Cu2+、Ni2+等与配体易于形成近似平面配位结构,Zn2+、Cd2+易于形成四面体型的四配位结构,而通常Fe2+、Cr3+倾向于形成八面体的配位结构,因而我们推测此识别的高度专一性可能与其配位基团环境及空间几何构型的综合因素相关。同时,为了模拟其在实际应用中的环境,评价了在溶液中其它金属离子共存的条件下(摩尔比1∶1)RP1对Cr3+离子识别的干扰。由图4c可以看出,金属离子 Cu2+、Ba2+、Ag+、Ca2+、Cd2+、Fe2+、Hg2+、Mg2+、Mn2+、Ni2+、Pb2+、Sr2+和Zn2+的存在对Cr3+的吸收光谱测定没有明显的干扰。结果表明,在其它金属离子存在的情况下,RP1可以在含水介质体系中作为潜在的、具有较高选择性的Cr3+离子化学传感器得到应用。

图4 RP1(Tris-HCl/acetone,V∶V=1∶1,1.0×10-4 mol/L,pH=7.2)中加入10倍量的各种金属离子(1.0×10-3 mol/L)后的紫外-可见(a)及荧光光谱(b),以及在等当量共存离子条件下的RP1和Cr3+识别后在560nm波长下的吸光度(c)

图5 向RP1的 Tris-HCl/Acetone(V∶V=1∶1,pH =7.2)溶液(1.0×10-4 mol/L)中加入金属离子(1.0×10-3 mol/L)后,RP1溶液颜色由无色变为粉红色的照片
2.2 RP1与Cr3+离子识别的化学计量比及结合常数的测定
在上述选择性识别的基础上,采用Job’s plot方法研究了RP1与Cr3+识别的化学计量比(RP1与Cr3+离子间的总浓度保持为2.2×10-3mol/L,如图6所示)。发现Cr3+/RP1+Cr3+在摩尔比为0.5时在560nm处出现了最大吸收,表明Cr3+和RP1按照1∶1的计量比进行相互作用。同时,采用 MALDI-TOF质谱法对RP1/Cr3+识别复合物的化学计量比进行了确定。MALDI-TOF质谱显示RP1在m/z 615.30处存在分子离子峰[M+H]+;当加入上述浓度的 Cr3+时,在m/z 666.95处出现一个新的特征峰,经计算可确定为RP1和Cr3+结合后生成了RP1+Cr3+。由上述结果可看出,RP1与Cr3+离子识别后形成了化学计量比为1∶1的复合物。

图6 RP1和Cr3+在缓冲溶液(Tris-HCl/acetone,V∶V=1∶1,pH=7.2)中相互作用的Job′s plot图(RP1和Cr3+总浓度2.2×10-3 mol/L,记录波长560nm)
为确定RP1吸收光谱强度变化和溶液中Cr3+离子浓度对应的定量关系,利用光谱滴定方法,通过向RP1溶液中滴加Cr3+进而测定其吸收光谱的变化来确定吸光度与Cr3+离子浓度之间的依存关系。如图7所示,随着Cr3+离子浓度的逐渐增加,在560nm处产生的吸收峰的强度也逐渐增强,最后达到一个平衡状态。根据上述Cr3+和RP1识别1∶1的化学计量比,进行非线性拟合后[17],进一步计算出RP1/Cr3+复合物的结合常数为Ks=3.43×104(R=0.9975)。

图7 RP1(Tris-HCl/acetone,V∶V=1∶1,1.3×10-4 mol/L,pH=7.2)中加入不同量的Cr3+(浓度1.0×10-4 mol/L~1.0×10-3 mol/L)后的紫外-可见光谱图,内插图为560nm处的吸光度与Cr3+浓度的相关曲线
2.3 RP1对Cr3+离子识别过程中的检测限的测定
以加入Cr3+离子后的RP1溶液体系在560 nm处的吸光度为纵坐标,以Cr3+离子的浓度为横坐标进行线性拟合作图,得二者之间的线性关系如图8所示。其中Cr3+离子的线性浓度范围是0.1×10-4~0.8×10-4mol/L,线性拟合方程为:y=0.0066+0.3325x(k=0.3325,R2=0.9942)。其测定标准偏差s=0.0126,以3倍标准偏差计算的检测限3s/k=0.11×10-4mol/L。结果表明,RP1可以作为一种有效的化学传感器应用于Cr3+离子的实际定量检测。

图8 RP1(Tris-HCl/acetone,V∶V=1∶1,pH=7.2,1.0×10-4 mol/L)随 Cr3+ 浓度(1.0×10-4 mol/L~1.0×10-3 mol/L)变化的相关曲线及其线性拟合结果
2.4 RP1对Cr3+离子识别的机制研究
一般的,对于金属离子诱导的罗丹明螺酰胺环开环-闭环反应而言,目前已阐明存在着金属离子配位以及金属离子催化水解开环两种可能的反应 (识 别 )机 制[5,18,19]。 为 进 一 步 研 究 RP1 与Cr3+离子的识别机制,在缓冲溶液体系(Tris-HCl/丙酮V∶V=1∶1,pH=7.0)中研究了 RP1与Cr3+离子作用的化学可逆性。如图9所示,Cr3+离子可诱导RP1开环继而在560nm处产生显著的吸收峰(图9,线b);当向体系中加入与Cr3+等摩尔比的乙二胺四乙酸(EDTA)后,其吸收峰几乎完全消失,这是因为EDTA对Cr3+的强螯合作用将Cr3+从与RP1配位结合的状态夺取出来(图9,线c)。向上述混合溶液中再次加入过量的Cr3+离子后,RP1在560nm处的吸收峰强度可恢复到原来的80%(图9,线d)。当加入过量的EDTA后,RP1/Cr3+离子混合溶液的粉红色迅速消失;而再次加入过量的Cr3+离子后混合液的颜色又可恢复到原来的粉红色,该颜色变化也可用目视比色观察。该结果表明RP 1与Cr3+离子的结合过程是化学可逆的,加入Cr3+离子后吸收和荧光光谱的增强,可由Cr3+离子配位所诱导的螺环内酰胺开环机制进行合理解释,而并非通过金属离子催化螺环内酰胺水解开环机制进行[10,12],即Cr3+离子与螺环内酰胺上的氧原子配位后可进一步诱导相邻的内酰胺开环,使其由非共轭的SP3杂化状态转变成平面共轭的SP2杂化状态,从而使得吸收光谱和荧光光谱强度大大增加,最终呈现无色-粉红色的显著变化(图10)。此外,对RP1探针与Cr3+识别后响应时间与体系紫外吸收强度(560nm)的变化关系可知,反应在6min左右基本趋于完全。

图9 RP1(Tris-HCl/acetone,V∶V=1∶1,1.7×10-4 mol/L,pH=7.2)的紫外-可见吸收光谱曲线(a),往上述RP1溶液中加入Cr3+(1.0×10-3 mol/L)后的紫外-可见吸收光谱曲线,(c)RP1溶液(1.7×10-4 mol/L)中加入 Cr3+(1.0×10-3 mol/L),然后加入EDTA (1.0×10-3 mol/L)的紫外-可见光谱吸收曲线,(d)RP1溶液(1.7×10-4 mol/L)中加入Cr3+(1.0×10-3 mol/L),加入EDTA (1.0×10-3 mol/L),再加入Cr3+(1.0×10-3 mol/L)后的紫外-可见吸收光谱曲线
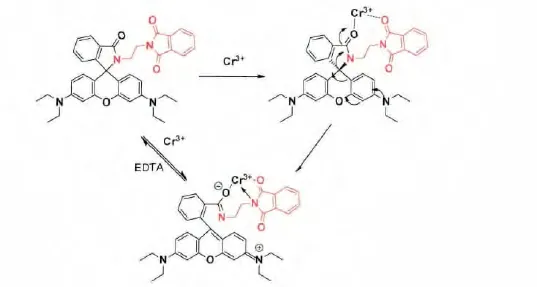
图10 Cr3+诱导RP1螺内酰胺可逆开环识别的可能机理
2.5 pH值对Cr3+离子识别的影响

图11 不同pH环境条件下,RP1(Tris-HCl/acetone,V∶V=1∶1,1.1×10-4 mol/L)中加入Cr3+(1.0×10-3 mol/L)后的紫外-可见光谱图
随后,对RP1和Cr3+离子识别响应的pH值影响因素也进行了研究。从图11中可看出,探针分子RP1(1.1×10-4mol/L)在pH 3.8~8.0的环境条件下,其在560nm处的吸光度无显著变化,表明在该范围内pH值的变化不会引起RP1的开环-闭环转变。而一定量的Cr3+离子(1.0×10-3mol/L)加入后,RP1(1.1×10-4mol/L)在3.8~7.0的pH值时,560nm处的吸光度随着pH的增大而升高,可能是由于质子与Cr3+离子对RP1的竞争性结合所致。即是说较低pH时,RP1酰胺结构质子化使得Cr3+离子的配位能力降低,导致在560nm处的吸光度下降;而pH增大后,RP1去质子化使得螺内酰胺环更易受Cr3+离子配位诱导而打开,导致相应的吸光度增强。但是,当pH值从7.0增加到8.0时,吸光度又开始下降,这可能是由于在较高pH环境下生成了一些Cr3+的水合物种如Cr(OH)3、Cr(OH)-4等,降低了其对螺内酰胺环的配位诱导开环作用所致。
2.6 RP1对Cr3+离子识别的响应时间
在pH=7的中性水溶液中,RP1对Cr3+离子的识别响应灵敏度与两者结合响应时间有密切联系。反应越彻底,其体系紫外强度的变化越大,方法的灵敏度越高。同时发现,体系的紫外吸收强度随时间延长而增强,但达到一定时间后,体系紫外信号变化已非常缓慢(如图12)。并且,配体浓度越低反应时间越短,越容易完全反应。测试结果表明,在规定浓度内两者在5min内即可反应完全。RP1对Cr3+离子具有即时响应特性。

图12 向RP1水/乙醇(Tris-HCl,pH=7.0)溶液(1.0×10-4 mol/L)中加入Cr3+(1.0×10-3 mol/L)后,不同时间时RP1的紫外吸收变化(560nm)
3 结论
本文设计合成了一种罗丹明-邻苯二甲酰胺衍生物RP1。发现在丙酮/水相混合溶液中,其对Cr3+离子具有较高的选择性,而加入其它金属离子并无此响应发生,从而说明RP1对Cr3+离子有较好的选择性识别作用。识别Cr3+离子后其吸收和荧光强度显著增加,有利于光谱检测,并且识别前后体系出现了明显的无色-粉红色变化,便于肉眼直接观察。定量研究结果表明,RP1与Cr3+离子按1∶1的化学计量比结合,其结合常数为Ks=3.43×104。进而通过对RP1和Cr3+离子识别机制的研究可知,加入Cr3+离子后可使RP1发生诱导开环且该反应可逆。该研究的相关结果为继续发展基于开环-闭环机制的、具有高选择性和灵敏度的Cr3+离子检测探针分子提供了一定的参考依据。
[1] Arakawa H,Ahmad R,Naoui M,Tajmir-Riahi H.A comparative study of calf thymus DNA binding to Cr(Ⅲ)and Cr(Ⅵ)ions.Evidence for the guanine N-7-chromium-phosphatechelate formation[J].Journal of Biological Chemistry,2000,275:10150-10153.
[2] Vincent J B.Quest for the molecular mechanism of chromium action and its relationship to diabetes [J].Nutrition reviews,2000,58:67-72.
[3] Singh A K,Gupta V K,Gupta B.Chromium (Ⅲ)selective membrane sensors based on Schiff bases as chelating ionophores[J].Analytica Chimica Acta,2007,585:171-178.
[4] Zhang X,Yin J,Yoon J.Recent advances in development of chiral fluorescent and colorimetric sensors [J].Chemical Reviews,2014,114:4918-4959.
[5] Chen X,Pradhan T,Wang F,Kim J S,Yoon J.Fluorescent chemosensors based on spiroring-opening of xanthenes and related derivatives[J].Chemical Reviews,2012,112:1910-1956.
[6] Quang D T,Kim J S.Fluoro-and chromogenic chemodosimeters for heavy metal ion detection in solution andbiospecimens[J].Chemical Reviews,2010,110:6280-6301.
[7] Liu W M,Xu L W,Zhang H Y,You J J,Zhang X L,Sheng R L,Li H P,Wu S K,Wang P F.Dithiolane linked thiorhodamine dimer for Hg2+recognition in living cells[J].Organic & Biomolecular Chemistry,2009,7:660-664.
[8] Sheng R L,Ma J J,Wang P F,Liu W M,Wu J S,Li H P,Zhuang X Q,Zhang H Y,Wu S K.Enzyme sensing based on a controllable oxidation reaction [J].Biosensors & Bioelectronics,2010,26:949-952.
[9] Chen J H,Liu W M,Zhou B J,Niu G L,Zhang H Y,Wu J S,Wang Y,Ju W G,Wang P F.Coumarin-and rhodamine-fused deep red fluorescent dyes:synthesis,photophysical properties,and bioimaging in vitro[J].The Journal of Organic Chemistry,2013,78:6121-6130.
[10] Zhou Z G,Yu M X,Yang H,Huang K W,Li F Y,Yi T,Huang C H.FRET-based sensor for imaging chromium(Ⅲ)in living cells[J].Chemical Communications,2008,29:3387-3389.
[11] Weerasinghe A J,Schmiesing C,Sinn E.Highly sensitive and selective reversible sensor for the detection of Cr3+[J].Tetrahedron Letters,2009,50:6407-6410.
[12] Zhou Y,Zhang J,Zhang L,Zhang Q,Ma T,Niu J.A rhodamine based fluorescent enhancement chemosensor for the detection of Cr3+in aqueous media[J].Dyes and Pigments,2013,97:148-154.
[13] Mao J,Wang L N,Tang X L,Yan Y,Liu W S.Tuning the selectivity of two chemosensors to Fe(Ⅲ)and Cr(Ⅲ)[J].Organic Letters,2007,9:4567-4570.
[14] Mahato P,Saha S,Suresh E,Liddo R D,Parnigotto P P,Conconi M T,Kesharwani M K,Ganguly B,Das A.Ratiometric detection of Cr3+and Hg2+by a naphthalimide-rhodamine based fluorescent probe [J].Inorganic Chemistry,2012,51:1769-1777.
[15] Sarkar M,Banthia S,Samanta A.A highly selective offon′fluorescence chemosensor for Cr(Ⅲ)[J].Tetrahedron Letters,2006,47:7575-7578.
[16] Yang Y X,Gao W L,Sheng R L,Wang W L,Liu H,Yang W M,Zhang T Y,Zhang X T.Rhodamine-based derivatives for Cu2+sensing:spectroscopic studies,structure-recognition relationships and its test strips[J].Spectrochimica Acta Part A,2011,81:14-20.
[17] Yang Y X,Xue H M,Chen LC,Sheng RL,Li X Q,Li K.Colorimetric and highly selective fluorescence “turn-on”detection of Cr3+by using a simple schiff base sensor[J].Chinese Journal of Chemistry,2013,31:377-380.
[18] Dujols V,Ford F,Czarnik A W.A long-wavelength fluorescent chemodosimeter selective for Cu (Ⅱ)ion in water[J].Journal of the American Chemical Society,1997,119:7386-7387.
[19] Kaur N,Kumar S.Colorimetric metal ion sensors[J].Tetrahedron,2011,67:9233-9264.
