乳腺癌组织中沉默信息调节因子和富含半胱氨酸的酸性分泌蛋白的表达及临床意义
2015-01-05高琳璐于国华张居民
高琳璐 于国华 张居民
1.潍坊医学院研究生学院,山东潍坊261000;2.山东省潍坊市人民医院,山东潍坊261000
乳腺癌组织中沉默信息调节因子和富含半胱氨酸的酸性分泌蛋白的表达及临床意义
高琳璐1于国华2张居民2
1.潍坊医学院研究生学院,山东潍坊261000;2.山东省潍坊市人民医院,山东潍坊261000
目的探讨沉默信息调节因子(SIRT1)和富含半胱氨酸的酸性分泌蛋白(SPARC)在乳腺癌组织中的表达及其与临床病理指标之间的关系。方法收集潍坊市人民医院2014年1~6月经病理明确诊断的乳腺浸润性导管癌石蜡标本60例和乳腺纤维瘤标本15例,应用免疫组化法检测乳腺癌组织和乳腺纤维腺瘤组织中SIRT1和SPARC的表达情况。结果SIRT1在乳腺癌组织中的阳性表达率(61.7%,37/60)明显高于乳腺纤维腺瘤组织(33.3%,5/15),差异有统计学意义(P<0.05);有乳腺癌淋巴结转移的SIRT1高表达率(72.0%,18/25)高于无淋巴结转移(25.7%,9/35),TNM分期为Ⅲ期的乳腺癌中SIRT1高表达率(77.3%,17/22)高于Ⅰ、Ⅱ期(26.3%,10/38),差异均有高度统计学意义(P<0.01)。SPARC在乳腺癌间质细胞的高表达率(73.3%,44/60)明显高于肿瘤细胞(10.0%,6/60)和乳腺纤维腺瘤间质细胞(40.0%,6/15),差异均有统计学意义(P<0.05);SPARC在乳腺癌有淋巴结转移的高表达率(96.0%,24/25)高于无淋巴结转移的(74.3%,26/35),差异有统计学意义(P<0.05)。结论乳腺癌中SIRT1、SPARC的高表达与乳腺癌的发生、发展、侵袭和转移有关。
乳腺癌;乳腺肿瘤;SIRT1;SPARC
据世界卫生组织(WHO)统计资料显示,2000年全球新发女性乳腺癌病例超过100万,标化发病率为35.66/10万,标化病死率为12.5/10万,乳腺癌已成为全球妇女首发恶性肿瘤。在乳腺癌的病理类型中,浸润性导管癌恶性程度较高,预后较差。沉默信息调节因子(SIRT1)基因位于10q22.1,长约33 kb,蛋白分子量约为60 kU,具有烟酰胺腺嘌呤二核苷酸(NAD)依赖的脱乙酰基酶活性,其广泛存在于人体各个细胞内。富含半胱氨酸的酸性分泌蛋白(SPARC),是一种非胶原糖蛋白,它在肿瘤中的作用是促进肿瘤细胞黏附,诱导肿瘤细胞迁移,并改变肿瘤细胞基质成分。两者均与乳腺癌的发生、发展、浸润和转移有关。本研究采用免疫组化检测SIRT1和SPARC在乳腺癌组织中的表达情况,并进一步分析SIRT1、SPARC与临床病理因素之间的关系。
1 材料与方法
1.1 实验材料
标本均为来源于潍坊市人民医院2014年1~6月经病理明确诊断的乳腺浸润性导管癌石蜡60例和乳腺纤维瘤15例,均为女性,年龄≥18岁,中位年龄43岁。所有乳腺癌患者均接受乳腺癌改良根治术或保乳术,术前均未行任何放疗及化疗治疗,无严重、未控制的内科疾病及感染,无病生存时间≥6个月。本研究已经医院伦理委员会研究通过,本研究均在患者及家属知情同意并签署知情同意书的条件下进行。依据TNM分期标准,Ⅰ、Ⅱ、Ⅲ期患者分别为22、16、22例,且伴有淋巴结转移者25例,无淋巴结转移者35例,每例标本均有免疫组化法检测的雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)表达情况。
1.2 实验方法
SIRT1鼠抗人单克隆抗体(一抗,工作浓度1∶400)及SPARC兔抗人单克隆抗体(一抗,工作浓度1∶200)均购自北京博奥森生物技术有限公司,免疫组化试剂盒、抗体稀释液、PBS冲洗液均购自北京中杉金桥生物技术有限公司。免疫组化采用Envision法,组织标本依次经过常规切片,脱蜡入水,高压修复,严格按照试剂盒说明书进行。以已知阳性切片作为阳性对照,用磷酸盐缓冲液代替一抗作为阴性对照。
1.3 结果判定
经两位有经验的病理科专家对结果进行判定,SIRT1在细胞中阳性表达为黄色或棕黄色,SPARC在细胞中阳性表达为棕黄色[1]。根据染色程度及阳性细胞表达数进行评分:不着色记为0分,着色淡者记为1分,着色中等记为2分,着色深者记为3分,阳性细胞表达数:≤5%记为0分,>5%~25%记为1分,>25%~50%记为2分,>50%记为3分;两者得分乘积为最后得分。0~1分记为阴性(-),2~3分记为弱阳性(+),4~6分记为阳性(++),>6分记为强阳性(+++)。在统计分析中将表达(-)~(+)划分为低表达,(++)~(+++)划分为高表达。
1.4 统计学方法
采用SPSS 21.0软件进行统计学分析,SIRT1和SPARC的表达及其与临床病理因素的分析采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 SIRT1在乳腺癌和乳腺纤维腺瘤组织中的表达
免疫组化染色结果显示(图1,封三),SIRT1主要表达于乳腺癌肿瘤细胞的细胞核和细胞质中。在乳腺纤维腺瘤及乳腺癌中,SIRT1的阳性表达率分别为33.3%(5/15)及61.7%(37/60),差异有统计学意义(P<0.05)。
2.2 SPARC在乳腺癌和乳腺纤维腺瘤组织中的表达
免疫组化染色结果显示(图2,封三),SPARC表达于肿瘤细胞、间质细胞的细胞质及细胞核中,以细胞质表达为主。SPARC在乳腺癌间质细胞的高表达率(73.3%,44/60)明显高于乳腺癌肿瘤细胞(10.0%,6/60)和乳腺纤维腺瘤间质细胞(40.0%,6/15),差异均有统计学意义(P<0.05)。提示SPARC在乳腺癌间质细胞中呈高表达,而在肿瘤细胞中呈现低表达。
2.3 乳腺癌组织中SIRT1的表达与临床病理指标的关系
乳腺癌中SIRT1的表达与患者年龄、肿物大小、ER、PR等因素均无关(P>0.05),但与TNM分期、腋窝淋巴结转移有关(P<0.05)。见表1。2.4乳腺癌组织中SPARC的表达与临床病理参数的关系
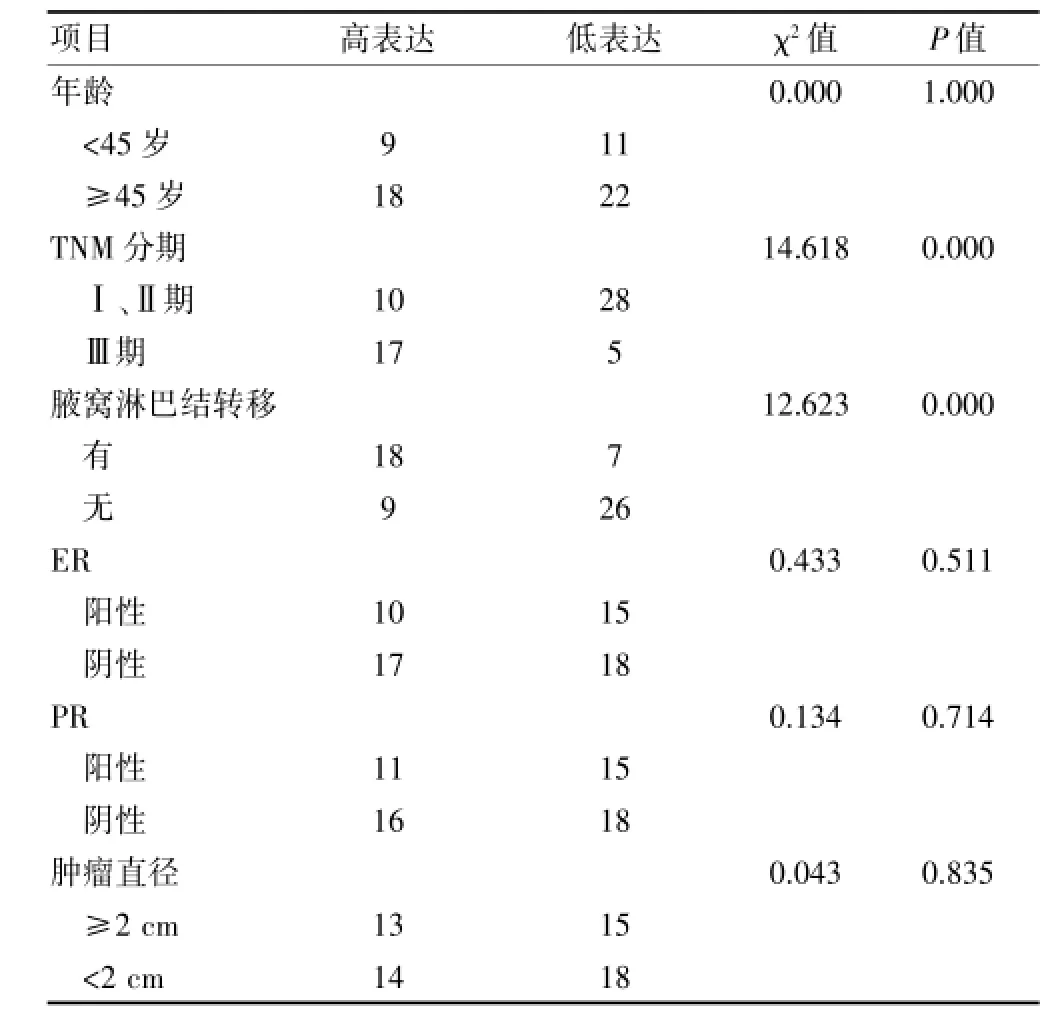
表1 乳腺癌组织中SIRT1的表达与病理指标的关系(例)
乳腺癌中SPARC的表达与患者年龄、肿物大小、ER、PR、TNM分期均无关(P>0.05),但与腋窝淋巴结转移有关(P<0.05)。见表2。

表2 乳腺癌组织中SPARC表达与临床病理指标的关系(例)
3 讨论
SIRTl是组蛋白脱乙酰酶(HDAC)第Ⅲ类蛋白质家族的成员之一,并且是NAD+依赖性组蛋白和蛋白脱乙酰基酶。SIRT1不仅可以通过组蛋白脱乙酰诱导染色质沉默,并且可以通过调节转录活性调节细胞存活,在细胞的生理及病理过程中起重要作用,如基因沉默、DNA损伤修复、肿瘤发生等[13]。SIRT1表达水平与肿瘤分期、淋巴结转移有关。樊林等[14]研究认为,胃癌组织中SIRT1的表达较正常组织表达增高,且浸润深度越深、有淋巴结转移及临床分期越高时,表达随之升高。另有学者研究证明,SIRT1的高表达率在子宫内膜癌、肝癌、结直肠癌中明显上升,且在子宫内膜中的表达水平与临床分期呈正相关[15],在结直肠癌中的表达与分期及淋巴结转移呈正相关[16],这可能与Wang等[17]发现的SIRT1是通过P13K/PTEN/AKT途径促进恶性肿瘤的发生有关。后期进一步研究发现,STRT1还通过脱乙酰基作用调控着诸多与肿瘤关系密切的信号因子,进而影响着肿瘤的各种特性[18-20]。例如:Powell等[21]的研究表明SIRTl的缺失可诱导前列腺上皮内瘤变的发生,表明了SIRT1的抗肿瘤作用。但关于SIRT1在乳腺癌组织中的表达研究较为少见。本研究显示,在乳腺纤维腺瘤中SIRT1的阳性表达率为33.3%,明显低于乳腺癌中SIRT1的阳性表达率(61.7%),差异有统计学意义(P<0.05),在有淋巴结转移、TNM分期为Ⅲ期的乳腺癌中SIRT1的高表达率高于无淋巴结转移、Ⅰ、Ⅱ期(P<0.05),这与宋新峰[22]研究结果一致。SIRT1的表达与患者年龄、性别、肿物大小、ER、RP表达情况无关(P>0.05)。提示SIRT1可作为乳腺癌的诊断、病程判断、预示乳腺癌的恶性程度的重要参考指标。
SPARC是一种含有大量半胱氨酸(Cys)的酸性分泌蛋白,又称骨连接蛋白(osteonec-fin)或基底膜40蛋白(BM40),编码SPARC蛋白的基因位于人类染色体5q31.3~q32,包含10个外显子,全长25.9 kb,为单拷贝基因[2]。SPARC蛋白的主要功能是阻止细胞黏附、促使细胞变形、改变细胞周期、调整细胞分化及抑制某些生长因子对细胞的刺激,还可以调节细胞外基质和基质金属蛋白酶的产生,并能影响新生血管的生成[3]。SPARC具有明显的组织特异性,已有研究表明,SPARC在转移性黑色素瘤中呈现高表达,在绝大多数异常痣中呈现中等表达[4-5];在前列腺癌的部分原发灶中呈现低表达或中等表达,在大部分前列腺癌转移灶中高表达[6],此外,SPARC在恶性肿瘤中的表达与淋巴结转移有关。杨锡贵等[7]研究认为在有淋巴结转移的食管鳞癌患者中,SPARC蛋白阳性表达率较无淋巴结转移组升高;另有学者研究表明,在肺癌组织[8]及子宫内膜癌组织[9]中,SPARC的表达与淋巴结转移呈负相关。学者将正常表达SPARC的小鼠和SPARC敲除小鼠进行比较,发现前者肿瘤的发生、发展、转移明显慢于后者。这可能与SPARC表达减少后影响ECM聚集,导致胶原沉着和纤维形成减少,抑制肿瘤细胞的黏附和迁移有关[10]。本研究结果表明,SPARC在乳腺癌组织和乳腺纤维腺瘤组织中表达存在差异性,在乳腺癌间质细胞的高表达率(73.3%)高于乳腺纤维腺瘤中高表达率(40.0%),两者差异有统计学意义;在乳腺癌的间质细胞中SPARC的高表达率明显高于肿瘤细胞(10.0%)(P<0.05),这与张雪梅[11]研究结果相一致。乳腺癌中有淋巴结转移的SPARC高表达率(96.0%)高于无淋巴结转移(74.3%)(P<0.05),这与孙孝媛等[4]研究结果一致。说明在有淋巴结转移组中SPARC的表达强度可能与乳腺癌的浸润转移有关,这可能与Rotllant等[12]研究认为的SPARC通过溶解细胞黏着斑、促使细胞变圆、促进细胞骨架重排来完成其抗黏附作用,增加肿瘤的侵袭和转移能力有关。SPARC在TNM分期为Ⅲ期的高表达率(94.4%)高于Ⅰ、Ⅱ期(76.3%),但差异无统计学意义(P>0.05),考虑本研究纳入乳腺癌患者例数较少,Ⅰ、Ⅱ期患者占63.3%。SPARC在乳腺癌组织中的表达是否与TNM分期有关,虽然本研究尚未得出具有统计学意义的结果,但可能随着样本量的增加,会出现有意义的结果。本研究结果表明,SPARC在乳腺癌中的表达与患者年龄、ER、PR、肿物大小、病理分期等因素无关,与淋巴结转移有关。这些提示SPARC与乳腺癌的发生、发展、侵袭和转移有关。
综上所述,SIRT1、SPARC在乳腺癌组织中均呈高表达。SIRT1和SPARC均参与了乳腺癌的发生、发展和转移,两者之间的具体作用机制及两者之间是否存在相关性仍有待进一步研究。
[1]刘晓梅,于国华,张居民,等.乳腺癌组织SPARC和VEGF表达临床意义的探讨[J].中华肿瘤防治杂志,2012,19(14):1061-1065.
[2]Brekken RA,Sage EH.SPARC,a matricellular pro-tein:at the crossroads ofcell-matrix communica-tion[J].Matrix Biol,2001,19(18):816-827.
[3]徐东旭,徐璐,李彦君,等.SPARC蛋白在乳腺癌组织中的表达及临床意义[J].中国医科大学学报,2014,43(6):493-498.
[4]孙孝媛,于国华,张居民,等.乳腺癌组织中SPARC和Her-2的表达[J].中国医药科学,2014,4(12):18-21.
[5]Mok SC,Chan WY,Wong KK,et al.SPARC,an extracellular matrix protein with tumor-suppressing activity in human ovarian epithelial cells[J].Oncogene,2012,12:1895-1901.
[6]Thomas R,True LD,Bassuk JA,et al.Different expression of osteonectin/SPARC during human prostate cancer progression[J].Clin Cancer Res,2000,6:1140-1149.
[7]杨锡贵,姜超,刘封,等.SPARC蛋白在食管鳞癌组织中的表达及临床意义[J].肿瘤防治杂志,2012,39(19):1240-1242.
[8]郑英娟,汤建华,张志林,等.肺癌中SPARC和TGFβ1的表达及意义[J].肿瘤防治研究,2014,41(6):593-597.
[9]王蕾,崔竹梅,郑烨,等.SPARC在子宫内膜癌组织中的表达及意义[J].现代生物医学进展,2011,3(5):593-597.
[10]Puolakkainen PA,Brekken RA,Muneer S,etal.Enhanecd growth ofpancreatic tumors in SPARC-nullmice is associated with decreased deposition of extracellul armatrix and reduced tumorcellapoptosis[J].MolCancerRes,2004,2(4):215-224.
[11]张雪梅.乳腺浸润性导管癌中SPARC、KISS-1和KALL的表达和意义[D].上海:上海交通大学,2008.
[12]RotllantJ,Liu D,Yan YL,etal.Sparc(Osteonectin)functions in morphogenesis of the pharyngeal skeleton and inner ear[J].Matrix Biol,2008,27:561-572.
[13]Marcia CH.Mamma lian sintuins emerging roles in physiology,aging and calorie restriction[J].Gen Dev,2008,20(21):2913-2921.
[14]樊林,陈锐,赵勇,等.Sirt1、P53及P-gp在胃癌中的表达及其临床意义[J].西安交通大学学学报,2013,34(5):642-646.
[15]郭宏英,张云良,李志红,等.子宫内膜癌中Sirt1和Survivin的表达和意义[J].临床与实验病理学杂志,2012,28(11):1224-1227.
[16]马静静,张云良,李志红,等.结直肠癌中Sirt1和Survivin的表达和意义[J].临床与实验病理学杂志,2013,29(11):74-77.
[17]Wang H,Liu H,Chen K,et al.SIRT1 promotes tumorigenesis of hepatocellular carcinoma through PI3K/PTEN/ AKT signaling[J].On-col Rep,2012,28:311-318.
[18]乔爱君,左瑾,刘晓军.SIRT1基因的研究进展[J].中国医学科学院学报,2009,31(6):782-785.
[19]张广,吴俊华.SIRT1与肿瘤的研究进展[J].世界华人消化杂志,2013,21(1):6-12.
[20]Lim CS.SIRT1:tumor promoter or tumor suppressor?[J]. Med Hcpotheses,2012,67:341-344.
[21]Powell MJ,Casimiro MC,Cordon-Cardo C,et al.Disruption of a Sirtl-dependent autophagy checkpoint in the prostate results in prostatic intraepithelial neoplasia lesion formation[J].Cancer Res,2011,71(3):964-975.
[22]宋新峰.SIRT1在乳腺癌中的作用[J].国际病理科学与临床杂志,2012,32(4):352-355.
Expression and significance of SIRT1 and SPARC in breast invasive ductal carcinoma tissues
GAO Linlu1Y U Guohua2ZHANG Jumin2
1.Graduate School,Weifang Medical College,Shandong Province,Weifang 261000,China;2.Weifang People's Hospital,Shandong Province,Weifang 261000,China
ObjectiveTo explore the expressions and role of SIRT and SPARC in invasive ductal carcinoma of the breast.Methods60 samples of pathologically diagnosed breast invasive ductal carcinoma and 15 samples of bresat fibroadenomastromal tissues in Weifang People's Hospital from January to June 2014 were selected,the expressions of SIRT1 and SPARC in these samples were detected by immunohistochemical technique.ResultsSIRT1 positive expression rate in breast cancer cells(61.7%,37/60)was significantly higher than that in breast fibroadenoma(33.3%,5/15), the difference was statistically significant(P<0.05);SIRT1 higher expression rate in invasive ductal carcinoma with lymph node metastasis(72.0%,18/25)was higher than that without lymph node metastasis(25.7%,9/35),the SIRT1 higher expression rate in TNMⅢ(77.3%,17/22)was significantly higher than that in TNMⅠ,Ⅱ(26.3%,10/38),the differences were statistically significant(P<0.01).SPARC higher erexpression rate in breast cancer interstitial cells (73.3%,44/60)was significantly higher than those in breast cancer tumor cells(10.0%,6/60)and bresat fibroadenomastromal interstitial cells(40.0%,6/15),the differences were statistically significant(P<0.05).SPARC higher expression rate in breast cancer with lymph node metastasis(96.0%,24/25)was higher that that without lymph node metastasis (74.3%,26/35).ConclusionThe higher expression of SIRT1 and SPARC in breast cancer are involved in breast cancer occurrence,development and prognosis.
Breast cancer,Breast neoplasms;SIRT1;SPARC
R737.9
A
1673-7210(2015)01(c)-0015-04
高琳璐,女,山东淄博人,潍坊医学院2012级肿瘤学专业在读硕士研究生;研究方向:恶性肿瘤的临床和基础研究。
于国华,男,山东滨州人,主任医师,教授,硕士研究生导师,主要从事肿瘤的临床和基础研究工作。
2014-10-14本文编辑:苏畅)
