替莫唑胺联合同步放疗对肺癌脑转移的临床观察
2015-01-05陶海涛汪进良马俊勋董伟伟解放军总医院肿瘤内一科北京00853南开大学医学院天津30000
张 渝,陶海涛,汪进良,马俊勋,董伟伟,胡 毅(.解放军总医院肿瘤内一科,北京 00853;2.南开大学医学院,天津 30000)
·临床评价·
替莫唑胺联合同步放疗对肺癌脑转移的临床观察
张 渝1,2,陶海涛1,2,汪进良1,马俊勋1,董伟伟1,胡 毅1(1.解放军总医院肿瘤内一科,北京 100853;2.南开大学医学院,天津 300100)
目的:评价替莫唑胺联合同步全脑放疗对肺癌脑转移患者的有效性和安全性。方法:收集替莫唑胺联合全脑放疗治疗肺癌脑转移患者24例,全脑放疗总剂量40 Gy,2 Gy/次,5次/周。全脑放疗后,对部分局部病灶三维适形局部加量至50 ~60 Gy。所有患者于放疗第1天开始给予替莫唑胺75 mg·m-2口服治疗,直至放疗结束,如有不良反应不可耐受则停用化疗药。后续根据患者的系统治疗和耐受情况,患者在放疗结束后接受系统化疗或继续替莫唑胺辅助治疗(150 ~ 200 mg·m-2·d-1,5/28天),最多行6周期辅助治疗,评价患者的疗效与不良反应。结果:24例患者全部完成颅脑的同步放化疗,10例患者接受个体化选择的系统化疗,7例接受最佳支持治疗,3例患者接受4个周期替莫唑胺辅助治疗,3例患者接受了6周期辅助治疗。放化疗结束后颅内病灶评价:完全缓解2例,部分缓解7例,稳定12例,进展3例,总有效率37.5%,疾病控制率87.5%,中位PFS为5个月,中位颅内病灶PFS为6个月。18例患者出现治疗相关不良反应,其中3例(12.5%)出现Ⅲ~Ⅳ度血液学毒性反应。4例(16.7%)出现Ⅲ~Ⅳ度非血液学毒性反应。结论:替莫唑胺联合全脑放疗治疗肺癌脑转移疗效较满意,不良反应可耐受,治疗依从性较好,远期生存获益仍需进一步的临床研究予以验证。
替莫唑胺;全脑放疗;脑转移;肺癌
脑组织是恶性肿瘤的常见转移部位,临床的发生率为10% ~ 30%[1]。不同部位的原发肿瘤脑转移的发生率也不同,其中最常出现脑转移的原发肿瘤是肺癌(约50%),临床上80%的脑转移来源于肺癌[2]。肺癌患者一旦出现脑转移,则意味着生活质量的下降和不良的预后,脑转移患者的中位生存期仅为2 ~ 4个月[3]。脑转移癌的治疗手段有限,全脑放疗是主要的治疗方法,生存期可延长至3 ~ 6个月[4]。由于大多数化疗药不能透过血脑屏障,化疗在脑转移瘤的治疗作用上较为局限。替莫唑胺(temozolomide,TMZ)是一种新型的咪唑四嗪类具有抗肿瘤活性的烷化剂,口服后可被迅速完全吸收,可透过血脑屏障进入脑脊液,在中枢神经系统达到有效的药物浓度,作用于肿瘤细胞分裂的各个时期,是治疗中枢神经系统肿瘤的新型药物[5]。单用替莫唑胺在多线治疗以后的脑转移瘤患者上获得了37%的神经症状控制率[6],显现了初步的疗效,单就替莫唑胺联合全脑放疗在肺癌脑转移的有效性和安全性上还缺乏相关的研究。本文回顾性分析2012年8月 – 2013年10月我院使用替莫唑胺联合同步放疗治疗的肺癌脑转移患者24例,以探索替莫唑胺联合全脑放疗的疗效。
1 资料与方法
1.1 一般资料
本研究经中国人民解放军总医院伦理委员会批准,选取我院2012年8月 – 2013年10月收治的24例肺癌伴脑转移患者为研究对象,入组患者均符合以下标准:(1)患者经病理确诊为肺癌。(2)头颅CT或MRI增强扫描等影像学检查证实有脑转移。(3)颅内至少有一个可测量或可评价的病灶。(4)患者年龄18 ~80岁,KPS≥60分,预计生存期3个月以上。(5)外周血中性粒细胞≥3.5×109·L-1,血小板≥100×109·L-1,血红蛋白≥100 g·L-1。血肌酐、胆红素< 1.5倍正常上限,转氨酶< 2倍正常上限。(6)未合并其他严重的内科疾病。
1.2 治疗方法
本组患者头部放疗为常规全脑放疗,放疗总剂量为40 Gy,2 Gy/次,5次/周,全脑放疗后,根据肿瘤反应情况,对部分局部病灶三维适形局部加量至50 ~ 60 Gy。放疗同期给予口服替莫唑胺胶囊(默沙东)75 mg·m-2,直至放疗结束,如有不良反应不可耐受则停用化疗药。后续根据患者的系统治疗和耐受情况,患者在放疗结束后接受系统化疗或继续替莫唑胺辅助治疗(150 ~ 200 mg·m-2·d-1,5/28天),最多行6周期辅助治疗。替莫唑胺胶囊需空腹服用,服用前可予托烷司琼或昂丹司琼等5-HT类止吐药。此外,根据患者病情变化使用甘露醇及地塞米松行脱水治疗,以减轻全脑放疗引起的脑组织水肿。化疗同时根据血象变化,及时给予粒细胞集落刺激因子及TPO皮下注射行升白细胞及血小板治疗,必要时予甲氧氯普胺、昂丹司琼等止吐治疗。
1.3 随访
治疗前完成颅脑MR、血常规、血生化、心电图检查作为基线标准,放化疗同步治疗期间,每周复查血常规、血生化。放疗结束后1个月复査颅脑MR评价近期疗效,此后每2个月复查一次,除非中途出现严重的中枢神经系统症状。每周期服用替莫唑胺前复查血常规、血生化。
1.4 疗效评价
近期疗效评价按照RECIST实体瘤近期疗效评价标准分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。以客观有效率(OR) = CR+PR作为主要观察指标,以总生存率(OS)、无进展生存率(PFS)及神经症状作为次要生存观察指标。总生存时间定义为自治疗开始之日起到患者死亡或最后1次随诊的时间间隔;无进展生存时间定义为治疗开始之日至疾病进展或者死亡的时间间隔;颅内无进展生存时间定义为自治疗之日到患者出现颅内病灶进展或者死亡的时间。治疗期间出现的不良反应按抗癌药物毒副反应的分度标准进行评估。治疗期间出现的不良反应按WHO抗癌药物毒副反应的分度标准进行评估,主要记录患者骨髓抑制、肝肾功能损害、胃肠道反应等毒副反应情况,分为Ⅰ~Ⅳ度。
1.5 统计学处理
采用SPSS17.0软件对各组数据进行分析,计量资料以均数±标准差表示,符合正态分布的计量资料组间比较采用t检验或秩和检验,采用Kaplan-Meier法计算生存率。以P < 0.05表示差异有统计学意义。
2 结果
2.1 入组情况
入组的24例患者中男性14例,女性10例,年龄23 ~ 75岁,中位年龄56岁,原发肿瘤:腺癌11例,鳞癌2例,小细胞癌11例。本组病例末次随访截止于2014年10月,随访时间为8 ~ 22个月,中位随访时间为13个月,失访1例。死亡5例,其中1例死于脑转移病灶,2例死于脑外病灶,2例死于非肿瘤疾病,存活患者中,脑转移病灶控制良好。患者的一般资料见表1。
2.2 疗效评价
24例患者全部完成同步化疗。同步放化疗结束后,10例患者接受个体化选择的系统化疗,7例接受最佳支持治疗,3例患者接受4个周期替莫唑胺辅助化疗,3例患者接受6周期辅助化疗。放化疗结束后颅内病灶评价:完全缓解2例,部分缓解7例,稳定12例,进展3例,总有效率37.5%,疾病控制率87.5%。其中2例1个转移病灶的患者达到完全缓解;3例发生疾病进展的患者中,1例出现颅内新发病灶;2例原有转移瘤增大。具体近期疗效评价情况见表2。该组患者中位PFS为5个月,中位颅内病灶PFS为6个月,中位OS为13个月(详见图1、图2)。

表1 24例接受替莫唑胺联合同步全脑放疗的患者临床资料Tab 1 Characteristics of 24 patients treated with whole brain radiotherapy combined with temozolomide

表2 放化疗后近期疗效评价Tab 2 Recent therapeutic evaluation after radiotherapy and chemotherapy
2.3 不良反应
同步放化疗中5例患者在治疗2周内出现明显头晕头痛反应,考虑为放疗引起脑水肿短暂加重造成颅内压增高所致,予对症治疗后症状均缓解。其余的不良反应包括胃肠道反应、肝功能损害、血象降低等,具体情况详见表3。同步放化疗期间所有患者均未出现严重的神经系统症状,也未有患者因相关不良反应导致替莫唑胺减量及放疗停止,仅有2例患者因消化道症状较重导致放疗延迟2 d。
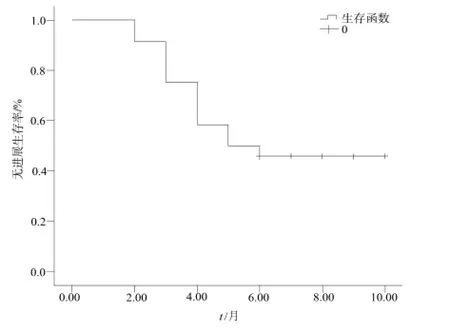
图1 全组PFS生存曲线Fig 1 The estimation of the PFS by Kaplan-Meier in this study
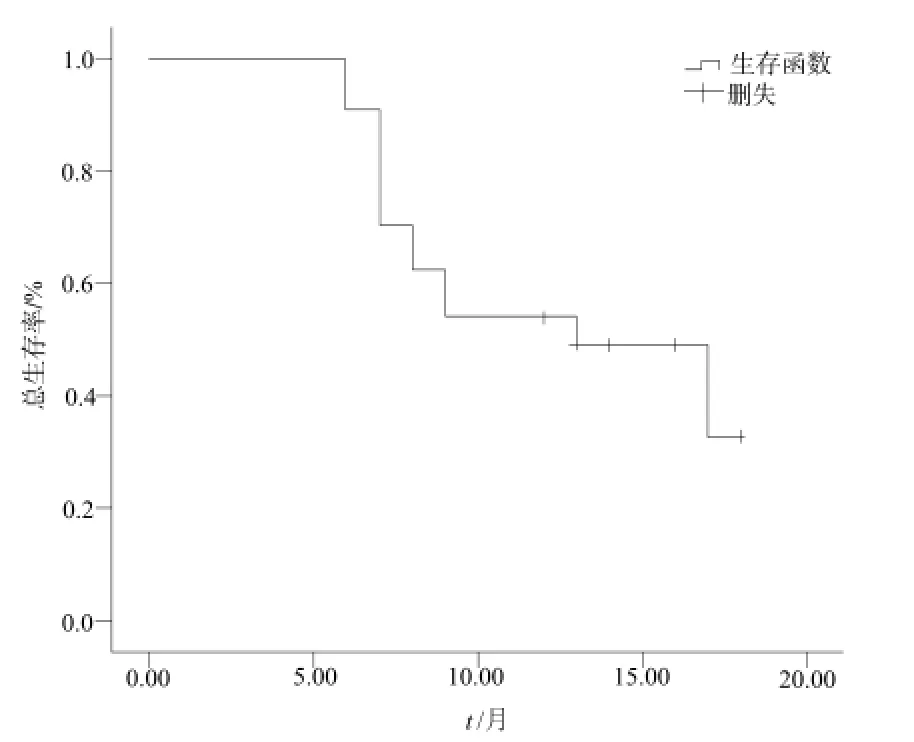
图2 全组OS生存曲线Fig 2 The estimation of the OS by Kaplan-Meier in this study

表3 接受替莫唑胺联合全脑放疗患者的不良反应.例Tab 3 Adverse reactions during the treatment. case
3 讨论
脑组织是肺癌常见的转移部位,一旦出现脑转移瘤常提示肿瘤已进入了晚期,预后差。全脑放疗是目前脑转移的标准治疗方式,单纯全脑放疗的有效率为50%左右[7],能改善患者神经系统的症状,是不能手术患者的首选治疗方法。但多数患者在放疗后3 ~ 4个月出现肿瘤复发进展,因此认为有必要联合化疗提高疗效。单纯化疗对治疗脑转移的疗效一直存在争议,由于血脑屏障的存在,化疗药物无法进入脑脊液达到治疗浓度,而静脉化疗与放疗同步的严重副反应使多数患者无法耐受,因此全脑放疗联合静脉化疗一直未在临床中广泛应用[8]。文献[9]研究证实脑部放疗后血脑屏障通透性可由原来的22.1%升高到74.7%,这提示脑部放疗可明显开放血脑屏障增加化疗药物在血脑屏障的通透率,这为同步放化疗提供了理论支持。
替莫唑胺是新型的口服烷化剂,能够有效的通过血脑屏障,同时替莫唑胺能够诱导肿瘤细胞停滞在G2/ M期,进而发生凋亡,G2/M期是放疗最敏感的阶段,所以替莫唑胺在发挥细胞毒性作用同时有放疗增敏作用[10]。近年来有多个Ⅱ期临床试验对替莫唑胺治疗脑转移瘤的疗效进行了研究。Antonadou等[11]报道了口服替莫唑胺联合全脑同步放疗对比单纯全脑放疗在肺癌和乳腺癌颅内转移的治疗研究,结果显示替莫唑胺联合放疗组与单纯放疗组的客观缓解率分别为96%和67%,两组的中位生存期分别为8.6个月和7.0个月。虽然差异无统计学意义(P = 0.447),但同步放化疗在治疗中显示出一定优势,总体的治疗有效率及神经症状改善程度联合治疗组均较单纯放疗组好,且治疗过程具有良好的耐受性。廖恺等[12]的一项Meta分析共纳入4个替莫唑胺联合全脑放疗治疗非小细胞肺癌的随机对照试验,结果显示替莫唑胺联合全脑放疗与单纯全脑放疗相比,近期客观缓解率方面前者是后者的1.55倍(P = 0.003),但远期的生存获益相当,推测可能是晚期非小细胞肺癌本身的生物学特性所致,替莫唑胺潜在的治疗获益可能被全身的治疗控制失败所抵消。本研究纳入采用替莫唑胺联合全脑放疗治疗肺癌脑转移患者24例,放化疗结束后颅内病灶评价:完全缓解2例,部分缓解7例,稳定12例,进展3例,总有效率37.5%,疾病控制率87.5%。全组患者1年OS为45.83%,6个月PFS为41.66%,中位PFS为5个月,中位颅内病灶PFS 6个月,中位OS为13个月,表现出较好的疗效。下一步可进一步扩大替莫唑胺联合全脑放疗的脑转移瘤患者病例数,并进行长期随访,且需要与单纯全脑放疗的病例进行比较,才能更加有效地说明替莫唑胺联合同步全脑放疗对于肺癌脑转移瘤的治疗效果。本研究提示联合治疗能够给患者带来临床获益,可考虑进一步大样本临床研究加以证实。
不良反应方面,本研究中在放化疗同步治疗期间及随后的替莫唑胺辅助治疗期间,不良反应包括胃肠道反应,肝功能损害,血象降低等,但多为Ⅰ~Ⅱ度的轻度不良反应,经对症处理后症状可缓解,未出现严重的神经系统症状。结果提示替莫唑胺联合全脑放疗治疗肺癌脑转移癌不良反应可耐受,有较好的安全性。
综上,鉴于联合治疗良好的耐受性及有效性,可考虑进一步扩大样本进行研究,并在可能的情况下对RPA进行分层分析以进一步证实替莫唑胺对肺癌脑转移瘤患者的作用。替莫唑胺联合全脑放疗治疗脑转移瘤已逐渐广泛应用于临床,改变替莫唑胺给药方式、给药剂量,以及与其他药物联合以进一步提高脑转移患者的生存期,改善生活质量,将会是今后研究的主要方向。
[1] Socinski MA, Langer CJ, Huang JE, et al. Safety of bevacizumab in patients with non-small-cell lung cancer and brain metastases[J]. J Clin Oncol, 2009, 27(31): 5255-5261.
[2] Qin H, Pan F, Li J, et al. Whole brain radiotherapy plus concurrent chemotherapy in non-small cell lung cancer patients with brain metastases: a meta-analysis[J]. PLoS One, 2014, 9(10): e111475.
[3] Gaspar LE, Mehta MP, Patchell RA, et al. The role of whole brain radiation therapy in the management of newly diagnosed brain metastases: a systematic review and evidence-based clinical practice guideline[J]. J Neurooncol, 2010, 96(1): 17-32.
[4] Rudat V, El-Sweilmeen H, Brune-Erber I, et al. Identification of breast cancer patients with a high risk of developing brain metastases: a single-institutional retrospective analysis[J]. BMC Cancer, 2014, 14: 289.
[5] Linz U. Commentary on effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomized phase Ⅲ study: 5-year analysis of the EORTC-NCIC trial[J]. Lancet Oncol, 2009, 10: 459-466.
[6] Mehta MP, Paleologos NA, Mikkelsen T, et al. The role of chemotherapy in the management of newly diagnosed brain metastases: a systematic review and evidence-based clinical practice guideline[J]. J Neurooncol, 2010, 96(1): 71-83.
[7] Cortot AB, Gerinière L, Robinet G, et al. PhaseⅡtrial of temozolomide and cisplatin followed by whole brain radiotherapy in non-small-cell lung cancer patients with brain metastases: a GLOT-GFPC study[J]. Ann Onco1, 2006, 17(9): 1412-1417.
[8] 胡毅,陶海涛.晚期非小细胞肺癌的药物治疗进展[J].中国药物应用与监测,2014,11(6):329-332.
[9] Costa DB, Kobayashi S, Pandya SS, et al. CSF concentration of the anaplastic lymphoma kinase inhibitor crizotinib[J]. J Clin Oncol, 2011, 29(15): e443-e445.
[10] Barazzuol L, Jena R, Burnet NG, et al. Evaluation of poly (ADP-ribose) polymerase inhibitor ABT-888 combined with radiotherapy and temozolomide in glioblastoma[J]. Radiat Oncol, 2013, 8: 65.
[11] Antonadou D, Coliarakis N, Paraskevaidis M, et al. A multiinstitutional trial comparing survival of patients with brain metastases from lung cancer treated with temozolomide plus radio therapy versus radiotherapy alone[J]. Lung Cancer, 2003, 41(Suppl 2): S22-S23.
[12] 廖恺,毕卓菲,何艳,等.全脑放疗联合替莫唑胺治疗非小细胞肺癌脑转移的荟萃分析[J].中华医学杂志,2012,92(45):3199-3203.
Efficacy of temozolomide combined with concurrent whole brain radiotherapy for lung cancer with brain metastases
ZHANG Yu1,2, TAO Hai-tao1,2, WANG Jin-liang1, MA Jun-xun1, DONG Wei-wei1, HU Yi1(1. Medical Oncology DepartmentⅠof PLA General Hospital, Beijing 100853, China; 2. School of Medicine, Nankai University, Tianjin 300100, China)
Objective:To assess the efficacy and safety of temozolomide (TMZ) combined with whole brain radiotherapy in the treatment of lung cancer patients with brain metastases.Methods:A total of 24 lung cancer patients with brain metastases were enrolled in this retrospective study. The whole brain radiotherapy with the total dose of 40 Gy (2 Gy per time, 5 times per week) was given to all the patients, and another 10 – 20 Gy of intensity-modulated boosting therapy for local lesion was given if necessary. All patients took temozolomide (75 mg·m-2) concurrently during the whole course of radiotherapy. Temozolomide should be stopped, if the patient can not tolerate adverse reactions. After radiotherapy, the patients received systematical chemotherapy or continued TMZ therapy (150 – 200 mg·m-2·d-1, 5/28 d) for additional 0 – 6 cycles according to the condition of the patients. The efficacy and adverse reactions were evaluated statistically.Results:All the patients finished the radiotherapy combined with concurrent TMZ. Afterwards, 10 patients received systematical chemotherapy, 7 patients received the best supportive treatment, 3 patients received additional 4 cycles of TMZ adjuvant therapy, and 3 patients continued 6 cycles of TMZ chemotherapy. After radiotherapy and chemotherapy, 2 patients had complete response, 7 patients had partial response, 12 patients had stable disease, while the other 3 patients had progressed disease by evaluation of intracranial lesion. Therefore, the total effective rate achieved 37.5%, the disease control rate obtained 87.5%, the median PFS was 5 months, the median intracranial lesions PFS was 6 months. Acute side-effects were developed in 18 patients. GradeⅢorⅣhematologic toxicities were developed in 3 patients (12.5%), but gradeⅢ–Ⅳnonhematologic side-effects were developed in 4 patients (16.7%).Conclusion:Temozolomide was well tolerant, and showed significant improvements in response rate when combined with whole brain radiotherapy in lung cancer with brain metastases. While, the benefit of long-term survival needs to be verified by further clinical studies.
Temozolomide; Whole brain radiotherapy; Brain metastases; Lung cancer
R969.4
A
1672 – 8157(2015)03 – 0133 – 04
2014-12-10
2015-03-10)
[基金课题] 军队保健专项课题(14BJZ04)
胡毅,男,主任医师,教授,研究方向为肺部肿瘤综合治疗。E-mail:huyi0401@aliyun.com
张渝,女,肿瘤学硕士研究生,研究方向:肺癌的靶向治疗。E-mail:nkdxzy@163.com
