正交实验法优化姜黄中姜黄素提取工艺及其抗氧化活性*
2015-01-05周美陈华国周欣龚小见
周美,陈华国,周欣,龚小见
正交实验法优化姜黄中姜黄素提取工艺及其抗氧化活性*
周美1,2,陈华国1,2,周欣1,2,龚小见1,2
(1.贵州省山地环境信息系统与生态环境保护重点实验室,贵阳 550001;2.贵州师范大学天然药物质量控制研究中心,贵阳 550001)
目的 研究姜黄中姜黄素类化合物最佳提取工艺及其抗氧化活性。方法 采用正交实验法,对乙醇提取姜黄中姜黄素的工艺条件进行优化,对乙醇浓度、溶剂用量、提取温度、提取时间等进行考察,采用高效液相色谱(HPLC)法比较不同因素对姜黄素化合物含量变化的影响;以姜黄素类化合物含量及姜黄提取物抗氧化活性为综合考察指标,用DPPH清除自由基实验评价其抗氧化活性。结果 最佳工艺参数为乙醇浓度60 %,乙醇用量20倍,回流2 h,提取温度90 ℃,姜黄素类化合物提取率为3.56%,姜黄提取物对DPPH自由基的清除率为79.79%。结论 该工艺操作简便、稳定可靠,在此条件下获得的姜黄提取物具有良好的抗氧化活性。
姜黄素;DPPH法;提取工艺;抗氧化活性
姜黄(Curcumin)为姜科植物姜黄(CurcumalongaL.)的根茎,具有利胆、通经止痛、行气破瘀、除湿通络等功效[1]。姜黄药材中主要含有姜黄素类、挥发油类、糖类及甾醇类等化学成分。其中姜黄素类化合物主要包括醇溶性二苯基庚烃类化合物姜黄素(JⅠ)、脱甲氧基姜黄素(JⅡ)和双脱甲氧基姜黄素(JⅢ)。同时,姜黄素是一种理想的天然色素[2-3],从姜黄中提取姜黄素类化合物是目前的研究热点之一。通过查阅文献发现,目前对姜黄中姜黄素类化合物提取工艺研究报道较多[4-8]。这些研究为合理提取姜黄素类化合物提供了一定科技支撑,但是,这些提取工艺大多采用姜黄素类化合物含量为指标,阐述其化学特征信息,而利用化学和药效学结合的手段进行姜黄素类化合物提取工艺研究笔者尚未见报道。因此,笔者拟以姜黄素类化合物含量以及姜黄提取物抗氧化活性为综合考察指标,采用正交实验法对影响提取工艺的主要影响因素进行研究,以期获得能够同时兼顾化学和药效学指标的工艺参数,为姜黄药材的深度开发利用提供一定科学基础,同时,也为其他天然药物活性成分的提取提供科学参考。
1 仪器与试药
1.1 仪器 Dionex Ultimate 3000型高效液相色谱仪(包括四元泵,在线脱气机,自动进样器,二极管阵列检测器,柱温箱);Spectra Max Plus 384 型酶标仪(美国Molecular Devices公司);AL204电子分析天平(梅特勒-托利多集团,感量:0.1 mg);DFY-200高速万能粉碎机(温岭市林大机械有限公司);DZF-6020真空干燥箱(杭州蓝天化验仪器厂);电热恒温水浴锅(天津市泰斯特仪器有限公司);KQ5200E超声波清洗器(昆山市超声仪器有限公司);101-2AB电热鼓风干燥箱(天津市泰斯特仪器有限公司);EM-202MS1微波真空干燥机(合肥荣事达三洋电器股份有限责任公司)。
2 方法与结果
2.1 姜黄素含量测定
2.1.1 色谱条件 色谱柱为Hypersil ODS2柱(250 mm×4.6 mm,5 μm);流动相:乙腈-0.5%醋酸溶液(44:56);检测波长425 nm;柱温35 ℃;进样量10 μL;流速1.0 mL·min-1[9],色谱图见图1。
2.1.2 供试品溶液制备 精密称取姜黄提取物的浸膏粉末0.1 g,置于50 mL量瓶,用乙醇溶解并定容,摇匀,过内径0.45 μm微孔滤膜,取续滤液,即得。
2.2 姜黄提取物抗氧化活性实验
2.2.1 DPPH样品溶液制备 取DPPH对照品粉末400 mg,精密称定,用乙醇配制成0.2 mmol·L-1的溶液。
2.2.2 供试品溶液制备 精密称取姜黄提取物的浸膏粉末0.1 g,置于50 mL量瓶,用乙醇溶解并定容,稀释为400,200,100,50,25 μg·mL-1等5个梯度的溶液,摇匀,即得。
2.2.3 测定方法 分别精密吸取上述系列梯度浓度的溶液各2 mL至5 mL试管中,再分别精密加入DPPH溶液2 mL,混合均匀,于25 ℃条件下避光保存40 min后,用酶标仪在波长517 nm处测定其吸光度(Ai),同时分别测定样品溶液2 mL+无水乙醇2 mL的吸光度(Aj),无水乙醇2 mL+DPPH溶液2 mL吸光度(A0),按下式计算对自由基的清除率,清除率(%)=[1-(Ai-Aj)/A0]×100%。

1.双脱甲氧基姜黄素;2.脱甲氧基姜黄素;3.姜黄素
图1 对照品(A)与姜黄乙醇提取物(B)的HPLC 图
1.bisdemethoxycurcumin;2.demethoxycurcumin;3.curcumin
Fig.1 HPLC chromatograms of the reference substances (A) and ethanol extraction ofCurcumalongaL.(B)
2.3 提取工艺优化
试验驴采用大栏饲养,运动场自由活动,每天饲喂4次,饲喂时间分别为07:00、11:00、17:00、22:00,由专人负责饲养与管理,全天自由饮水。期间注意观察驴的采食规律、行为表现和健康。
2.3.1 综合评分的计算 采用面积归一化法对姜黄素含量及姜黄提取物抗氧化活性进行处理,综合评分=总含量/最大总含量×0.3+抗氧化活性/最大抗氧化活性×0.7。
2.3.2 单因素实验
2.3.2.1 乙醇浓度的考察 精密称取姜黄药材粉末(过内径0.425 mm筛)10 g,置具塞锥形瓶中,分别精密加入40%,50%,60%,70%,80%浓度的乙醇溶液150 mL,在80 ℃条件下回流提取2 h,冷却,滤过,滤液蒸干,残渣减压干燥至恒重。并按“2.1”和“2.2”项下条件对浸膏进行测定。结果40%,50%,60%,70%,80%乙醇提取综合评分分别为0.481,0.781,0.966,0.958,0.851。实验结果表明,以60%乙醇提取时综合评分最大,故优选60%乙醇作为提取溶剂。
2.3.2.2 溶剂用量的考察 精密称取姜黄药材粉末(过内径0.425 mm筛)10 g,置具塞锥形瓶中,分别加入10,15,20,25 倍量60%乙醇溶液,在80 ℃条件下回流提取,冷却,滤过,滤液蒸干,残渣减压干燥至恒重。并按“2.1”和“2.2”项下条件对浸膏进行测定。结果10,15,20,25 倍量60%乙醇溶液提取综合评分分别为0.893,0.930,0.958,0.948。从实验结果可知,溶剂倍量至15倍以后,随着溶剂倍量增加,对综合评分影响不大,出于节约溶剂、降低成本的角度考虑,选择15 倍量的溶剂体积为最优溶剂用量。
2.3.2.3 提取温度的考察 精密称取姜黄药材粉末(过内径0.425 mm筛)10 g,置具塞锥形瓶中,加入60%乙醇溶液150 mL,分别于70,80,90 ℃下进行提取,冷却,滤过,滤液蒸干,残渣减压干燥至恒重。并按“2.1”和“2.2”项下条件对浸膏进行测定,结果70,80,90 ℃时提取综合评分分别为0.831,0.957,0.933。从实验结果可知,温度为80 ℃时,综合评分最大,故选取80 ℃为最优提取温度。
2.3.2.4 提取时间的考察 精密称取姜黄药材粉末(过内径0.425 mm筛)10 g,置具塞锥形瓶中,加入60%乙醇溶液150 mL,分别在80 ℃条件下回流提取1,2,3 h,冷却,滤过,滤液蒸干,残渣减压干燥至恒重。并按“2.1”和“2.2”项下条件对浸膏进行测定,结果回流提取1,2,3 h的综合评分分别为0.946,0.983,0.836。从实验结果可知,提取时间2 h效果优于1 h,但随着时间的延长,综合评分有下降的趋势,故选取2 h为最优提取时间。
2.3.2.5 提取次数的考察 精密称取姜黄药材粉末(过内径0.425 mm筛)10 g,置具塞锥形瓶中,加入60%乙醇溶液150 mL,在80 ℃条件下回流提取2 h,分别提取1,2,3 次,冷却,滤过,滤液蒸干,残渣减压干燥至恒
重。并按“2.1”和“2.2”项下条件对浸膏进行测定,结果提取1,2,3 次的综合评分分别为0.983,0.988,1.000。结果显示,提取次数对提取工艺综合评分的影响不大,从方便、省时、节能等方面考虑,优选提取1 次。
2.3.3 正交实验设计 根据单因素考查结果,本实验以乙醇浓度(A)、溶剂用量(B)、提取温度(C)和提取时间(D)为考察因素,每个因素3 个水平,以综合评分为考查指标,进行L9(34)正交实验,提取次数为1次,每次实验平行3份,筛选最佳工艺条件,因素水平见表1,正交实验结果见表2。
表1 L9(34)正交实验设计因素水平
Tab.1 Factors and levels for orthogonal test L9(34)

水平乙醇浓度(A)/%溶剂用量(B)/倍提取温度(C)/℃提取时间(D)/h150107012601580237020903
2.3.4 正交实验结果与分析 通过直观分析,影响因素的主次为:乙醇浓度>提取温度>溶剂用量>提取时间,最佳提取条件为:A2B2C3D1,即乙醇浓度为60%,溶剂用量为20倍,提取温度为90 ℃,提取时间为1 h,且提取次数为一次。为验证直观分析结果,对正交实验结果进行方差分析,见表3,结果表明,乙醇浓度对提取工艺有显著性影响,与直观分析结果相符。

表2 L9(34)正交实验结果Tab.2 Results for the orthogonal text L9(34)
A.乙醇浓度;B 溶剂用量;C.提取温度;D.提取时间;JⅠ.姜黄素; JⅡ.脱甲氧基姜黄素; JⅢ.双脱甲氧基姜黄素
A.ethanol concentration;B.solvent volume;C.extraction temperature;D.extraction time;curcumin (JⅠ),demethoxycurcumin (JⅡ);bisdemethoxycurcumin (JⅢ)

表3 方差分析结果Tab.3 Results of variance analysis
A.乙醇浓度;B 溶剂用量;C.提取温度;D.提取时间;F0.05(2,2)=19.00
A.ethanol concentration;B.solvent volume;C.extraction temperature D.extraction time ;F0.05(2,2)=19.00
2.3.5 优化工艺的验证 由于优选的工艺未包含在正交设计表的9 次实验中,故对其进行验证实验,结果见表 4。用同一批药材,按条件A2B2C3D1进行3次重复实验,综合评分的RSD值为0.5%,表明该工艺重复性好。
表4 优化工艺条件的验证结果
Tab.4 Verification results of optimum process
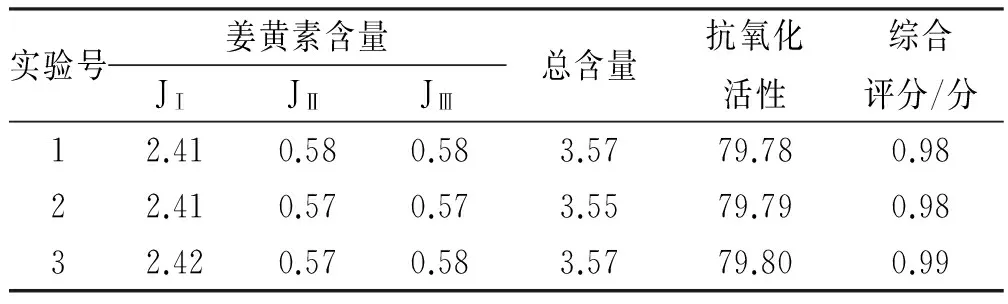
%
JⅠ.姜黄素; JⅡ. 脱甲氧基姜黄素; JⅢ.双脱甲氧基姜黄素
curcumin (JⅠ);demethoxycurcumin (JⅡ);bisdemethoxycurcumin (JⅢ)
3 讨论
现代药理学研究表明,自由基是引起多种疾病和老化的诱因,如癌症、心血管疾病等[10-13],因此,抗氧化剂的研究越来越受到高度的重视。本研究以姜黄素类化合物含量以及姜黄提取物抗氧化活性为综合考察指标,在单因素实验的基础上,选取乙醇浓度、料液比、提取温度、提取时间进行正交实验,通过正交实验优化,确定姜黄最佳提取工艺为乙醇浓度60%,料液比为1:20,提取温度为90 ℃,提取时间1 h。在此条件下姜黄素类化合物提取率为3.56%,姜黄提取物对DPPH自由基的清除率为79.79%,表明在该工艺条件下姜黄素类化合物具有较高的提取率、姜黄提取物具有较强
的抗氧化活性。但从正交实验可知,姜黄素含量与抗氧化活性并非呈绝对线性关系,但整体上呈正相关,其作用机制有待深入研究。本实验优化的工艺简便、重复性好,能为姜黄药材的综合开发利用奠定实验基础。
[1] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:247-248.
[2] 蔡少鑫,陈成,杨熹,等.姜黄素调控乳腺癌细胞增殖与转移机制研究[J].医药导报,2013,32(5):561-564.
[3] SHISHODIA S,CHATURVEDI M M,AGGARWAL B B.Role of curcumin in cancer therapy[J].Curr Probl Cancer,2007,31(3):243-305.
[4] 罗廷顺,李洪文,刘正文,等.姜黄素的提取分离与药理作用研究进展[J].现代药物与临床,2011,26(2):102-107.
[5] 卢德赵,林韬琦,沃兴德,等.RAW 264.7细胞中姜黄素抗动脉粥样硬化作用机制的蛋白质组学研究[J].中国中药杂志,2011,36(9):1207-1211.
[6] 关延彬,邱玉红,袁昕,等.姜黄素自微乳化释药系统的制备与评价[J].医药导报,2013,32(6):773-777.
[7] 郭立达,焦振霞,宋瑛,等.姜黄素诱导结肠癌LoVo细胞凋亡的作用及机制研究[J].中国中药杂志,2013,38(13):2191-2196.
[8] 冯慧利,李瑞晟,王虹,等.姜黄素对APP/PS1 双转基因小鼠海马IRS-1 和p-IRS-1 表达的影响[J].中国中药杂志,2013,38(9):1290-1296.
[9] 李明,周欣,赵超,等.HPLC同时测定姜黄中3 种姜黄素的含量[J].药物分析杂志,2008,28(11):1810-1814.
[10] SAGIROGLU T,KANTER M.Protective effect of curcumin on cyclosporine A-induced endothelial dysfunction,antioxidant capacity,and oxidative damage[J].Toxicol Ind Health,2014,30(4):316-327.
[11] 陈骁,林以诺,方丹红,等.姜黄素对动脉粥样硬化家兔血管内皮功能的影响[J].中国中药杂志,2003,38(19):3343-3347.
[12] CHEN A,XU J,JOHNSON A C.Curcumin inhibits human colon cancer cell growth by suppressing gene expression of epidermal growth factor receptor through reducing the activity of the transcription factor Egr-1[J].Oncogene,2006,25(2):278-287.
[13] 王雪梅,张建胜,高云涛,等.姜黄素体外清除活性氧自由基及抗氧化作用研究[J].食品工业科技,2008,29(7):94-951.
Optimized Extraction of Curcuminoids from Curcuma Longa L.by Orthogonal Designed Method and Its Antioxidant Activity
ZHOU Mei1,2, CHEN Huaguo1,2, ZHOU Xin1,2, GONG Xiaojian1,2
(1.KeyLaboratoryforInformationSystemofMountainousAreasandProtectionofEcologicalEnvironment,GuizhouProvince,Guiyang550001,China;2.TheResearchCenterforQualityControlofNaturalMedicine,GuizhouNormalUniversity,Guiyang550001,China)
Objective To investigate the optimal extraction technique and antioxidant activity of curcuminoids fromCurcumalongaL. Methods The optimized extraction process of curcuminoids fromCurcumalongaL.with ethanol as extracting solvent were studied based on orthogonal test.The effect of each factor such as the ethanol concentration, the amount of solvent, extraction temperature and extraction time were investigated based on a single-factor experiment.The effects of extraction yield of curcuminoids under different processing conditions were compared by HPLC method.Content of curcuminoids and antioxidant activity of the extract were used as comprehensive survey index. Free radical scavenging DPPH method was used to assess the antioxidant effect.And the extraction technique parameters were optimized. Results The condition of optimal extraction technique was: ethanol concentration 60%, amount of solvent 20 folds, extraction time 2 h, extraction temperature 90 ℃. Under these conditions, the extraction yield of curcuminoids was 3.65%.DPPH free radical scavenging yield of the curcumin extract was 79.9%. Conclusion This optimized technology is simple and have a good reappearing rate, and the extracts ofCurcumalongaL.show good antioxidant activity.
Curcuminoids;DPPH radical assay;Orthogonal array design;Antioxidant activity
2014-07-08
2014-10-10
*贵阳市科技计划项目(筑科合同[2012203]2-15);贵州省教育厅特色重点实验室项目(黔科合KY[2012]005);贵州省药物质量控制及评价技术工程实验室项目(黔发改高技[2013]2068号);贵州省中药材现代产业技术体系建设专项 (GZCYTX-02)。
周美(1987-),女,贵州毕节人,硕士,研究方向:中药质量控制。电话:0851-6700414,E-mail:zm19860523@163.com。
周欣(1962-),女,贵州贵阳人,教授,博士,研究方向:中药、民族药质量控制,中药指纹图谱以及中药新药研发。电话:0851-6700494,E-mail:alice9800@sina.com。
R284.2
B
1004-0781(2015)10-1352-04
10.3870/j.issn.1004-0781.2015.10.024
