7周不同强度耐力运动对大鼠骨骼肌线粒体相关信号PGC-1α、UCP3和COXⅣ表达的影响*
2015-01-05陈淑妆张国华李素萍曾凡星
陈淑妆,张国华,李素萍,曾凡星
(1.韩山师范学院体育学院,广东潮州 521041;2.北京体育大学运动生理教研室,北京 100084)
已知耐力或抗阻运动导致骨骼肌各种生理和生化适应,包括线粒体生物合成、血管生成、肌纤维类型改变等[17,22]。不同强度、时间及耐力运动方式对线粒体的影响不尽相同。小或中等强度耐力运动增加线粒体含量,改善其功能,这涉及多种生物分子,包括过氧化物酶体增殖物激活受体γ辅激活因子(peroxisomeproliferatorsγactivatedreceptorcoativator - 1α,PGC -1α)、核呼吸因子 1(nuclearrespiratoryfactor1,NRF1)、解耦联蛋白3(Uncouplingprotein3,UCP3)细胞色素 c氧化酶Ⅳ(CytochromecoxidaseⅣ,COXⅣ)和柠檬酸合成酶(citratesynthase,CS)等[13,14,19]。然而,过量或强度过大的运动造成线粒体损伤,如体积增加、嵴疏或断裂、基质电子密度降低,提示组织已严重缺氧;如果继续训练,组织缺氧进一步加重,线粒体将破裂、溶解到不能恢复的程度[1,2,5]。但这些结论主要基于形态学的观察,细胞内反映线粒体功能和生物合成的信号分子有否变化,如何变化,目前并不清楚。从分子生物学角度研究大强度运动对线粒体生物合成和氧化功能的伤害,特别是能否从中找到早期预警信号,这有助于认识过度运动损伤线粒体的分子生物学原理,也可为训练提供科学的理论依据。
1 研究方法
1.1 实验对象及分组
雄性SPF级7周龄SD大鼠42只,体重220~240g,北京维通利华实验动物中心提供,北京体育大学实验动物房饲养。动物自由饮食和给水,环境温度23℃ ~25℃,相对湿度40% ~60%,光照12h/d。适应性训练后,实验动物根据运动强度分为安静组(C)、中等强度运动组(M)和大强度运动组(H)。其中后两组选取运动后即刻、6h、24h作为取材时间点,共7个小组,每小组6只动物。动物体重组间无显著性差异(P>0.05),见表1。
1.2 运动方案
正式运动前,动物进行4天跑台适应性训练,休息3天。4天适应性训练方案为:强度按10-15-20-26m/min递增,时间按15-15-20-20min递增。
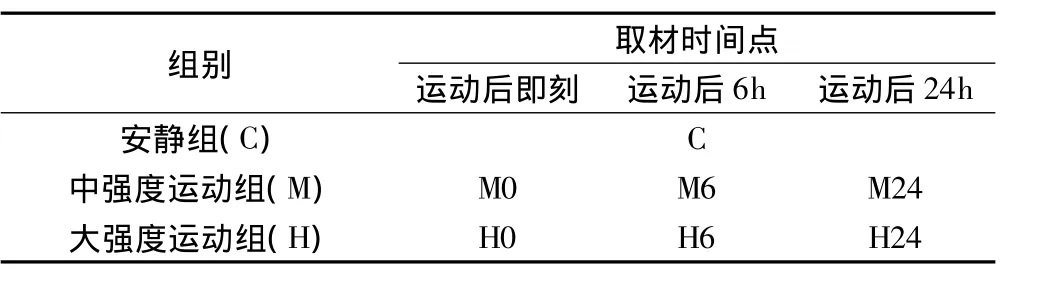
表1 实验动物分组
正式运动方案参考 Bedford[7]、Wisloff[20]的递增负荷跑台训练,共进行7周。其中,运动组(包括M组和H组)以15m/min,15min的运动负荷起始,以后每隔2d速度增加5m/min,时间增加 5min,至 M 组达 28m/min,60min;H 组达 38m/min,60min时,各组维持上述负荷训练至7周结束。每周训练5d,休息2d。
1.3 测试样本的采集与处理
运动组动物分别在运动后即刻、6h和24h,快速称量体重,按5mL/kg体重剂量腹腔注射20%乌拉坦麻醉后,速取右后肢比目鱼肌约0.2g。锡纸包装迅速投入-80℃度保存备用。C组以同样的麻醉剂量和取材方法操作。
1.4 指标测试方法
1.4.1 主要试剂和仪器
p-AMPKα兔单抗购自CST,SIRT1兔单抗购自Epitomics,UCP3兔多抗购自 Santa。超纯 RNA提取试剂盒、HiFi-MMLVcDNA第一链合成试剂盒、UltraSYBRMixture、DNase1购自CWbio。
1.4.2 荧光定量 PCR 检测 SIRT1、PGC -1α、NRF1、COXIV、CS的基因转录
1.4.2.1 骨骼肌RNA的提取、电泳和消化
取骨骼肌样品100mg左右,抽提RNA后,进行凝胶电泳,然后对RNA中残留的基因组DNA进行消化处理,实验操作按说明书进行。
1.4.2.2 逆转录反应
用HiFi-MMLVcDNA第一链合成试剂盒进行反转录,实验步骤按说明书进行,反应结束后的cDNA放置-20℃保存。
1.4.2.3 扩增引物

表2 扩增引物名称、序列和大小
1.4.2.4 荧光定量PCR
操作过程如下:(1)反应体系:用UltraSYBRMixture(With-ROX)进行扩增,上游引物(10uM):0.4μl,下游引物(10uM):0.4μl,模板:2μl。(2)建立筛选引物标准曲线:对模板进行 5倍梯度稀释后,样品各取2ul进行扩增,同时进行融解曲线分析,并绘制目的基因和内参基因的标准曲线。(3)样品RTPCR分析:将各样品稀释后分别用目的基因引物和内参基因引物进行扩增,同时进行溶解曲线分析。反应结束后,PCR仪给出各反应孔的Ct值,以β-actin基因为内参,根据公式2-△△CT计算各样品目的基因的相对表达量。
1.4.3 Westernblot测定骨骼肌P-AMPKThr172、SIRT1和线粒体UCP3的蛋白表达
骨骼肌蛋白的抽提:预冷RIPA蛋白抽提试剂中加入蛋白酶抑制剂(磷酸化蛋白需要同时加入磷酸酶抑制剂),抽提前加入0.1MPMSF母液,以重量:裂解液体积=1:9比例加入裂解液,电动匀浆完成后,在冰上孵育20min,4度离心,13000rpm,20min。离心完成后取上清,分装保存,待测。
WesternBlot实验流程:(1)蛋白电泳。根据目的蛋白的分子量,配制12%分离胶,待检测蛋白样品上样量:20ug/孔。(2)湿转法。转膜条件:300mA恒流;0.45um孔径NC膜,转膜时间1h。转膜完成后丽春红染色试剂对膜进行染色,观察转膜效果。(3)封闭。将膜完全浸没3%BSA-TBST中室温轻摇30min。(4)一抗孵育。用3%BSA-TBST稀释,室温孵育10min,放4℃过夜。第二天从4℃拿出,在室温孵育30min。(5)二抗孵育。用5%脱脂奶粉-TBST稀释后,山羊抗兔IgG(H+L)HRP1:20000,室温轻摇40min。TBST洗膜6次,每次3min。(6)图像处理。ECL加到膜上后反应3min~5min,胶片曝光10s~5min,显影2min,定影并拍照,用天能GIS凝胶图像处理系统进行数据分析。以待测蛋白与内参蛋白的平均密度之比作为待测蛋白的相对表达水平。
1.5 数据统计方法
实验数据统计处理应用SPSS17.0软件,图像生成使用sigmaPlot11.0软件。计量资料用均数±标准差(X±SD)表示。不同强度运动及不同时间点与C组的均数比较以及大强度组与中等强度组的均数比较均采用T检验。以P<0.05表示具有显著性差异,P<0.01表示具有非常显著性差异。
2 结果
2.1 骨骼肌UCP3蛋白表达的变化
和C相比,UCP3蛋白表达在中等强度运动三个检测时间点分别上升到111%、149%(P<0.05)、121%,大强度运动则分别下降为87%、33%(P<0.01)、81%。和中等强度组相比,大强度运动后各时间点均出现显著下降,其中运动后即刻和24h具有显著性(P<0.05),运动后6h具有非常显著性(P<0.01)。

图1 UCP3蛋白表达电泳图及相对变化
2.2 骨骼肌PGC-1α基因表达的变化
和C相比,PGC-1αmRNA表达在中等强度运动三个检测时间点分别上升到362%(P<0.05)、657%(P<0.05)、116%,大强度运动分别为274%(P<0.01)、130%(P<0.05)、68%(P<0.05);和中等强度组相比,大强度运动后各时间点均有非常显著性下降(P<0.01)。

图2 PGC-1α实时扩增曲线及mRNA表达相对变化
2.3 骨骼肌NRF1基因表达的变化
和C相比,NRF1mRNA表达在中等强度运动三个检测时间点分别上升到1071%、429%、199%(三者均P<0.01),大强度运动分别为235%(P<0.01)、362%(P<0.01)、85%;和中等强度组相比,大强度运动后各时间点均出现显著下降,其中运动后即刻和24h具有非常显著性(P<0.01),运动后6h具有显著性(P<0.05)。
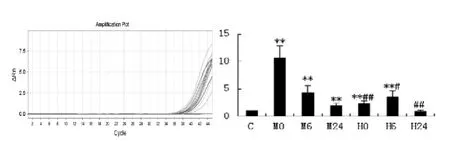
图3 NRF1实时扩增曲线及mRNA表达相对变化
2.4 骨骼肌COXⅣ基因表达的变化
和C相比,COXⅣmRNA表达在中等强度运动三个检测时间点分别上升到223%(P<0.01)、410%(P<0.01)、124%,大强度运动分别下降为29%(P<0.01)、60%(P<0.05)、55%(P<0.05);和中等强度组相比,大强度运动后各时间点均有非常显著性下降(P<0.01)。

图4 COXⅣ实时扩增曲线及mRNA表达相对变化
2.5 骨骼肌CS基因表达的变化
和C相比,CSmRNA表达在中等强度运动三个检测时间点分别上升到839%、210%、203%(三者均P<0.01),大强度运动分别为289%(P<0.01)、162%(P<0.05)、78%;和中等强度组相比,大强度运动后各时间点均出现显著下降,其中运动后即刻和24h具有非常显著性(P<0.01),运动后6h具有显著性(P<0.0)。

图5 CS实时扩增曲线及mRNA表达相对变化
3 讨论
本实验采用7周中等和大强度两种耐力训练方案。长期大强度耐力运动或力竭性运动损伤线粒体已从形态学上得到了证实:刘小红等在对大鼠脊髓前角细胞线粒体超微结构的研究。
中发现,大强度运动组出现线粒体嵴断裂、空泡变,甚至裂解现象[2];徐冬青等发现力竭性运动后,骨骼肌纤维膜通透性增高,肌原纤维降解,线粒体肿大,Z线异常,以运动后24h~48h最为严重[5];刘丽萍等在对力竭大鼠的肝组织线粒体研究中也见到线粒体数量减少,嵴膜有融解现象[1];苏全生等亦发现,大强度运动可造成大鼠心肌线粒体损伤,以运动后12h损伤最为严重[3]。王震、林文弢等发现,8周不同负荷抗阻训练对衰老动物线粒体功能的改善效果不同,中小负荷有改善作用,而大负荷则没有[4]。然而,过度运动损伤线粒体过程中,对骨骼肌细胞调控线粒体生物合成和氧化功能的相关生物分子和氧化酶的研究还极少见到。
3.1 不同强度运动对骨骼肌PGC-1α及相关信号分子UCP3和NRF1的影响
PGC-1α是一种多功能转录共激活因子,为线粒体生成的标志物[12]。研究表明,PGC-1α可显著诱导NRFs和 UCPs基因的表达,增加线粒体DNA数量及其复制程度,从而促进线粒体的生物合成[21]。本研究发现,中等强度运动后即刻和6h,PGC-1αmRNA表达分别增加到安静水平的3.62和6.57倍,24h时基本恢复。表明中等强度运动显著促进骨骼肌PGC-1αmRNA表达和线粒体生成。大强度运动后即刻和6h、24h,PGC-1αmRNA表达分别为安静时的2.74、1.3和0.68倍,可以看出短时间内虽然PGC-1αmRNA表达虽有增加,但明显低于中等强度的增幅,且随着恢复时间的延长,PGC-1αmRNA表达逐渐下降,24h时已显著低于安静水平,表明大强度运动显著抑制了安静时骨骼肌PGC-1αmRNA表达,这可能是线粒体生物合成受损的重要证据。
Suwa等曾报道[18],在14天耐力训练中,无论是低强度组(20m/min,90min)还是高强度组(30m/min,60min)大鼠比目鱼肌PGC-1α表达均增加,这和本研究结论有所不同,分析原因可能一是因为Suwa采用的训练时间较短,还不足以造成骨骼肌PGC-1α信号受损,二是因为其采用的大强度运动的强度低于我们的实验方案。对此还需要进一步研究。
我们同时也发现,伴随着大强度运动后PGC-1αmRNA表达下降,骨骼肌线粒体UCP3蛋白含量也出现下降,其中运动后6h降为安静水平的33%(P<0.01),至24h仍未恢复到安静水平。然而,PGC-1α另一下游信号NRF1mRNA表达并未同时出现下降,但与中等强度运动相比,其增加幅度显著降低。UCP3主要表达于骨骼肌[6,10],是线粒体内膜上的一种具有调节质子跨膜作用的特殊蛋白质。骨骼肌中UCP3表达可能与线粒体的调控物PGC-1α有关[8]。研究发现,运动等因素诱导UCP3表达增加或抑制均与PGC-1α密切相关[11]。长期暴露于高原地区后回到平原地区的受试者线粒体密度下降21%,同时伴随PGC-1α和UCP3水平同步下降[9]。Leslie等在对糖尿病和肥胖大鼠进行中等强度运动干预的研究中,发现运动降低线粒体生成和抗氧化反应恶化的程度,其机制也涉及UCP3和PGC-1α表达同步增加[16]。我们的研究也证实了二者关系的密切性,但在变化时程上并不完全一致。
3.2 不同强度运动对骨骼肌COXⅣ和CS酶的影响
我们还研究了反映线粒体氧化呼吸功能的两种生物酶COXⅣ和CS的变化。结果发现,大强度运动后即刻、6h和24h,COXⅣmRNA表达分别为安静时水平的29%、60%和55%,均出现显著下降;CSmRNA表达虽然未出现下降,但与中等强度运动相比,增加幅度有显著降低。COXⅣ是线粒体呼吸链的终端酶,位于线粒体内膜上,是呼吸链中唯一能够直接与氧作用的复合物。有研究发现,COXⅣ活性减弱伴随着ROS的产生增加[15]。所以我们认为,大强度运动导致COXⅣ表达下降,是线粒体氧化功能损伤的直接证据,其原因可能与ROS大量生成有关。双因素方差分析表明,运动强度可能不是影响CS表达的主要因素,但要注意取样时间对其的影响。
3.3 运动强度和取样时间对骨骼肌线粒体调控信号分子的影响
本试验方案设计采用7周中等和大强度两种运动强度和运动后即刻、6h和24h三个取样观测点。双因素方差分析表明,运动强度对骨骼肌UCP3蛋白和PGC-1α、NRF1、COXⅣ基因表达均有显著性影响,但对CS酶基因表达影响不明显;取样时间点对骨骼肌PGC-1α、NRF1、COXⅣ、CS基因表达均有显著性影响,但对UCP3蛋白表达影响不明显。同时,运动强度和取样时间点之间无交互影响。以上说明在骨骼肌线粒体调控相关信号的研究中,在考虑运动强度影响的同时,也要考虑取样时间点的影响。其中,UCP3蛋白表达在大强度运动后即刻并未下降,但运动后6h有显著下降;而PGC-1α在大强度运动后下降的时间更晚,在运动后24h。所以观测时间点的不同可能会引出不同的结论。
4 结论
通过以上对实验结果的分析,可得出如下结论:(1)7周中等强度耐力运动增加骨骼肌线粒体生物合成;(2)7周大强度耐力运动使骨骼肌PGC-1α、COXⅣmRNA和UCP3蛋白表达出现下降,其中尤以COXⅣ和UCP3下降明显,这可能是骨骼肌线粒体生成受损的信号。
[1]刘丽萍,柴戟臣,唐卫平,等.游泳训练对大鼠肝组织自由基代谢及肝脏超微结构的影响[J].中国运动医学杂志,1998,17(2):121 -123
[2]刘小红,包修风,冯慎远.不同强度训练后大鼠脊髓前角细胞线粒体的定量研究[J].中国运动医学杂志,2002,21(4):386-388
[3]苏全生,段意梅,李顺昌,等.大强度运动对大鼠心肌线粒体膜通透性转换孔状态的影响.体育科学,2007,27(11):48-54
[4]王震,林文弢,翁锡全,等.抗阻训练对老龄大鼠腓肠肌Ca2+及线粒体膜电位的影响[J].广州体育学院学报,2014,34(2):85 -88
[5]徐冬青,陈家琦,李静先.力竭运动对大鼠骨骼肌自由基代谢及肌细胞膜通透性的影响[J].天津体育学院学报,1999,14(3):27 -30
[6]sAffourtitC.Noveluncouplingproteins.NovartisFoundSymp,2007,287(1):70-91
[7]BedfordTG.,TiptonCM,WilsonNC,etal.Maximumoxygenconsu mptionofratsanditschangeswithvariousex-perimentalprocedures[J].JApplPhysiol,1979,47:(6)1278 -1283
[8]BuggeA,SiersbaekM,MadsenMS,etal.Anovelintronicperoxiso meproliferator-activatedreceptorgammaenhancerintheuncoupli ngprotein(UCP)3geneasaregulatorofbothUCP2and-3expres sioninadipocytes[J].JBiolChem,2010,285(23):17310 -17317
[ 9 ] DennyZ.Levett, ElizabethJ.Radford, DavidA.et,al.cclimatizationofskeletalmusclemitochondriatohigh-altitudehypoxiaduringanascentofEverest.FASEBJ,2012,26(4):1431-1441
[10]El- MeccawiS,KamM,BroshA,etal.Energyintake,heatproductionandenergyandnitrogenbalancesofsheepandgoatsfedwheats trawasasolediet.LivestockSci,2009,125:88 – 91
[11]ErikaKoltai,NikolettHart,AlbertW.Taylor,et,al.Age - associateddeclinesinmitochondrialbiogenesisandproteinqualitycontro lfactorsareminimizedbyexercisetraining.AmJPhysiolRegulatory IntegrativeCompPhysiol,2012,303(2):127 -134
[12]FujimotoE,YamaguchiW,TeradaS,etal.ChangeinPGC -1αExpressioninRatSkeletalMuscleafterLow - intensityProlongedSwimmingExercise[J].JournalofPhysiologicalAnthrop ology,2011,30(1):23 -27
[13] GiuliaUguccioniandDavidA.Hood.TheimportanceofPGC -1incontractileactivity-inducedmitochondrialadaptation.AmJ PhysiolEndocrinolMetab,Feb,2011,300(2):361 -371
[14] JonathanD.Bartlett,ChangHwaJoo,Tae - SeokJeong,etal.Matchedworkhigh-intensityintervalandcontinuousrunning inducesimilarincreasesinPGC - 1αmRNA,AMPK,p38,andp53phosphorylationinhumanskeletalmuscle.WarrenGAppl Physiol,2012,112(7):1135 -1143
[15]LeadshamJE,SandersG,GiannakiS,etal.Lossofcytochromeco xidasepromotesRAS-dependentROSproductionfromtheERresid entNADPHoxidaseyno1pinyeast[J].CellMetab,2013,18(2):279-286
[16]LeslieAKnaub,SylviaMcCune,AdamJChicco,et,al.Impaired responsetoexerciseinterventioninthevasculatureinmetabolicsynd rome.DiabetesandVascularDiseaseResearch,2013,10(3):222-238
[17]LiWang,HenrikMascher,NiklasPsilander,etal.Resistanceexer ciseenhancesthemolecularsignalingofmitochondrialbiogenesisin ducedbyenduranceexerciseinhumanskeletalmuscle.JApplPhysi ol,2011,111(5):1335 -1344
[18]MSuwa,HNakano,ZRadak,etal.Enduranceexerciseincreases theSIRT1andperoxisomeproliferator-activatedreceptorgammacoactivator-1alphaproteinexpressionsinratskeletalmuscle.Met abolism,July1,2008;57(7):986 -98
[19] TuoyuGeng,PingLi,MitsuharuOkutsu,etal.PGC -1playsafunctionalroleinexercise-inducedmitochondrialbiogenesisandangiogenesisbutnotfiber-typetransformationinmouseskeletalmuscle.AmJPhysiolCellPhysiol,2010,298(3):572 -579[20] WisloffU,HelgerudJ,KemiOJ,etal.Intensity - con -trolledtreadmillrunninginrats:VO2maxandcardiachy-pertrophy[J].AmJPhysiolHeartCircPhysiol,2001,280:1301 - 1310
[21]WuZ,PuigserverP,AnderssonU,etal.Mechanismscontrolling mitochondrialbiogenesisandrespirationthroughthethermogenicco activatorPGC - 1[J].Cell,1999,98(1):115 - 124
[22]ZhenYan,MitsuharuOkutsu,YasirN.Akhtar,etal.Regulation ofexercise- inducedfibertypetransformation,mitochondrialbiogenesis,andangiogenesisinskeletalmuscle.JApplPhysiol,2011,110(1):264-274
