超高效液相色谱串联质谱法快速检测柑橘中的5种链格孢霉毒素
2015-01-04蒋黎艳赵其阳龚蕾刘雁雨张耀海马良焦必宁西南大学食品科学学院重庆00715农业部柑桔产品质量安全风险评估实验室重庆西南大学柑桔研究所重庆0071国家柑桔工程技术研究中心重庆0071农业部柑桔及苗木质量监督检验测试中心重庆0071
蒋黎艳赵其阳龚 蕾刘雁雨张耀海马 良焦必宁,,1(西南大学食品科学学院,重庆00715)(农业部柑桔产品质量安全风险评估实验室(重庆),西南大学柑桔研究所,重庆0071)(国家柑桔工程技术研究中心,重庆0071)(农业部柑桔及苗木质量监督检验测试中心,重庆0071)
超高效液相色谱串联质谱法快速检测柑橘中的5种链格孢霉毒素
蒋黎艳1,2赵其阳2,4龚 蕾2,4刘雁雨2,4张耀海2,4马 良*1,2焦必宁*1,2,3,41(西南大学食品科学学院,重庆400715)
2(农业部柑桔产品质量安全风险评估实验室(重庆),西南大学柑桔研究所,重庆400712)
3(国家柑桔工程技术研究中心,重庆400712)4(农业部柑桔及苗木质量监督检验测试中心,重庆400712)
建立了超高效液相色谱-串联质谱法快速检测柑橘中腾毒素、链格孢酚、交链格孢酚单甲醚、交链孢烯和细交链格孢菌酮酸5种链格孢霉毒素的新方法。样品经改进的QuEChERS(快速、简单、廉价、高效、灵活和安全)方法一步完成萃取净化,采用乙腈-甲酸(1.5%)提取,无水MgSO4和NaCl盐析,以ACQUITY UPLC BEH C18柱为分离柱,用乙腈和0.1%甲酸溶液进行梯度洗脱,电喷雾正离子(ESI+)多反应模式监测,超高效液相色谱-串联质谱(UPLC-MS/MS)测定。在本方法条件下,5种链格孢霉毒素在2.0~100μg/L浓度范围内均呈现良好的线性关系(R2>0.9922),检出限在0.11~0.91μg/kg之间。在5,20和100μg/kg加标水平下,5种毒素的回收率在71%~112%之间,相对标准偏差为1.1%~9.9%,能满足柑橘中链格孢霉毒素检测的要求。
链格孢霉毒素;超高效液相色谱-串联质谱法;柑橘;QuEChERS法
1 引 言
链格孢菌是导致水果、蔬菜及冷藏食品腐败变质的主要微生物,可以产生多种次生代谢物[1,2]。目前,从链格孢菌中已经分离了超过30种明显有毒性的毒素,统称为链格孢霉毒素。有研究表明,这些毒素具有致突变能力、致癌、致畸、细胞毒性和基因毒性等毒性,最为重要的有链格孢酚(Alternariol, AOH)、交链格孢酚单甲醚(Alternariolmonomethyl ether,AME)、交链孢烯(Altenuene,ALT)、腾毒素(Tentoxin,Ten)及细交链格孢菌酮酸(Tenuazonic acid,TeA),而TeA是其中唯一的含氮代谢产物,被认为是毒性最大且最重要的链格孢霉毒素[3~6]。
柑橘是全球最大的水果作物之一,具有较高的经济和保健价值[7]。有研究报道链格孢菌属能引发宽皮柑橘的褐斑病、粗皮柠檬的叶斑病和多种柑橘的黑斑病等病害,同时在果实发病中伴有链格孢霉毒素产生,给柑橘产业造成经济损失,危害食用者的健康[8,9]。目前链格孢霉毒素的研究主要集中在番茄、苹果和芒果等[10,11],柑橘中5种链格孢霉毒素研究基本上是空白;而且我国现有的食品安全国家标准还未规定链格孢霉毒素的限量[12],也没有制定柑橘类水果中链格孢霉毒素的检测方法,因此,尽快建立简单、快速、高效、灵敏的柑橘类水果中链格孢霉毒素的检测方法很有必要。
已报道的链格孢霉毒素的检测方法主要有薄层色谱法(TLC)[13]、高效液相色谱法(HPLC)[14]、酶联免疫吸附法(ELISA)[15]、气相色谱-串联质谱法(GC-MS/MS)[16]、液相色谱-串联质谱法(LC-MS/MS)[17]和超高效液相-串联质谱法(UHPLC-MS/MS)[18]等,这些方法各有优缺点,近年来对多种链格孢霉毒素的定量分析主要集中在后两种方法的研究和应用方面。
样品的前处理技术在方法检测中起到至关重要的作用,QuEChERS(Quick,easy,cheap,effective, rugged and safe)技术是一项新的高效提取净化技术,具有提取净化效率高、环境污染小、操作简单快速等优点[19],因其简单性和适用性,近年来广泛应用于同时分析农产品中的农兽药、激素和抗生素等残留。虽然QuEChERS方法最初是针对水果和蔬菜中的农药多残留分析,最近也应用于霉菌毒素的检测。Zhang等[20]采用QuEChERS方法对谷物中的黄曲霉毒素、T-2毒素、赭曲霉毒素和呕吐毒素等16种毒素进行前处理,UHPLC-MS/MS法检测,方法的平均回收率为70% ~120%,检出限为0.2~29.7μg/kg,部分毒素回收率不高(70%左右),而且并没有对链格孢霉毒素进行检测。目前还未见相关柑橘中5种链格孢霉毒素的检测方法的报道。
本研究利用超高效液相色谱-串联质谱法结合QuEChERS前处理技术,建立了快速检测柑橘中5种链格孢霉毒素Ten,ALT,AME,AOH和TeA的方法。考察了影响提取效果的因素,如样品量、提取溶剂、无水MgSO4的用量、NaCl的用量、是否添加吸附剂和提取时间等,并将本方法应用于实际样品测定。结果表明,本方法具有快速、简便、重现性良好等优点,能够满足不同柑橘中链格孢霉毒素的快速确证检测的要求。
2 实验部分
2.1 仪器、试剂与样品
Waters Quatrro-Premier XE超高效液相色谱-串联质谱仪(美国Waters公司),配有Acquity UPLC BEH C18色谱柱(50 mm×2.1 mm,1.7μm);KS260摇床(德国IKA公司);KQ5200DE超声波清洗器(江苏昆山市超声仪器有限公司);3K15离心机(德国Sigma公司);SANYO MDF-382E(N)超低温冰箱(日本松下集团);Vortex Genius 3涡旋混合器(德国IKA公司);Milli-Q A10超纯水器(美国Millipore公司);0.22μm有机滤膜(中国捷盛依科科技有限公司)。
腾毒素、交链格孢酚单甲醚、链格孢酚和细交链格孢菌酮酸的标准品(纯度>98%,新加坡Pribolab公司);交链孢烯标准品(纯度>98%,加拿大TRC公司);乙腈、甲醇(色谱纯)和N-丙基乙二胺均购自德国CNW Technologies有限公司;无水MgSO4(分析纯,江苏强盛化工有限公司,140℃烘烤4 h);NaCl(分析纯,国药集团化学试剂有限公司,140℃烘烤4 h);甲酸(分析纯,重庆川东化工有限公司)。
脐橙,芦柑,温州蜜柑,南丰蜜橘购买于重庆当地超市。
2.2 实验方法
2.2.1 超高效液相色谱条件色谱柱:Acquity UPLC BEH C18液相色谱柱(50 mm×2.1 mm,1.7μm);柱温30℃;流动相组成:A(0.1%甲酸溶液)+B(乙腈);梯度洗脱程序:0~4.3min,5% ~95%B;4.3~7.0min,95%B;5.0~5.1min,95%~5%B;5.1~6.0min,5%B。进样量:5μL;流速:0.3 mL/min。
2.2.2 超高效液相色谱-串联质谱条件离子化模式:电喷雾离子源,正离子模式(ESI+);质谱扫描方式:多反应监测(MRM);电离电压3 kV,离子源温度120℃,脱溶剂温度380℃,脱溶剂气流量800 L/h,碰撞气流量0.18 L/min,锥孔反吹气流量50 L/h。5种链格孢霉毒素的监测离子、锥孔电压和碰撞电压等质谱参数如表1所示。
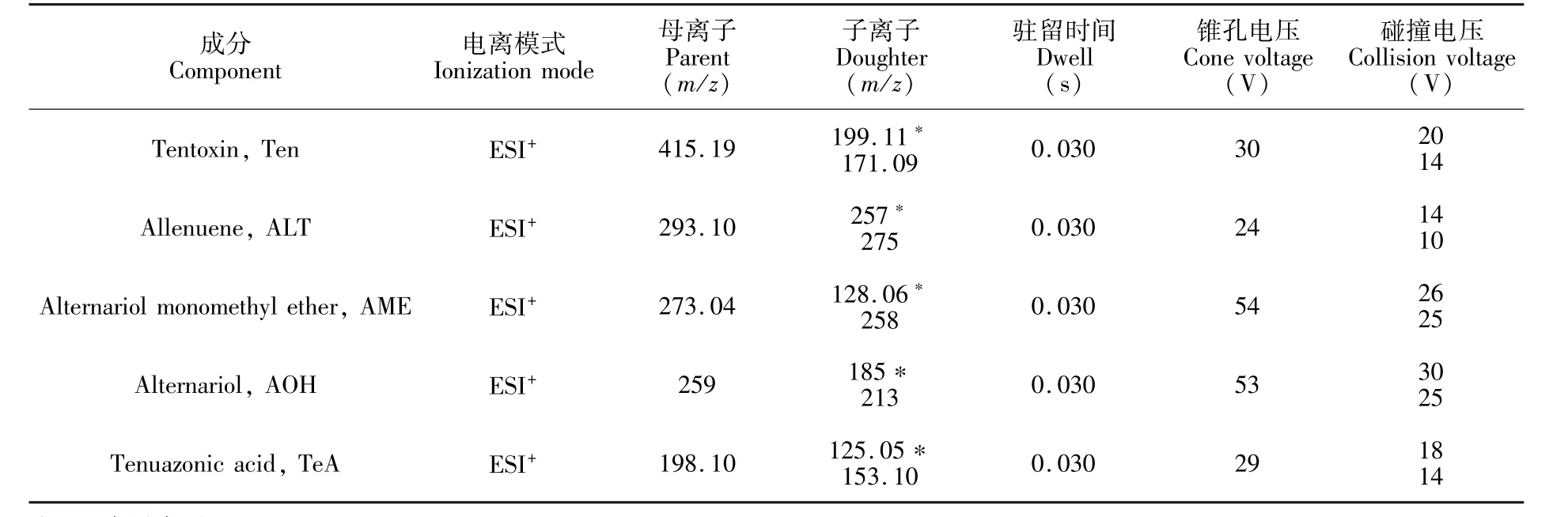
表1 5种链格孢霉毒素的串联质谱测定参数Table 1 MS/MS parameters for the five alternariamycotoxins
2.2.3 标准溶液的配制标准储备液:分别准确称取5种链格孢霉毒素标准品1 mg溶于1 mL乙腈中,配制成各自质量浓度为1.0 g/L的标准储备液,密封后置于-50℃避光保存。
标准工作液:用乙腈将标准储备液逐级稀释配制成1000,500,200,100,50和20μg/L的5种链格孢霉毒素的系列混合标准溶液,置于-50℃保存。
基质空白标准溶液:以不含链格孢霉毒素的柑橘果实为材料,利用本实验前处理方法分别制备柑橘果皮、全果和果肉的基质空白溶液。分别移取适量的1000,500,200,100,50和20μg/L的混合标准溶液,用基质空白溶液稀释成一系列质量浓度为100,50,20,10,5和2μg/L的基质空白标准溶液,在优化后的方法条件下测定,分别得到果皮、全果和果肉中5种毒素的标准曲线。
2.2.4 样品前处理方法
样品前处理方法的改进[21,22]:分别称取柑橘全果、果肉和果皮样品各5g(精确至0.01g)于50mL尖底具塞离心管中,加入5.00mL1.5%甲酸-乙腈溶液,20℃下恒温超声提取30min;再加入2.5g无水MgSO4和0.4gNaCl,剧烈振荡1min后,在10000r/min下离心5min,取上清液过0.22μm有机滤膜,滤液经UPLC-ESI-MS/MS分析。
3 结果与分析
3.1 色谱和质谱条件的优化
本实验研究了乙腈-水,甲醇-水,乙腈-甲酸溶液,乙腈-甲酸铵溶液,甲醇-甲酸溶液5种流动相体系,结果表明,在流动相为乙腈-甲酸(甲酸含量0.1%)溶液时,5种链格孢霉毒素可以达到分离,且均能获得较好的峰型和响应值(见图1)。

图1 5种链格孢霉毒素的MRM离子质谱图Fig.1 Mass spectrogram of five alternariamycotoxinsa. Tentoxin; b. Altenuene; c. Alternariol Monomethyl Ether;d.Alternariol;e.Tenuazonic acid.
通过电喷雾电离(ESI)和流动注射泵连续进样方式对多反应监测模式(MRM)的质谱条件进行了优化。分别在电喷雾ESI+和ESI-模式下进行全扫描,结果表明,在ESI+模式下,5种链格孢霉毒素灵敏度响应值高,母离子分别为m/z 415.19,293.10,273.04,259和198.10。通过对脱溶剂温度、碰撞压力、碰撞电压、毛细管电压和锥孔电压等质谱参数的优化,选择了稳定性好、丰度高和干扰小的两个碎片离子作为5种毒素定性离子和定量离子,并以丰度最强,响应值最高的的离子对作为定量离子对(见表1),图1为浓度为100μg/L标准溶液中5种链格孢霉毒素的MRM定量离子对质谱图。
3.2 改进QuEChERS方法萃取条件优化
为提高萃取效率,需对QuEChERS方法操作条件进行优化。在优化实验条件的过程中样品均采用全果为基准,加标水平均为0.1 mg/kg。
3.2.1 样品量对5种链格孢霉毒素回收率影响的优化QuEChERS方法普遍采用的称取样品量为10g[23~25],本实验考察了不同样品量(2,5和10g)对5种链格孢霉毒素回收率的影响。结果表明,在称样量为2.0g时,部分毒素回收率不高,其中Ten和ALT仅65%左右,且精密度和重复性差,5种毒素的RSD在9.6%~15.2%之间,尤其TeA的RSD值高达15.2%;在5和10g时,5种毒素的回收率都能达到80%以上,相对标准偏差均小于10%。考虑到样品量的增加会使乙腈提取液的量也增加,最终选择样品的称取量为5 g。
3.2.2 提取溶剂对5种链格孢霉毒素回收率影响的优化TeA是一种酸,样品提取液中加入适量酸有利于TeA提取[26]。本实验分别以0.1%,0.5%,1.0%,1.5%和2.0%(V/V)甲酸-乙腈为提取液,分别对样品进行提取(图2)。结果表明,当甲酸含量为0.1%~1.5%时,TeA的回收率显著上升,其它4种毒素的回收率变化不明显;在甲酸含量为1.5%时,所有毒素的添加回收率均大于80%;在甲酸含量为1.5%~2.0%时,5种毒素的回收率均下降,其中以TeA下降最明显。综合考虑确定甲酸1.5%(V/V)-乙腈作为提取液。

图2 甲酸含量对5种链格孢霉毒素回收率的影响(以全果为基质,加标水平:0.1 mg/kg)Fig.2 Effect of formic acid content on recovery rates of five alternaria mycotoxins(in whole fruit,spiked at 0.1 mg/kg)
3.2.3 提取方式、超声温度和功率对5种链格孢霉毒素提取效果的影响本实验考察了超声波和振荡及两者交替3种提取方式对5种链格孢霉毒素回收率的影响。结果表明,在振荡提取时,AOH和TeA提取回收率低于80%;超声波提取时,5种毒素的回收率均大于85%;两者交替与直接超声提取结果无显著差异。因此,最终选择以超声提取方式。本实验还研究了超声温度(20℃,30℃和40℃)和超声功率(90,120和150 W)对5种链格孢霉毒素回收率效果的影响,发现两者对回收率的影响不显著。因此,本研究选择温度20℃和功率90W作为提取条件。
3.2.4 无水M gSO4、NaCl用量和吸附剂对5种链格孢霉毒素提取效果的影响QuEChERS方法中常用的除水剂主要有MgSO4,MgCl2,NaNO3,Na2SO4等,其中以MgSO4的除水效果最好。本实验考察了无水MgSO4用量(1,1.5,2,2.5,3g)对5种毒素回收率的影响。MgSO4用量为1.0~2.5 g时,3种毒素Ten,ALT和AOH的回收率变化趋势并不明显, 而AME和TeA的回收率均上升,并在2.5 g时回收率均达到85%以上;MgSO4用量为2.5~3.0 g时, 4种毒素回收率均下降,其中Ten的回收率从95.1%下降到94.6%,变化并不明显,因此确定无水MgSO4的用量为2.5 g。
样品经过提取后,提取液中仍然存在大量共萃物;添加了盐析剂后,提取液中的有机相分子(如:乙腈)会由于离子强度的增加而断开与水分子间的氢键,从水中盐析出来。本实验考察了盐析剂NaCl用量(0.3,0.4,0.5,0.6,0.7g)对5种毒素回收率的影响,结果表明,当NaCl用量在0.3~0.4g时, 5种链格孢霉毒素的回收率达到85%以上;在0.4~0.7g范围内,有4种毒素回收率均下降,因此确定NaCl的用量为0.4g。

图3 提取时间对5种链格孢霉毒素回收率的影响(以全果为基质,加标水平:0.1 mg/kg)Fig.3 Effect of extraction time on recoveries of five alternariamycotoxins(in whole fruit,spiked at0.1 mg/kg)
当样品提取液经盐析分层后,少量的蛋白质、油脂、色素以及糖组分会不可避免地与真菌毒素共同萃取出来,严重干扰残留的分析结果。本实验研究了不加吸附剂及分别加入C18,PSA,GCB这3种吸附剂对5种链格孢霉毒素回收率的影响,发现加入PSA后TeA的回收率为50%~60%;加入GCB后 AME的回收率为0;加入C18及不加入任何吸附剂对5种链格孢霉毒素的回收率影响不显著,其中TeA在C18条件下重现性差且不稳定,因此本实验最终选择不加入任何吸附剂。
3.2.5 提取时间的优化考察了提取时间(10, 20,30,40,50和60min)对5种链格孢霉毒素回收率的影响(图3)。在10~30min时,5种毒素回收率均上升,达80%以上;在30~60min时,4种毒素的回收率无显著差异,而AOH的回收率显著下降。在基质标测定时发现,随着空白基质溶液加入的比例的增加,AOH的基质减弱效应逐步增强;而在提取时间优化时,随着超声时间的过度延长,AOH的响应值明显下降,其基质减弱响应明显增强,回收率也逐渐下降至70%左右,因此推测过度的延长超声时间会导致样品杂质的溶出量增加,对AOH的检测产生一定干扰。
3.3 基质效应
基质效应(Matrix Effect,ME)是指样品中除目标化合物以外的其它成分对目标化合物响应值的影响[27]。为了检验空白样品基质对目标化合物的响应值是增强还是抑制,分别用溶剂标准溶液和基质空白溶液配置100μg/L的5种链格孢霉毒素的混合溶液,并进行比较,当平均基质效应(增强或抑制)超过20%,则认为基质效应对定量检测具有显著影响,不可忽略。基质效应(ME)可以通过下面的公式计算:
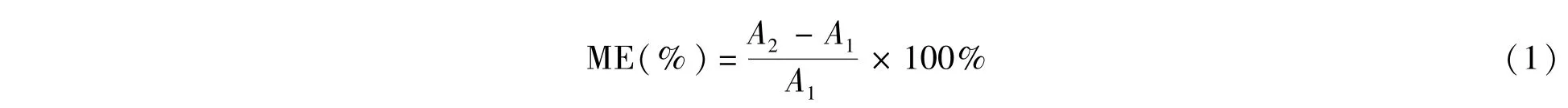
式中,A1为特定浓度下的毒素标准品在纯溶剂(初始流动相)中的平均峰面积;A2为相同浓度下的毒素标准品在基质空白溶液中的平均峰面积。

表2 柑橘样品果皮、果肉、全果通过QuEChERS方法前处理后的基质效应Table 2 Overview of matrix effects evaluated in peel,pulp and whole fruit when employing the QuEChERS-based sample preparation approach(UPLC/ESI+-MSanalysis)
表2表明,5种毒素的基质效应都是减弱效应,绝对值均几乎大于20%,其中在果皮中的减弱效应最高,果肉中最低,分析原因是柑橘果皮基质比较复杂,而果肉基质简单,因此基质效应会降低方法的灵敏度,影响方法的准确性。为了确保结果的准确性,需要用基质标准工作液为基准来进行校正。
3.4 方法的评价
3.4.1 线性关系和检出限在优化的前处理和色谱条件下,对系列质量浓度的基质空白混合标准溶液进行检测,其线性范围和精密度结果见表3。结果表明,5种链格孢霉毒素在2.0~100μg/L范围内均有良好的线性关系,R2>0.9922。在S/N=3时, Ten,ALT,AME,AOH和TeA的检出限在0.11~0.91μg/kg范围内。

表3 5种链格孢霉毒素的线性范围、线性方程、R2和检出限(LODs)Table 3 Liner range,linear equation,R2and limit of detection(LODs)of five alternariamycotoxins
3.4.2 加标回收率和精密度分别在5,20和100μg/kg水平下加标,每个水平重复测定5次。5种毒素的回收率在71%~112%之间,相对标准偏差均小于10%(见表4),结果表明,本方法对柑橘样品的不同含量的5种链格孢霉毒素的测定均具有较高的回收率和精密度,满足检测要求。
3.4.3 实际样品测定在本地市场随机抽取宽皮柑橘(南丰蜜橘、温州蜜柑和芦柑)和橙类(脐橙)各20个,共计80份,采用本方法分别对4个不同品种柑橘的果皮、果肉和全果进行检测。结果表明,其中20份柑橘果皮样品呈阳性,主要集中在南丰蜜橘和温州蜜柑里,而5种链格孢霉毒素的含量在2.1~21.8μg/kg范围;14份柑橘全果样品呈阳性,5种毒素均有检出,含量在2.0~10.2μg/kg范围;3份柑橘果肉样品呈阳性,主要检出了ALT和AOH两种毒素,毒素含量在3.3~5.0μg/kg。由表5可知,链格孢霉毒素主要产生在果皮上,而后通过果皮侵染,这与Magnani等[8]的研究结果一致。
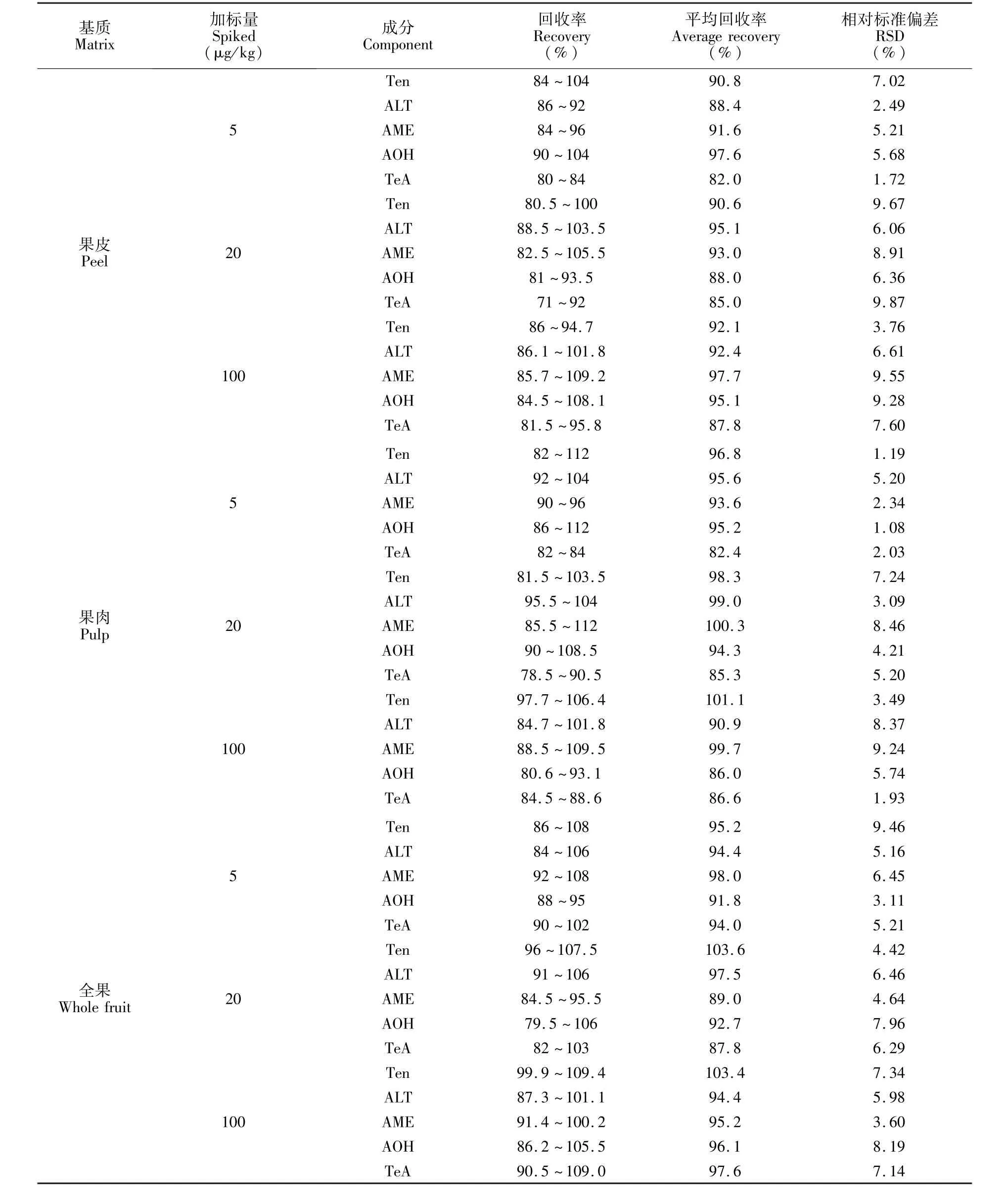
表4 柑橘的果皮、果肉以及全果中5种链格孢霉毒素的添加回收率和精密度(n=5)Table 4 Recoveries and precisions for the five alternariamycotoxins in citrus peel,pulp and whole fruit(n=5)
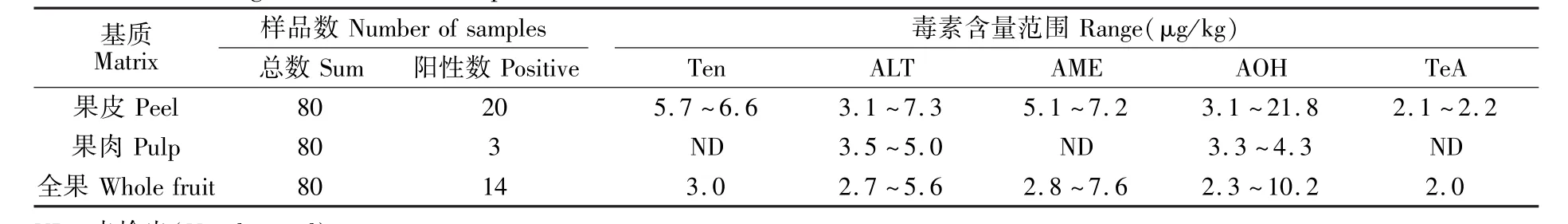
表5 实际样品的检测结果Table 5 Detecting results of real samples
4 结论
利用超高效液相色谱-串联质谱法结合QuEChERS前处理技术,建立了快速检测柑橘中Ten,ALT, AME,AOH和TeA 5种链格孢霉毒素的方法。采用改进的QuEChERS一步提取净化的前处理方法处理柑橘样品,重点考察了影响提取效果的因素,如样品量、提取溶剂、无水MgSO4用量、NaCl用量、是否添加吸附剂和提取时间等,同时简化了前处理步骤。本方法具有操作简单、快速、灵敏度高、检出限低和重现性好等优点,能满足柑橘中真菌毒素的检测要求。
1 Watson D H.J.Food Prot.,1984,47(6):485-488
2 LIFeng-Qin.Chinese J.Food Hyg,2001,13(6):45-49
李凤琴.中国食品卫生杂志,2001,13(6):45-49
3 Ostry V.World Mycotoxin J,2008,1(2):175-188
4 King Jr A D,Schade JE.J.Food Prot.,(USA),1984,47(11):886-901
5 Logrieco A,Moretti A,Solfrizzo M.World Mycotoxin J.,2009,2(2):129-140
6 Alexander J,Benford D,Boobis A,Ceccatelli S,Cottrill B,Cravedi J,Heppner C.EFSA J,2011,9(10):2407-2504
7 Talon M,Gmitter FG.Citrus G.Int.J.Plant.Genom.,2008:528361
8 Magnani R F,De Souza G D,Rodrigues-Filho E.J.Agric.Food Chem.,2007,55(13):4980-4986
9 Akimitsu K,Peever T L,Timmer LW.Mol.Plant Pathol.,2003,4(6):435-446
10 Stinson EE,Bills DD,Osman SF,Siciliano J,Ceponis M J,Heisler EG.J.Ag.Food Chem.,1980,28(5):960-963
11 Prusky D,Shalom Y,Kobiler I,Akerman M,Fuchs Y.Postharvest Biol.Tec.,2002,25(3):339-347
12 GB 2761.2011 SD,National Food Safety Standards.Maximum Levels ofMycotoxins in Foods,2011
食品中真菌毒素限量食品安全国家标准.2011 GB 2761.2011
13 Sauer D B,Seitz L M,Burroughs R,Mohr H E,West J L,Milleret R J,Anthony H D.J.Ag.Food Chem.,1978, 26(6):1380-1383
14 Myresiotis C K,Testempasis S,Vryzas Z,Karaoglanidis G S,Papadopoulou-Mourkidou E.Food Chem.,2015,182:81-88
15 Gross M,Curtui V,Ackermann Y,Latif,H,Usleber E.J.Ag.Food Chem.,2011,59(23):12317-12322
16 Scott PM,Weber D,Kanhere SR.J.Chromatogr.A,1997,765(2):255-263
17 Liu Y,Rychlik M.Anal.Bioanal.Chem.,2015:1-13
18 Zhao K,Shao B,Yang D,Li F.J.Agric.Food.Chem,2014,63(1):343-348
19 CHEN Jian-Biao,DONG Li-Na,LIU Jiao,LU Lei,ZHAO Ming-Ming,DING Hua,WANG Xiao-Hong,HU Ding-Jin, ZHOU You-Xiang.Chinese J.Food Sci,2014,11:57
陈建彪,董丽娜,刘娇,路磊,赵明明,丁华,王小红,胡定金,周有祥.食品科学,2014,11:57
20 Zhang JM,Wu Y L,Lu Y B.J.Chromatogr.B,2013,915:13-20
21 Anastassiades M,MaštovskáK,Lehotay S J.J.Chromatogr.A,2003,1015(1):163-184
22 Zachariasova M,Lacina O,Malachova A,Kostelanska,M,Poustka J,Godula,M,Hajslova.Anal.Chim.Acta,2010, 662(1):51-61
23 Anastassiades M,Lehotay S J,¯Stajnbaher D,Schenck,F.J.AOAC Int.,2003,86(2):412-431
24 Rasmussen R R,Storm IM L D,Rasmussen PH,Smedsgaard J,Nielsen K F.Anal.Bioanal.Chem.,2010,397(2):765-776
25 Zhu Y,Liu X,Xu J,Dong F,Liang X,LiM,Zheng Y.J.Chromatogr.A,2013,1299:71-77
26 Scott PM.J.J.AOAC Int,2001,84(6):1809-1817
27 SONG Ying,ZHANG Yao-Hai,HUANG Xia,PANG Jia-Rong,JIAO Bi-Ning.Chinese J.Anal.Chem.,2011,39(8):1270-1273
宋莹,张耀海,黄霞,潘家荣,焦必宁.分析化学,2011,39(8):1270-1273
(Received 5 May 2015;accepted 22 July 2015)
Rapid Determ ination of Five Alternaria M ycotoxins in Citrus by Ultra-high Performance Liquid Chromatography-Tandem M ass Spectrometry
JIANG Li-Yan1,2,ZHAO Qi-Yang2,4,GONG Lei2,4,LIU Yan-Yu2,4,ZHANG Yao-Hai2,4,
MA Liang*1,2,JIAO Bi-Ning*1,2,3,41(College of Food Science,Southwest University,Chongqing 400715,China)
2(Citrus Research Institute,Southwest University/Laboratory ofCitrus Quality and Safety Risk Assessment, Ministry ofAgriculture,Chongqing 400712,China)
3(National Center for Citrus Engineering,Chongqing 400712,China)
4(Supervision and Testing Centre for Citrus and Seedling Quality, Ministry ofAgriculture,Chongqing 400712,China)
A novel method was developed for the rapid determination of five alternaria mycotoxins, alternariol,alternariolmonomethyl ether,altenuene,tentoxin and tenuazonic acid,in citrus using ultra-high performance liquid chromatography-tandem mass spectrometry.The sample was prepared using the modified QuEChERS(quick,easy,cheap,effective,rigged,and safe)method to complete the extraction and cleanup steps in one procedure.In this QuEChERSmethod,sample was extracted with acetonitrile(1.5%formic acid),then salted out with anhydrous MgSO4 and NaCl,separated on an ACQUITY UPLC BEH C18with gradient elution by using acetonitrile and 0.1%formic acid aqueous as eluant,and detected by UPLC-MS/MS under negative(ESI+)electrospray ionization and MRM models.Under these conditions,five alternaria mycotoxinsmade a good linearity in the concentration range of2.0-100μg/L with R2>0.9922,and the limits of detection of the instrument were in the range of 0.11-0.91μg/kg.Three spiked levels of five altenaria mycotoxins at5,20 and 100μg/kg were investigated,and the recoveries ranged from 71%to 112%with the relative standard deviations(RSDs)varying from 1.1%to 9.9%,which met the requirement ofmycotoxins determination.
Altenariamycotoxins;Ultra-high performance liquid chromatography-tandem mass spectrometry;Citrius;QuEChERSmethod
10.11895/j.issn.0253-3820.150370
2015-05-05收稿;2015-07-22接受
本文系国家重点基础研究发展计划(973计划)项目(No.2013CB127803)、国家自然科学基金项目(No.31301476)、农业部现代农业(柑桔)产业技术体系建设专项(CARS-27)、2015年国家农产品质量安全风险评估重大专项(GJFP2015004)和中央高校基本科研业务费专项(XDJK2013B035)资助项目。
Email:zhyhml@163.com,bljiao@tom.com
