选择性COX-2抑制剂塞来昔布抑制B细胞淋巴瘤细胞株MDR-1及Bcl-2的mRNA表达 并增强表柔比星的抗肿瘤作用
2015-01-04化范例王玲燕赵鑫李莹邬扬炯高松
化范例,王玲燕,赵鑫,李莹,邬扬炯,高松
1.复旦大学附属金山医院血液内科,上海 201508;
2.复旦大学附属中山医院实验研究中心,上海 200032
选择性COX-2抑制剂塞来昔布抑制B细胞淋巴瘤细胞株MDR-1及Bcl-2的mRNA表达 并增强表柔比星的抗肿瘤作用
化范例1,王玲燕2,赵鑫1,李莹1,邬扬炯1,高松1
1.复旦大学附属金山医院血液内科,上海 201508;
2.复旦大学附属中山医院实验研究中心,上海 200032
背景与目的:部分非霍奇金淋巴瘤(non-Hodgkin’s lymphoma, NHL)具有高表达环氧合酶-2(cyclooxygenase-2,COX-2)的特征,而后者与P-糖蛋白及Bcl-2表达相关,可能导致NHL对化疗耐药。本研究旨在探讨B细胞淋巴瘤细胞株中COX-2的表达以及选择性COX-2抑制剂塞来昔布增强淋巴瘤细胞对表柔比星抗肿瘤效应的敏感性及其可能机制。方法:用荧光定量PCR(qRT-PCR)及蛋白[质]印迹法(Western blot)分别检测Raji、Jeko-1和Namalwa等淋巴瘤细胞株以及正常人外周血B细胞的COX-2表达;以梯度浓度的塞来昔布作用于淋巴瘤细胞株,CCK-8方法检测细胞增殖的抑制程度,qRT-PCR检测各细胞株MDR-1 mRNA及Bcl-2 mRNA表达的变化;表柔比星单独或联合不同浓度的塞来昔布处理Raji细胞株72 h后,CCK-8方法分析塞来昔布对表柔比星的增敏作用。结果:各淋巴瘤细胞株及正常对照外周血B细胞均不表达COX-2。塞来昔布单药即可对各淋巴瘤细胞株产生程度不同的抗增殖效应;随着塞来昔布作用浓度的增加,除Jeko-1细胞不表达MDR-1外,其余细胞株MDR-1 mRNA及Bcl-2 mRNA表达水平逐渐下降;塞来昔布明显增强表柔比星对Raji细胞的抗肿瘤活性,两者之间具有协同作用。结论:选择性COX-2抑制剂塞来昔布下调B细胞淋巴瘤细胞株的MDR-1 mRNA及Bcl-2 mRNA水平,并且增强表柔比星对淋巴瘤细胞的抗肿瘤效应。
环氧合酶-2;塞来昔布;淋巴瘤;MDR-1基因;Bcl-2基因
非霍奇金淋巴瘤(non-Hodgkin’s lymphoma, NHL)是淋巴造血系统常见的恶性肿瘤之一,且近年来在我国的发病率及死亡率均有逐渐升高的趋势[1]。虽然新的治疗方法如分子靶向治疗、造血干细胞移植等可以改善部分患者的预后,但化疗仍然在临床治疗策略中占据着无可替代的基石地位。影响化疗成败的重要因素之一是肿瘤细胞是否出现耐药,在此过程中,MDR-1基因产物P-糖蛋白(P-glycoprotein,P-gp)因可以将药物主动泵出细胞外而被广泛关注,下调P-gp的表达可以有效减少肿瘤细胞对化疗的耐药[2-3]。我们在前期研究中发现,部分NHL病理组织高表达环氧合酶-2(cyclooxygenase-2, COX-2)[4],而COX-2的表达又与P-gp和Bcl-2蛋白的表达呈现一定的联系[5]。那么,选择性的COX-2抑制剂塞来昔布在抑制COX-2活性的同时,是否能够下调P-gp和Bcl-2的表达并进一步影响淋巴瘤细胞的生物学特点呢?本研究选取了部分B细胞来源的淋巴瘤细胞株,观察塞来昔布处理后MDR-1及Bcl-2基因表达的变化及其对表柔比星抗增殖效应的影响,探讨塞来昔布应用于抗NHL治疗的潜在价值。
1 材料和方法
1.1 主要试剂及细胞株
塞来昔布及表柔比星均为美国辉瑞公司产品;RPMI-1640细胞培养液及新生牛血清购自杭州四季青生物工程材料有限公司;CCK-8试剂盒由无锡碧云天生物技术有限公司供应; CD19免疫磁珠为德国美天旎公司产品;兔抗人COX-2单克隆抗体及兔抗人GAPDH单克隆抗体、鼠抗兔IgG二抗均购自美国CST公司;cDNA逆转录及荧光定量PCR分别采用宝生物工程(大连)有限公司的PrimeScript逆转录试剂盒和SYBR Premix Ex TaqTMⅡ试剂盒。人Burkitt淋巴瘤Raji、Namalwa细胞株(均为EBV阳性)及套细胞淋巴瘤Jeko-1细胞株(EBV阴性)均购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
1.2 免疫磁珠分离外周血B细胞
抽取3名健康志愿者外周EDTA-K2抗凝血20 mL,Ficoll密度梯度离心法获取单形核细胞约2×107个,加入40 μL CD19免疫磁珠4 ℃温育15 min,洗涤2次后,过柱分选出CD19+B细胞。流式细胞术验证所得细胞纯度达99%以上。
1.3 细胞培养及CCK-8检测细胞增殖活力
将各细胞株置于含10%小牛血清的RPMI-1640完全培养液中,在37 ℃、CO2体积分数为5%的饱和湿度条件下培养,取对数生长期细胞进行实验。细胞密度调整为5×104个/mL,接种于96孔细胞培养板,每孔100 μL。细胞株均按处理药物不同分为塞来昔布组(终浓度依次为0、10、20、40、60、80和100 μmol/mL)、表柔比星组(终浓度依次为0.05、0.1、0.25、0.5和1.0 μg/mL)和联合药物组(塞来昔布0~100 μmol/mL和表柔比星0.49 μg/mL),培养72 h后加入10 μL CCK-8试剂,继续培养2 h,450 nm处读取吸光度值(D),按如下公式计算细胞活力:细胞活力(%)=(D实验组-D空白对照)/(D对照组-D空白对照)×100%。
塞来昔布与表柔比星的协同作用以金氏公式q=Ea+b/(Ea+Eb-Ea×Eb)进行评价,其中Ea、Eb、Ea+b代表两药分别应用及联用时的抑制率。q值介于0.85~1.15之间为相加作用,>1.15为两药协同作用,<0.85则为拮抗作用。
1.4 蛋白[质]印迹法(Western blot)检测
收集对数生长期的各细胞株,分别用含蛋白酶抑制剂的RIPA细胞裂解液裂解,提取蛋白并定量。取40 μL总蛋白进行SDS-PAGE凝胶电泳,转膜后以4% BSA封闭2 h,在1∶1 000浓度的兔抗人COX-2单克隆抗体及兔抗人GAPDH单克隆抗体中温育16 h,TBST洗涤6次以后,1∶3 000浓度的鼠抗兔IgG1二抗温育2 h,显色。以目的条带与内参条带灰度值的比值计算目的蛋白的相对表达量。
1.5 实时荧光定量PCR检测
以TRIzol-氯仿-异丙醇法提取经过0、10、20、40、60、80和100 μmol/mL等不同浓度塞来昔布处理后的各细胞株的总RNA,检测其含量及D260/D280比值。按照产品操作说明,以20 μL体系逆转录为cDNA。实时荧光定量PCR的反应条件为95 ℃,30 s 预变性,95 ℃5 s,60 ℃ 30 s共40个循环。COX-2基因上游引物序列为:5’-TGCATTCTTTGCCCAGCACT -3’,下游:5’-AAAGGCGCAGTTTAC GCTGT-3’,产物长度146 bp;MDR-1上游:5’-GCTCGTGCCCTTGTTAGAC-3’,下游:5’-C A G G G C T T C T T G G A C A ACC-3’,产物长度96 bp;Bcl-2上游:5’-ATCGCCCTGTGGATGACTGAG-3’,下游:5’-CAGCCAGGAGAAATCAAACAGA GG-3’,产物长度129 bp;GAPDH上游:5’-GGTGGTCTCCTCTGACTTCAACA-3’,下 游 : 5’-G T T G C T G T A G C C A A ATTCGTTGT-3’,产物长度127 bp。以GAPDH的Ct值作为参照,以2-ΔΔCt计算mRNA倍数变化。
1.6 统计学处理
采用SPSS l6.0软件进行统计学分析。不同细胞株对各浓度塞来昔布增殖抑制的反应采用双向方差分析,塞来昔布处理后MDR-1和Bcl-2 mRNA表达变化以ΔΔCt作为统计量进行单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 Raji、Namalwa及Jeko-1细胞株均不表达COX-2
无论是EBV阳性的Raji、Namalwa细胞株,还是EBV阴性的Jeko-1细胞株,也无论是在蛋白水平还是mRNA水平,均未见COX-2表达。多次改变实验条件(Western blot检测增加总蛋白量至80 μL及提高抗体工作浓度,实时荧光定量PCR实验更换引物及改变扩增条件等)并未能改变阴性结果。同样,来源于正常对照外周血的B细胞也不表达COX-2(图1)。

图1 Western blot未检测到Raji、Namalwa及Jeko-1细胞株和正常对照外周血B细胞COX-2的表达Fig. 1 COX-2 was not detectable both in normal B cells (control) and in B-cell-originated lymphoma cell lines by Western blot
2.2 塞来昔布对实验淋巴瘤细胞株增殖的抑制作用
虽然实验所使用的3种细胞株均不表达COX-2,但COX-2的选择性抑制剂塞来昔布却对3种细胞株的增殖均有抑制作用(F=34.60,P<0.001)。3种细胞株对塞来昔布的反应不尽相同(F=58.14,P<0.001)。由图2可见,Raji细胞株在接受较低浓度塞来昔布(10 μmol/L)处理时即出现增殖抑制效应,并且随着浓度增加而逐渐显著;而Namalwa和Jeko-1细胞株对塞来昔布的反应弱于Raji细胞株,直至浓度达60 μmol/L,甚至更高时,才能观察到塞来昔布对其增殖的抑制作用。
2.3 塞来昔布下调各淋巴瘤细胞株MDR-1 mRNA和Bcl-2 mRNA表达
实时荧光定量PCR结果显示,虽然强弱程度有差异,但3种细胞株均表达Bcl-2,塞来昔布明显影响Bcl-2的表达(Raji、Jeko-1和Namalwa细胞株实验中F值分别为58.37、42.62和50.83,P值均<0.001),且呈现出浓度梯度效应。与Bcl-2表达不同,Jeko-1细胞株并不表达MDR-1,而Raji细胞株中MDR-1的表达又强于Namalwa细胞株。塞来昔布同样影响Raji和Namalwa细胞株的MDR-1表达(前者F=45.99,P<0.001;后者F=18.05,P<0.001),并且亦呈浓度依赖性。图3显示各细胞株分别接受20、40和80 μmol/L塞来昔布处理后MDR-1 mRNA和Bcl-2 mRNA表达相对于处理前的倍数变化。
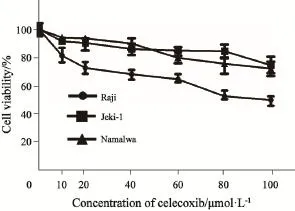
图2 塞来昔布抑制淋巴瘤细胞株增殖Fig. 2 Celecoxib inhibited the proliferation of B-cell-originated lymphoma cell lines
2.4 塞来昔布增加Raji细胞株对表柔比星的敏感性
由于M D R-1和B c l-2基因产物均与肿瘤对化疗药物的耐药相关,我们选择了M D R-1和B c l-2基因表达均较强的R a j i细胞株进行了塞来昔布对表柔比星的增敏实验。不同浓度(0.01~2 μmol/L)的表柔比星单独作用于对数生长期的Raji细胞株72 h,计算其IC50为0.49 μmol/L,作为实验浓度。分别将终浓度为0、10、20、40、60、80和100 μmol/L的塞来昔布与终浓度0.49 μmol/L 的表柔比星共同作用于Raji细胞。结果显示,塞来昔布在10、20、40和60 μmol/L时与表柔比星对Raji细胞株增殖的抑制呈现协同作用,金氏公式计算q值分别为1.28、1.19、1.18和1.23,而当塞来昔布浓度进一步增加时,q有所减小,但仍介于1.1~1.15之间。

图3 MDR-1和Bcl-2 mRNA表达随塞来昔布浓度增加而下降Fig. 3 The expression MDR-1 and Bcl-2 mRNA was decreased in B-cell-originated lymphoma cell lines by celecoxib in a concentration-dependent manner
3 讨 论
COX-2是前列腺素合成过程中的限速酶,正常生理状态下通常难以检测,但在炎性条件下可由IL-1β、IL-6、TNFα等细胞因子诱导表达,其催化产物前列腺素E2在抑制细胞凋亡、增加血管生成、促使前致癌物质向致癌物质转化等过程中起到重要作用。由于多种恶性肿瘤具有高表达COX-2的特征,COX-2也被认为在慢性炎症与肿瘤形成之间起着重要的桥梁作用[6]。本研究之前也在NHL中发现高表达COX-2的病理亚型通常与病原体感染密切相关[4],例如MALT淋巴瘤和鼻型结外NK/T细胞淋巴瘤分别与幽门螺杆菌和EB病毒感染有关。本研究选取了EBV阳性的Raji、Namalwa细胞株及EBV阴性的Jeko-1细胞株,以期进一步证实病原感染对COX-2表达的影响,但结果显示,与正常B细胞无差异,无论是mRNA水平还是蛋白水平,上述细胞株中均未能检测出COX-2表达,提示至少在淋巴瘤中,单独EBV感染因素并不能决定COX-2的表达。
塞来昔布是选择性COX-2抑制剂,临床上常用来作为解热镇痛药物。由于COX-2与恶性肿瘤的联系密切,塞来昔布也被推测可以预防或者延缓肿瘤发生,控制肿瘤的生长和转移、浸润等。虽然有研究证实,塞来昔布对多种恶性肿瘤的负向调控作用[7-10],但同时发现,这种作用并不一定依赖于COX-2活性的抑制。正如本研究结果显示,虽然Raji、Namalwa和Jeko-1细胞株中均不表达COX-2,但经过塞来昔布处理后,各细胞株的生长仍然受到了不同程度的抑制。有学者证实,在淋巴瘤Raji细胞株中,塞来昔布可以通过内质网应激途径发挥抗增殖效应[11],而在同样不表达COX-2的多种Burkitt淋巴瘤细胞株和滤泡细胞淋巴瘤细胞株中,塞来昔布则可以通过促进TRAIL介导的细胞凋亡而发挥抗肿瘤效应[12]。这些结果一方面说明塞来昔布对肿瘤细胞作用的复杂性,另一方面亦提示不能仅根据肿瘤是否表达COX-2判断塞来昔布的适用性。
本研究结果提示,塞来昔布在单独应用尤其是低剂量时对淋巴瘤的抑制作用有限,反而下调MDR-1和Bcl-2基因表达的作用十分显著,在其他类型的肿瘤细胞中亦有类似发现[8,13-14]。MDR-1和Bcl-2基因分别编码P-gp和Bcl-2蛋白,其中Bcl-2是调控细胞凋亡的关键蛋白之一,其高表达已被证实与淋巴瘤细胞对化疗和放疗敏感性降低有关[15]。P-gp则是公认的导致耐药的重要因素[2],其可依赖ATP将药物泵出细胞外,通过降低细胞内的药物浓度而导致肿瘤细胞耐药。本研究中,塞来昔布下调实验NHL细胞MDR-1和Bcl-2基因表达,可使肿瘤细胞对化疗药物的抵抗减弱,凋亡增加,从而协同放大表柔比星的抗肿瘤效应。
目前在世界范围内多项塞来昔布应用于肿瘤辅助治疗的临床试验已经开展,但初步结论并不一致:虽然在乳腺癌[16]、复发性卵巢癌[17]等恶性疾病中塞来昔布显示出令人鼓舞的临床疗效,但被寄予厚望的STAMPEDE研究否认了塞来昔布对激素敏感型前列腺癌的治疗作用[18]。亦有学者乐观估计塞来昔布等COX-2抑制剂在淋巴瘤治疗中的应用前景[19],并且塞来昔布的确在部分难治/复发性淋巴瘤患者以及MALT淋巴瘤动物模型中显示出一定的抗肿瘤作用[20-21],但是否所有的NHL病理亚型均适用COX-2抑制剂,是否存在某种可以预测COX-2抑制剂的生物标志,虽然本研究尚不能给出答案,但这些问题无疑值得深入研究。
应当注意的是,在上述临床试验中,塞来昔布均为连续给药,造成部分患者难以耐受,例如在DoCaCel研究中[22],虽然塞来昔布带来的益处已经初步显现,但实验组患者平均应用仅8.5个月,以致无进展生存期及总生存率差异无统计学意义(P>0.05)。本研究结果显示,塞来昔布单独应用并不能显著抑制淋巴瘤细胞增殖,而明显下调MDR-1和Bcl-2基因的表达,与化疗药物表现出协同抗肿瘤效应。由此设想,在化疗的同时给予塞来昔布,而在化疗间歇期则停用,一方面可以保持塞来昔布对化疗的增敏作用,提高疗效,另一方面也可以避免长时间连续应用塞来昔布所带来的不良反应,提高患者对治疗的耐受性。但是该设想仅由淋巴瘤细胞系的体外实验结果推断,是否可行还需要动物体内实验、临床实践等进一步验证。
[1] 陈万青, 张思维, 曾红梅, 等. 中国2010年恶性肿瘤发病与死亡[J]. 中国肿瘤, 2014, 23(1): 1-10.
[2] SANEJA A, KHARE V, ALAM N, et al. Advances in P-glycoprotein-based approaches for delivering anticancer drugs: pharmacokinetic perspective and clinical relevance[J]. Expert Opin Drug Deliv, 2014, 11(1): 121-138.
[3] DARBY R A, CALLAGHAN R, MCMAHON R M. P-glycoprotein inhibition: the past, the present and the future[J]. Curr Drug Metab, 2011, 12(8): 722-731.
[4] 化范例, 刘惠萍, 刘泽兵, 等. 环氧合酶-2在不同病理类型非霍奇金淋巴瘤组织中的表达及其临床意义[J]. 临床血液学杂志, 2011, 24(5): 286-289.
[5] 化范例, 高松, 邬扬炯, 等. 环氧合酶-2影响弥漫大B细胞淋巴瘤患者预后相关因素初探[J].复旦学报(医学版), 2012, 39(3): 243-246.
[6] HARRIS R E. Cycloozygenase-2 (COX-2) and inflammogenesis of cancer[J]. Subcell Biochem, 2007, 42(1): 93-126.
[7] NINOMIYA I, NAGAI N, OYAMA K, et al. Antitumor and anti-metastatic effects of cyclooxygenase-2 inhibition bycelecoxib on human colorectal carcinoma xenografts in nude mouse rectum[J]. Oncol Rep, 2012, 28(3): 777-784.
[8] YAN Y X, LI W Z, HUANG Y Q, et al. The COX-2 inhibitor Celecoxib enhances the sensitivity of KB/VCR oral cancer cell lines to Vincristine by down-regulating P-glycoprotein expression and function[J]. Prostaglandins Other Lipid Mediat, 2012, 97(1-2): 29-35.
[9] 郭华, 曹维克, 刘定胜, 等. 塞来昔布联合干扰素α对K562/ A02细胞增殖的影响及其机制 [J].中华血液学杂志, 2011, 32(6): 408-409.
[10] BOCCA C, BOZZO F, BASSIGNANA A, et al. Blocking PGE2-induced tumour repopulation abrogates bladder cancer chemoresistance [J]. Nature, 2015, 517(7533): 209-213.
[11] CHEN S T, THOMAS S, GAFFNEY K J, et al. Cytotoxic effects of celecoxib on Raji lymphoma cells correlate with aggravated endoplasmic reticulum stress but not with inhibition of cyclooxygenase-2[J]. Leuk Res. 2010, 34(2): 250-253.
[12] GALLOUET A S, TRAVERT M, BRESSON-BEPOLDIN L, et al. COX-2-independent effects of celecoxib sensitize lymphoma B cells to TRAIL-mediated apoptosis[J]. Clin Cancer Res, 2014, 20(10): 2663-2673.
[13] 陈琛, 许文林, 秦茹娟, 等. 塞来昔布逆转MCF-7/Adr细胞多药耐药及其机制探讨[J]. 实用肿瘤杂志, 2009, 24(3): 237-242.
[14] LIU D B, LONG G X, MEI Q,et al. Anticancer effects of celecoxib through inhibition of STAT3 phosphorylation and AKT phosphorylation in nasopharyngeal carcinoma cell lines[J]. Pharmazie, 2014, 69(5): 358-361.
[15] NG S Y, DAVIDS M S. Selective Bcl-2 inhibition to treat chronic lymphocytic leukemia and non-Hodgkin lymphoma[J]. Clin Adv Hematol Oncol, 2014, 12(4): 224-229.
[16] LUSTBERG M B, POVOSKI S P, ZHAO W, et al. Phase Ⅱtrial of neoadjuvant exemestane in combination with celecoxib in postmenopausal women who have breast cancer[J]. Clin Breast Cancer, 2011, 11(4): 221-227.
[17] LEGGE F, PAGLIA A, D’ASTA M, et al. Phase Ⅱ study of the combination carboplatin plus celecoxib in heavily pretreated recurrent ovarian cancer patients[J]. BMC Cancer, 2011, 11: 214.
[18] JAMES N D, SYDES M R, MASON M D, et al. Celecoxib plus hormone therapy versus hormone therapy alone for hormonesensitive prostate cancer: first results from the STAMPEDE multiarm, multistage, randomised controlled trial[J]. Lancet Oncol, 2012, 13(5): 549-558.
[19] BERNARD M P, BANCOS S, SIME P J, et al. Targeting cyclooxygenase-2 in hematological malignancies: rationale and promise[J]. Curr Pharm Des, 2008, 14: 2051-2060.
[20] EL BARY N A, HASHEM T, METWALLY H, et al. A phaseⅡ study of high-dose celecoxib and metronomic ‘lowdose’ cyclophosphamide and methotrexate in patients with relapsed and refractory lymphoma[J]. Hematol Oncol Stem Cell Ther, 2010, 3(1): 13-18.
[21] NAKAMURA M, TAKAHASHI T, MATSUI H, et al. New pharmaceutical treatment of gastric MALT lymphoma: antiangiogenesis treatment using VEGF receptor antibodies and celecoxib[J]. Curr Pharm Des, 2014, 20(7): 1097-1103.
[22] REYNERS A K, DE MUNCK L, ERDKAMP F L, et al. A randomized phase Ⅱ study investigating the addition of the specific COX-2 inhibitor celecoxib to docetaxel plus carboplatin as first-line chemotherapy for stage ⅠCto Ⅳepithelial ovarian cancer, fallopian tube or primary peritoneal carcinomas: the DoCaCel study[J]. Ann Oncol, 2012, 23(11): 2896-2902.
Selective cyclooxygenase-2 inhibitor celecoxib could sensitize B-cell-originated lymphoma cell lines to epirubicin via down-regulation of MDR-1 mRNA and Bcl-2 mRNA expression
HUA Fanli1, WANG Lingyan2, ZHAO Xin1, LI Ying1, WU Yangjiong1, GAO Song1 (1. Department of Hematology, Jinshan Hospital, Fudan University, Shanghai 201508, China; 2. Biomedical Research Centre, Zhongshan Hospital, Fudan University, Shanghai 200032, China)
GAO Song E-mail: jsyyxyk2014@163.com
Background and purpose:It has been demonstrated that cyclooxygenase-2 (COX-2) is overexpressed in some subtypes of non-Hodgkin’s lymphoma (NHL), and COX-2 correlates with the expression of P-glycoprotein and Bcl-2, which may contribute to chemotherapy-resistance in NHL. The purpose of this study was to investigate the expression of COX-2 in B-cell lymphoma cell lines and the potential mechanisms of celecoxib, a selective COX-2 inhibitor, to sensitize lymphoma cell lines to epirubicin.Methods:Quantitative fluorescent realtime poly-chain-reaction (qRT-PCR) and Western blot were employed to determine the expression of COX-2 in Raji, Jeko-1 and Namalwa cell lines, as well as in peripheral blood B cells from normal controls. Cell lines were treated with celecoxib at gradient concentrations, followed by the detection of cell viabilities by cell counting kit-8 (CCK-8). Meanwhile, the changes in expression of MDR-1 mRNA and Bcl-2 mRNA before and after celecoxib treatment were determined by qRT-PCR. Raji cells were treated with epirubicin alone or in combination with gradient concentrations of celecoxib for 72 h, then CCK-8 was used to analyze whether celecoxib sensitize Raji cells to epirubicin.Results:Neither lymphoma cell lines nor normal B cells expressed detectable COX-2 in this study. Celecoxib inhibited the proliferation of the 3 lymphoma cell lines, and the mRNA expressions of MDR-1 and Bcl-2 were decreased by celecoxib in a concentration-dependent manner, except for that MDR-1 was undetectable in Jeko-1 cells. In addition, celecoxib sensitized Raji cells to epirubicin, indicating a synergistic anti-tumor effect between the two agents.Conclusion:Selective COX-2 inhibitor celecoxib down-regulates the expressions of MDR-1 mRNA and Bcl-2 mRNA in B-cell-originated lymphoma cell lines, and sensitizes Raji cells to epirubicin.
Cyclooxygenase-2; Celecoxib; Lymphoma; MDR-1 gene; Bcl-2 gene
10.3969/j.issn.1007-3969.2015.06.005
R733.4
A
:1007-3639(2015)06-0433-06
2014-12-05
2015-04-27)
上海市自然科学基金(13ZR1405700)。
高松 E-mail:jsyyxyk2014@163.com
