丹参酮ⅡA磺酸钠注射液对镉致肾损伤保护作用的实验研究*
2015-01-04魏长征吕晓云宋连猛裴海霞张倩倩
魏长征 吕晓云宋连猛 裴海霞 张倩倩 杨 杰
(兰州大学基础医学院中西医结合研究所,甘肃 兰州 730000)
·研究报告·
丹参酮ⅡA磺酸钠注射液对镉致肾损伤保护作用的实验研究*
魏长征 吕晓云△宋连猛 裴海霞 张倩倩 杨 杰
(兰州大学基础医学院中西医结合研究所,甘肃 兰州 730000)
目的观察丹参酮ⅡA磺酸钠注射液对镉致肾损伤的保护作用并探讨其可能的作用机制。方法40只Wistar大鼠随机分为空白组、模型组、亚硒酸钠组(0.05 mg/kg)、丹参酮低(4 mg/kg)、高(8 mg/kg)剂量组。镉染毒4周后,观察大鼠基本状况,检测大鼠血肌酐(Scr)、血尿素氮(BUN)、血清超氧化物歧化酶(SOD)、丙二醛(MDA)及其尿β2-微球蛋白(β2-MG)。于造模成功后,空白组、模型组给予腹腔注射0.9%氯化钠注射液,亚硒酸钠组给予腹腔注射亚硒酸钠溶液,丹参酮低、高剂量组分别给予4 mg/kg和8 mg/kg剂量丹参酮ⅡA磺酸钠注射液治疗。检测血液中的Scr、BUN、SOD、MDA、尿β2-MG含量,肾皮质、血、尿含镉量,肾脏皮质细胞凋亡率及Bax蛋白表达水平。结果染毒后模型组、亚硒酸钠组、丹参酮低剂量组、丹参酮高剂量组大鼠体质量、Scr、BUN、尿β2-MG、SOD及MDA与空白组差异有统计学意义(P<0.05或P<0.01)。采用丹参酮ⅡA-磺酸钠治疗后,丹参酮低剂量组、丹参酮高剂量组与模型组相比,血Scr、BUN、尿β2-MG、肾、血含镉量、MDA、SOD含量、肾脏皮质细胞凋亡率及Bax蛋白表达差异均有统计学意义(P<0.05或P<0.01)。结论丹参酮低、高剂量组对镉致肾脏损伤具有保护作用,其保护机制可能与抗氧化应激有关。
丹参酮 Ⅱ A磺酸钠 镉 肾损伤 凋亡 抗氧化应激
镉(Cd)是原子序列为48的一种重金属,可通过污染土壤、水源、空气的方式,经口、鼻、皮肤等途径在人体内蓄积,对肝、肾、肺等器官产生损伤。镉在人体内排泄缓慢,其半衰期约10~30年,为已知在体内最易蓄积的毒物[1-2]。镉进入人体后,约1/3~1/2的镉蓄积于肝和肾[3],其中肾脏是低剂量慢性镉中毒最重要的受损器官,研究证实镉诱导的肾损伤的主要作用部位是肾近曲小管,会影响肾小管的重吸收功能[4]。一般认为镉所致的肾损伤是不可逆的,目前无有效的治疗方法[5],但有业者认为随着镉的接触量和时间的减少或停止,肾损伤可以逐渐恢复[6]。究其肾毒性的机制,可能与氧化损伤、镉-钙的相互作用、引发肾脏细胞凋亡、诱导基因异常表达等方面有关。鉴于镉中毒的研究中,硒可有效拮抗镉致肾损伤,但由于其治疗量与中毒量很接近,尚不能满足临床应用。近年研究发现,丹参酮ⅡA磺酸钠注射液(STS)具有改善肾脏微循环、保护肾脏血管内皮细胞、清除氧自由基、抗脂质氧化、防治肾脏小球硬化等作用[7]。但有关STS防治镉致肾损伤研究未见报道,基于以上背景,笔者就STS对镉致肾损伤的作用及其机制进行研究。现报告如下。
1 材料与方法
1.1 试剂与药物 STS(上海第一生物药业有限公司),氯化镉(分析纯,天津市光复科技发展有限公司),亚硒酸钠(分析纯,上海中秦化学试剂有限公司)。血清超氧化物歧化酶(SOD)、丙二酫(MDA)试剂盒(南京建成生物工程研究所)。血肌酐(Scr)、尿素氮(BUN)试剂盒(南京建成生物工程研究所)。β2-微球蛋白(兰大一院送检),Bax蛋白一抗兔抗大鼠(bioworld公司)。清洁级wistar大鼠40只,雌雄各半,体质量(160±20)g,由兰州大学医学实验动物中心提供,合格证号:SCXK(甘)2009-0004。原子吸收法分光光度计石(德国耶拿分析仪器股份公司);721分光光度计 (上海菁华科技仪器有限公司);全自动生化分析仪(型号Cobas c31);流式细胞仪(美国Beekman coulter公司);显微镜(德国Olympus公司);超净工作台(苏净集团安泰公司)。
1.2 分组与给药 40只清洁级Wistar大鼠适应性喂养2周后,按随机数字表法随机分为空白组、模型组、亚硒酸钠组、丹参酮低剂量组、丹参酮高剂量组,每组8只,空白组腹腔注射0.9%氯化钠注射液,其余组腹腔注射氯化镉溶液1.4 mg/kg,每周7次,共4周。造模4周后,观察大鼠基本状况,检测大鼠Scr、BUN、SOD、MDA及尿β2-MG含量。造模成功后,空白组、模型组给予腹腔注射0.9%氯化钠注射液,亚硒酸钠组给予腹腔注射亚硒酸钠溶液0.05 mg/kg,丹参酮低、高剂量组分别给予STS 4 mg/kg、8 mg/kg治疗。实验末收取血、尿,并留取肾组织,检测Scr、BUN,SOD、MDA、尿β2-MG、肾皮质、血、尿镉含量、肾皮质细胞凋亡率及皮质Bax蛋白表达水平。
1.3 标本采集与检测 实验过程中,观察大鼠一般状况,每隔2周称量大鼠体质量,大鼠处死后取肾脏并称重,计算肾脏质量系数(mg/g)=(左侧肾脏质量+右侧肾脏质量)/2(mg)/大鼠体质量(g)。分别于大鼠造模后、处死前用代谢笼收集24 h尿液,大鼠禁食禁水,测量尿量;隔天禁食不禁水,收集尿液-80℃冰箱保存待测β2-MG及镉含量。分别于大鼠造模后、处死前,在乙醚麻醉下进行眼底静脉丛采集血样,静置1 h后,离心机转速3000 rpm离心10 min,按试剂盒说明使用全自动生化分析仪测定Scr、BUN含量,使用分光光度计测定SOD、MDA含量,使用原子吸收法分光光度计石墨炉法检测血镉含量。于治疗后,取血后行心脏0.9%氯化钠注射液灌流,迅速摘取右侧肾脏置于超净工作台,使用剪碎法收集细胞悬液,行流式细胞仪凋亡率检测。迅速摘取左侧肾脏,剥去包膜,行肾门纵切,一部分肾脏组织经4%多聚甲醛溶液固定,石蜡包埋,3 μm切片,免疫组化S-P法检测肾组织Bax蛋白表达。结果判断方法:每组8张切片,每片切片在400倍视野下随机选择4个视野,阳性细胞分为弱阳性和强阳性,弱阳性指浅染的棕黄色或黄色,强阳性指较深的棕黄色或黄色,分别计算Bax弱阳性表达率和强阳性表达率,然后将4个视野的结果求平均值。另一部分肾脏组织剪取皮质置于40 mL三角烧瓶中,加4 mL混合酸,烧瓶口覆以牛皮纸,浸泡过夜,至消化完全,置于电热板上加热,直至混合酸完全蒸发,加入5 mL蒸馏水,再次置于电热板上进行驱酸,最后稀释至10 mL,设定石墨炉法的工作条件,检测肾皮质镉含量。
1.4 统计学处理 应用SPSS19.0统计软件。计数资料以(±s)表示,各组采用单因素方差(one-way ANOVA)分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠治疗后体质量比较 见表1。经治疗后,模型组与空白组差异有统计学意义(P<0.05),但与亚硒酸钠、低、高剂量组差异无统计学意义(P>0.05)。
表1 各组大鼠不同阶段体质量、增加的体质量比较(g,±s)

表1 各组大鼠不同阶段体质量、增加的体质量比较(g,±s)
与空白对照组比较,*P<0.05。
组别 n空白组 8模型组 8亚硒酸钠组 8初始体质量 造模后体质量 治疗后体质量 体质量增加1 5 5 . 1 0 ± 1 2 . 3 0 2 0 8 . 1 0 ± 5 3 . 0 0 2 4 4 . 2 0 ± 5 8 . 9 0 8 3 . 8 0 ± 4 4 . 4 0 1 5 0 . 5 0 ± 8 . 5 0 1 6 4 . 0 0 ± 1 6 . 0 0 1 9 2 . 2 0 ± 3 4 . 1 0*4 0 . 2 0 ± 3 7 . 1 0*1 6 0 . 7 0 ± 1 6 . 8 0 1 6 5 . 3 0 ± 2 1 . 6 0 2 0 4 . 9 0 ± 2 5 . 8 0 4 8 . 6 0 ± 3 4 . 8 0丹参酮低剂量组 8 1 6 5 . 0 0 ± 1 9 . 1 0 1 7 4 . 9 0 ± 2 7 . 5 0 2 2 4 . 8 0 ± 3 1 . 3 0 6 1 . 3 0 ± 3 4 . 5 0丹参酮高剂量组 8 1 4 9 . 1 0 ± 8 . 5 0 1 6 7 . 9 0 ± 1 8 . 9 0 2 1 8 . 1 0 ± 3 2 . 1 0 6 9 . 0 0 ± 4 9 . 3 0
2.2 各组大鼠肾脏质量系数、尿量比较 见表2。大鼠肾脏质量系数模型组、亚硒酸钠组与空白组比较差异有统计学意义(P<0.01或P<0.05),丹参酮低、高剂量组与空白组相比差异无统计学意义(P>0.05),丹参酮高剂量组与模型组相比差异有统计学意义(P<0.01)。24 h尿量结果统计显示:治疗后模型组与空白组差异有统计学意义(P<0.01),丹参酮低、高剂量组与模型组差异有统计学意义(P<0.05)。
2.3 各组大鼠SOD、MDA含量比较 见表3。造模后模型组、亚硒酸钠组、丹参酮低、高剂量组血清SOD、MDA含量与空白组差异有统计学意义 (P<0.01),治疗后丹参酮低、高剂量组血清SOD、MAD含量与模型组差异有统计学意义(P<0.01或P<0.05)。
表2 各组大鼠肾脏质量系数、24 h尿量比较(±s)
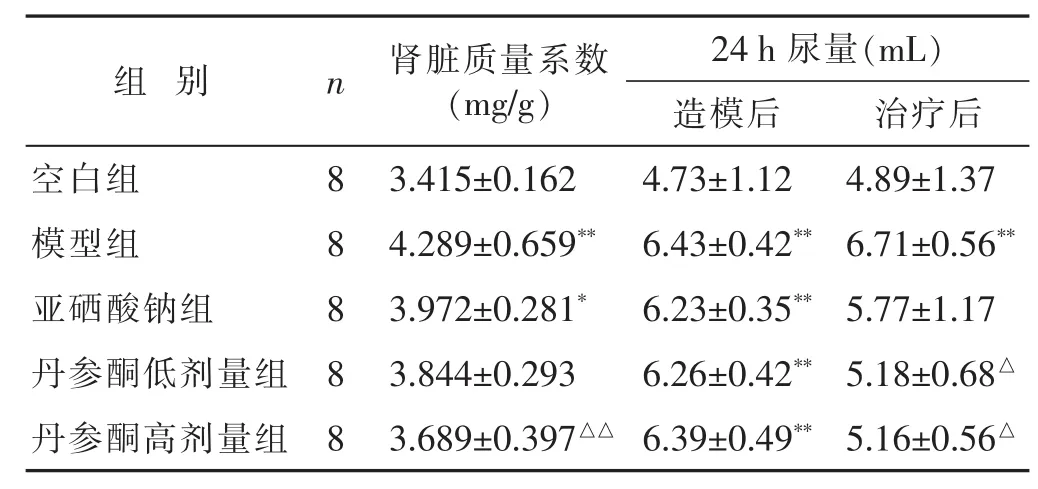
表2 各组大鼠肾脏质量系数、24 h尿量比较(±s)
与空白组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.01,△△P<0.05。下同。
肾脏质量系数(m g / g)组别n 治疗后2 4 h尿量(m L)造模后3 . 4 1 5 ± 0 . 1 6 2 4 . 7 3 ± 1 . 1 2 4 . 2 8 9 ± 0 . 6 5 9**6 . 4 3 ± 0 . 4 2**亚硒酸钠组 8 5 . 7 7 ± 1 . 1 7空白组 8 4 . 8 9 ± 1 . 3 7模型组 8 6 . 7 1 ± 0 . 5 6**3 . 9 7 2 ± 0 . 2 8 1*6 . 2 3 ± 0 . 3 5**丹参酮低剂量组 8 3 . 8 4 4 ± 0 . 2 9 3 6 . 2 6 ± 0 . 4 2**5 . 1 8 ± 0 . 6 8△丹参酮高剂量组 8 3 . 6 8 9 ± 0 . 3 9 7△△6 . 3 9 ± 0 . 4 9**5 . 1 6 ± 0 . 5 6△
表3 各组大鼠造模后与治疗后SOD、MDA比较(±s)
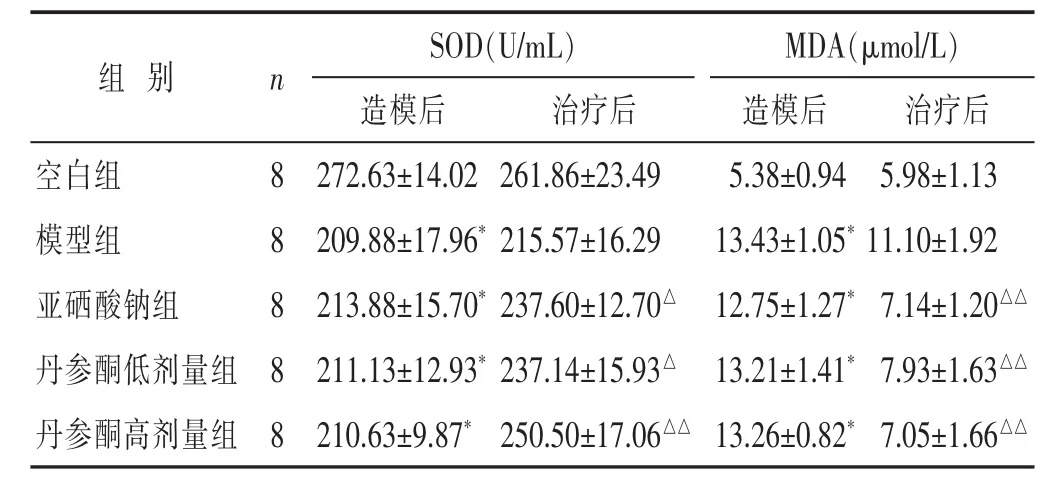
表3 各组大鼠造模后与治疗后SOD、MDA比较(±s)
M D A(μ m o l / L)造模后 治疗后5 . 3 8 ± 0 . 9 4 5 . 9 8 ± 1 . 1 3 1 3 . 4 3 ± 1 . 0 5*1 1 . 1 0 ± 1 . 9 2亚硒酸钠组 8 2 1 3 . 8 8 ± 1 5 . 7 0*2 3 7 . 6 0 ± 1 2 . 7 0△1 2 . 7 5 ± 1 . 2 7*7 . 1 4 ± 1 . 2 0△△丹参酮低剂量组 8 2 1 1 . 1 3 ± 1 2 . 9 3*2 3 7 . 1 4 ± 1 5 . 9 3△1 3 . 2 1 ± 1 . 4 1*7 . 9 3 ± 1 . 6 3△△丹参酮高剂量组 8 2 1 0 . 6 3 ± 9 . 8 7*2 5 0 . 5 0 ± 1 7 . 0 6△△1 3 . 2 6 ± 0 . 8 2*7 . 0 5 ± 1 . 6 6△△组别 n空白组 8模型组 8 S O D(U / m L)造模后 治疗后2 7 2 . 6 3 ± 1 4 . 0 2 2 6 1 . 8 6 ± 2 3 . 4 9 2 0 9 . 8 8 ± 1 7 . 9 6*2 1 5 . 5 7 ± 1 6 . 2 9
2.4 各组大鼠Scr、BUN、β2-MG比较 见表4。治疗后Scr、BUN、β2-MG丹参酮高剂量组与模型组差异有统计学意义(P<0.01或P<0.05),亚硒酸钠组、丹参酮低、高剂量组BUN含量与模型组差异有统计学意义(P<0.01)。
表4 各组大鼠造模后与治疗后Scr、BUN、β2-MG比较(±s)
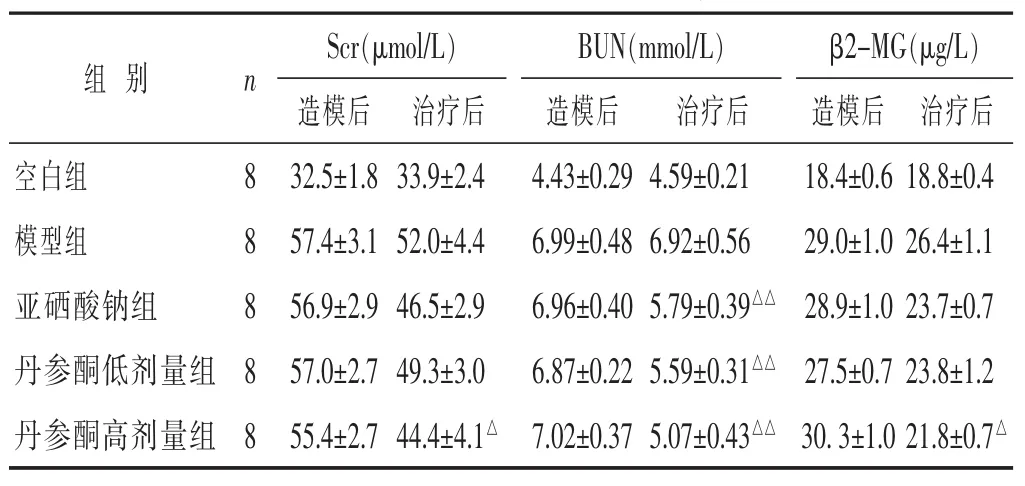
表4 各组大鼠造模后与治疗后Scr、BUN、β2-MG比较(±s)
S c r(μ m o l / L) B U N(m m o l / L) β 2 -M G(μ g / L)造模后 治疗后 造模后 治疗后 造模后 治疗后空白组 8 3 2 . 5 ± 1 . 8 3 3 . 9 ± 2 . 4 4 . 4 3 ± 0 . 2 9 4 . 5 9 ± 0 . 2 1 1 8 . 4 ± 0 . 6 1 8 . 8 ± 0 . 4模型组 8 5 7 . 4 ± 3 . 1 5 2 . 0 ± 4 . 4 6 . 9 9 ± 0 . 4 8 6 . 9 2 ± 0 . 5 6 2 9 . 0 ± 1 . 0 2 6 . 4 ± 1 . 1亚硒酸钠组 8 5 6 . 9 ± 2 . 9 4 6 . 5 ± 2 . 9 6 . 9 6 ± 0 . 4 0 5 . 7 9 ± 0 . 3 9△△2 8 . 9 ± 1 . 0 2 3 . 7 ± 0 . 7丹参酮低剂量组 8 5 7 . 0 ± 2 . 7 4 9 . 3 ± 3 . 0 6 . 8 7 ± 0 . 2 2 5 . 5 9 ± 0 . 3 1△△2 7 . 5 ± 0 . 7 2 3 . 8 ± 1 . 2丹参酮高剂量组 8 5 5 . 4 ± 2 . 7 4 4 . 4 ± 4 . 1△7 . 0 2 ± 0 . 3 7 5 . 0 7 ± 0 . 4 3△△3 0 . 3 ± 1 . 0 2 1 . 8 ± 0 . 7△组别 n
2.5 各组大鼠细胞凋亡率比较 见表5。模型组与空白组相比早、晚、总凋亡率明显升高(P<0.01),亚硒酸钠组晚、总凋亡率与空白组差异有统计学意义 (P<0.05),但丹参酮低、高剂量组与空白组早、晚、总凋亡率差异无统计学意义(P>0.05)。其余各组早期凋亡率和总凋亡率与模型组差异有统计学意义(P<0.01),丹参酮高剂量组与模型组晚期凋亡率差异有统计学意义(P<0.05)。
表5 各组肾皮质细胞凋亡率比较(%,±s)

表5 各组肾皮质细胞凋亡率比较(%,±s)
与空白组比较,*P<0.05;与模型组比较,△P<0.05,△△P<0.01。下同。
组别 n 总凋亡率空白组 8 1 . 5 3 ± 0 . 2 9模型组 8 2 2 . 3 2 ± 2 . 9 7**亚硒酸钠组 8 9 . 8 7 ± 6 . 1 3△△早期凋亡率 晚期凋亡率0 . 0 4 ± 0 . 0 4 1 . 5 0 ± 0 . 2 6 9 . 0 5 ± 2 . 3 0**1 3 . 2 6 ± 0 . 8 6**1 . 2 5 ± 0 . 8 8△△8 . 6 2 ± 2 . 2 9丹参酮低剂量组 8 8 . 2 6 ± 6 . 1 3 0 . 8 5 ± 0 . 8 5 7 . 4 1 ± 5 . 3 0丹参酮高剂量组 8 0 . 5 2 ± 0 . 4 9 5 . 5 5 ± 3 . 9 7 6 . 0 7 ± 4 . 4 4△
2.6 各组血、尿、肾皮质镉含量比较 见表6。血、肾皮质含镉量的模型组、亚硒酸钠组、丹参酮低、高剂量组及尿含镉量的模型组、亚硒酸钠组含镉量与空白组比差异有统计学意义(P<0.01)。肾皮质含镉量高剂量组与空白组差异有统计学意义(P<0.05)。血含镉量丹参酮高剂量组及肾皮质含镉量亚硒酸钠组、丹参酮低、高剂量组与模型组差异有统计学意义(P<0.01)。尿含镉量亚硒酸钠组、丹参酮低、高剂量组与模型组差异无统计学意义(P>0.05)。
表6 各组大鼠血、尿、肾皮质镉含量比较(±s)
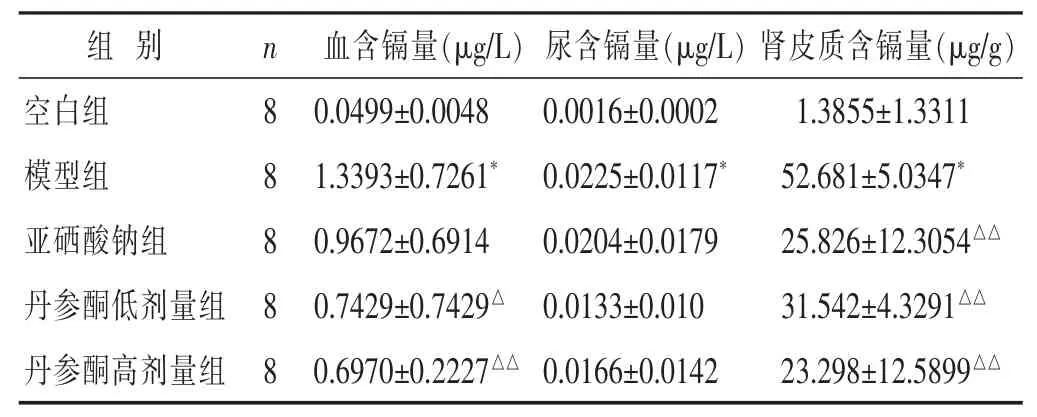
表6 各组大鼠血、尿、肾皮质镉含量比较(±s)
组别 n 肾皮质含镉量(μ g / g)空白组 8 1 . 3 8 5 5 ± 1 . 3 3 1 1模型组 8 5 2 . 6 8 1 ± 5 . 0 3 4 7*亚硒酸钠组 8 2 5 . 8 2 6 ± 1 2 . 3 0 5 4△△血含镉量(μ g / L)尿含镉量(μ g / L)0 . 0 4 9 9 ± 0 . 0 0 4 8 0 . 0 0 1 6 ± 0 . 0 0 0 2 1 . 3 3 9 3 ± 0 . 7 2 6 1*0 . 0 2 2 5 ± 0 . 0 1 1 7*0 . 9 6 7 2 ± 0 . 6 9 1 4 0 . 0 2 0 4 ± 0 . 0 1 7 9丹参酮低剂量组 8 3 1 . 5 4 2 ± 4 . 3 2 9 1△△0 . 7 4 2 9 ± 0 . 7 4 2 9△0 . 0 1 3 3 ± 0 . 0 1 0丹参酮高剂量组 8 0 . 6 9 7 0 ± 0 . 2 2 2 7△△0 . 0 1 6 6 ± 0 . 0 1 4 2 2 3 . 2 9 8 ± 1 2 . 5 8 9 9△△
2.7 两组肾组织免疫组化比较 肾皮质Bax蛋白弱阳性表达结果显示,空白组、丹参酮ⅡA高剂量组与镉染毒模型组相比较,镉染毒模型组Bax蛋白弱阳性表达率为(22.80±1.90)%,分别强于空白组与丹参酮高组的(7.90±1.30)%、(18.50±6.20)%(P<0.01)。而亚硒酸钠组、丹参酮ⅡA低剂量组与镉染毒模型组相比,差异无统计学意义(P>0.05)。肾皮质Bax蛋白强阳性表达结果显示,镉染毒模型组Bax蛋白强阳性表达率为(18.30±1.70)%,并且明显高于其他组(P<0.01)。
3 讨 论
上述镉致肾损伤机制中,氧化损伤的机制研究最为明确。大量研究显示,大鼠镉染毒后,其功能损伤明显,超微结构出现病理损伤,线粒体、溶酶体等细胞器严重受损,血清及肾脏中SOD、GSH-Px活性明显下降,氧自由基生成显著升高[8],这是由于镉可以通过增强脂质过氧化的产生及改变细胞内的抗氧化系统的方式,从而诱导不同组织的氧化损伤[9],提示在镉致肾脏损伤的过程中,氧自由基的生成及由此引起的脂质氧化反应可能起着重要作用。
丹参具有活血化瘀等功效。近年对丹参药理作用的研究取得了较大突破,研究报道丹参具有清除自由基和抗脂质氧化、减轻缺血组织再灌注损伤、抗肝肾损伤及肝肾间质纤维化等作用[10]。丹参酮ⅡA磺酸钠作为从丹参中提取出的主要有效的药理成分,已被证实具有较强的清除自由基和抗脂质氧化作用。丹参酮ⅡA是一种有效的细胞内脂质过氧化产物与DNA互相作用的抑制药,其保护机制可能与清除脂类自由基,阻断脂质过氧化的链式反应,从而抑制DNA加成物的生成以减少细胞毒性有关[11]。
本实验结果显示,染毒后大鼠体质量明显低于空白组。血清SOD显著降低,血清MDA明显升高,SOD是生物体内重要的抗氧化酶,可以清除氧自由基,进而阻断氧自由基对细胞的损伤,并可恢复氧自由基对细胞造成的损伤。MDA是自由基引发的脂质过氧作用的最终分解产物,其含量可间接反映机体脂质过氧化的水平,血清SOD、MDA含量的异常,提示了氧化损伤可能是镉致肾脏损伤的重要机制之一。Scr、BUN都是主要经由肾小球滤过排出体外,Scr、BUN升高提示肾脏实质受到损伤,其机制可能与镉致肾小管上皮细胞损伤有关,肾小管上皮损伤后可导致其管腔狭窄,相应的阻力又会使肾小球滤过率下降。β2-MG可以从肾小球自由滤过,大部分在近端小管被重吸收,β2-MG明显升高提示镉诱导的慢性中毒损伤的主要部位是肾脏的近端小管。总之,以腹腔注射氯化镉溶液(1.4 mg/kg),每周7次,共4周的大鼠镉染毒方法,可致大鼠肾脏损伤。
治疗后模型组肾脏质量系数明显高于丹参酮低、高剂量组,提示STS对肾脏有保护作用。大鼠禁食禁水24 h,检测大鼠严重缺水的情况下肾小管的重吸收能力,丹参酮低、高剂量组尿量有所升高,但与空白组相比,其差异无统计学意义,提示STS对镉致肾小管损伤有一定的保护作用。STS治疗后丹参酮低、高剂量组Scr、BUN含量,肾皮质细胞凋亡率,提示STS可以有效改善镉致肾损伤大鼠的肾功能。作为人体中重要的抗氧化酶SOD及其自由基引发的脂质过氧作用的最终分解产物MDA,受STS干预治疗后,低、高剂量组SOD含量明显上升、MDA明显下降,提示STS可以有效清除氧自由基。检测各组大鼠血、肾皮质含镉量,给药组镉含量明显低于模型组,而尿镉含量未见明显降低,可能与镉从肾脏排出进入尿液有关,提示STS可以加速大鼠体内镉代谢。STS、亚硒酸钠干预镉致肾损伤大鼠后,结果显示,肾脏组织细胞中Bax蛋白显著降低,证明STS、亚硒酸钠干预镉致肾毒性有效,但以丹参酮高剂量组效果显著。
综上所述,STS具有较强的清除氧自由基和抗脂质氧化作用,并可加速大鼠体内镉代谢、改善肾功能、保护肾小管,并且丹参酮高剂量组疗效优于低剂量组和亚硒酸钠组。STS改善镉致肾损伤机制可能与其有效清除氧自由基、抗脂质氧化作用有关。相关研究提出药物调节Bax、Bcl-2基因表达,也是干预重金属致肾损伤的机制之一[12],尚待进一步深入研究。
[1] Fukumoto M,Kujiraoka T,Hara M,et al.Effect of cadmium on gap junctional intercellular communication in primary cultures of rat renal proximal tubular cells[J].Life Sci,2001,69(3):247-254.
[2] 毛伟平,许锋,石晓娟,等.镉诱导HEK293细胞胞内钙稳态的失调引发细胞凋亡[J].中国药理学与毒理学杂志,2004,18(2):103-108.
[3] 刘茂生.有害元素镉与人体健康[J].微量元素与健康研究,2005,22(4):66-67.
[4] Piscator M.Long-term observations on tubular and glomerular function in cadmium-exposed persons[J].Environ Health Perspect,1984,54(8):175-179.
[5] 余日安.镉与DNA损伤、癌基因表达、细胞凋亡[J].国外医学:卫生学分册,2000,27(6):359-363.
[6] Nomiyama K,Nomiyama H,Kameda N.Plasma cadmiummetallothionein,a biological exposure index for cadmiuminduced renal dysfunction,based on the mechanism of its action[J].Toxicology,1998,129(2):157-168.
[7] 于敏,王姣,史耀勋,等.丹参酮ⅡA磺酸钠注射液治疗慢性肾衰竭的可能机制探[J].中国中医急症,2009,18(5):743-744,783.
[8] 刘爱萍,赵金垣,刘亚宁,等.氧自由基在急性镉中毒性肾损伤中的作用[J].中华劳动卫生职业病杂志,1998,16(1):24-27.
[9] Stohs SJ,Bagchi D,Hassoun E,et al.Oxidative mechanisms in the toxicity of chromium and cadmium ions[J].J Environ Pathol Toxicol Oncol,2000,19(3):201-213.
[10]李文喆,王勇,姚世芳.丹参药用成分研究进展[J].人民军医,2008,51(3):180-182.
[11]吴百灵.丹参对 CCl-4所致急性肝损伤保护作用的研究[J].中医药学刊,2002,20(3):363-381.
[12]吕晓云,滕玉莲,赵健雄,等.扶正解毒颗粒对染镍大鼠肾细胞凋亡及Bax、Bcl-2表达的影响[J].时珍国医国药,2011,22(8):1884-1885.
The Protective Effect of Tanshinone Ⅱ A Sulfonic Acid Sodium Injection on Cadmium Induced Renal Damage
WEI Changzheng,LV Xiaoyun,SONG Lianmeng,et al. Institute of Integrated Chinese and Western Medicine,Lanzhou University,Lanzhou,Gansu 730000,China
Objective:To investigate the protective effect of Tanshinone Ⅱ A sulfonic acid sodium injection(STS)on Cadmium induced renal damage and its possible mechanism.Methods:40 wistar rats were randomly divided into the sham group,model group,sodium selenite group(0.05 mg/kg),STS group(4 mg/kg),STS group(8 mg/kg).After exposed cadmium for 4 weeks,the basic condition of rats,Scr,BUN,SOD,MDA and β2-MG were observed.After the success of the modeling,the sham group and model group were intraperitoneally injected with 0.9%sodium chloride,while the sodium selenite group was intraperitoneally injected with Sodium selenite solution,and the STS group(4 mg/kg and 8 mg/kg)was intraperitoneally injected with different doses of STS.At the end of the test,the Scr,BUN,SOD,MDA in the blood and β2-MG in the urine were detected.The cadmium content in the Renal cortex,blood,urine and Bax were measured.Flow cytometry was used to measure Cell apoptosis in Renal cortex.Results:The basic condition,Scr,BUN,SOD,MDA,β2-MG in different groups had statistical differences.After compared with model group,in the STS group (4 mg/kg and 8 mg/kg)Scr,BUN,β2-MG,cadmium content,MDA,kidney Cell apoptosis and the expression of Bax protein were significantly reduced,and SOD increased significantly.Conclusions:Cadmium induced renal damage can be reduced by the STS group(4 mg/kg and 8 mg/kg).Its protection mechanism may be associated with the antioxidant abitity.
Tanshinone Ⅱ A sulfonic acid sodium;Cadmium;Kidney damage;Apoptosis;Antioxidant abitity
R285.5
A
1004-745X(2015)06-0984-04
10.3969/j.issn.1004-745X.2015.06.016
2015-03-20)
兰州市科技发展项目(No.2012-1-24)
△通信作者(电子邮箱:776802750@qq.com)
