丙烯酰胺对睾丸间质细胞R2C活性及孕酮合成功能的影响
2015-01-03李名薇孙建霞邹飞雁朱翠娟胡云峰欧仕益冯梦鸽白卫滨
李名薇,孙建霞,许 伟,邹飞雁,*,白 顺,朱翠娟,胡云峰,焦 睿,吴 实,欧仕益,冯梦鸽,白卫滨,*
丙烯酰胺对睾丸间质细胞R2C活性及孕酮合成功能的影响
李名薇1,孙建霞2,许 伟1,邹飞雁1,*,白 顺1,朱翠娟1,胡云峰1,焦 睿1,吴 实1,欧仕益1,冯梦鸽1,白卫滨1,*
(1.暨南大学理工学院食品科学与工程系,生命科学技术学院,第一附属医院,广东 广州510632;2.广东工业大学轻工化工学院,广东 广州510006)
目的:研究丙烯酰胺(acrylamide,AA)对体外培养的睾丸间质细胞R2C生长及孕酮合成功能的影响。方法:用浓度为0.25、0.5、0.75、1、2、4、6 mmol/L的AA作用于R2C细胞24 h,四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)法获得IC25、IC50及IC75的AA作用浓度。用以上3种浓度的AA处理R2C细胞24 h,观察细胞形态。AA作用于R2C细胞4 h后,通过彗星实验(Comet assay)检测细胞DNA的损伤程度;放射免疫法(radioimmunoassay,RIA)测定AA处理R2C细胞4 h和24 h后的孕酮合成量。结果:AA能抑制R2C细胞活性,其IC25、IC50、IC75分别为1.140、1.925、3.250 mmol/L;3种浓度的AA能不同程度地影响R2C细胞生长形态;作用4 h对R2C细胞DNA有损伤作用;各浓度组作用24 h后均能降低R2C细胞的孕酮合成量。结论:AA能影响R2C细胞增殖及孕酮合成能力。
丙烯酰胺;R2C细胞;细胞活性;DNA损伤;孕酮
丙烯酰胺(acrylamide,AA)是一种广泛存在于常见食品及工业生产中的化学物质[1-3],它被认为是一种对人类有潜在致癌作用的物质[4]。2002年4月,瑞典国家食品管理局宣布在富含碳水化合物,如薯片、咖啡、烤面包等的热处理过程中会产生大量的丙烯酰胺[5-6],这一发现引起了广泛关注。据报道,丙烯酰胺具有基因毒性、神经毒性及生殖毒性等,对人类具有致癌的危害性[7-8]。Yang等[9]通过大鼠实验发现,较低剂量的AA即可抑制睾丸内精子的生成,影响大鼠的生殖功能,然而 其造成雄性生殖毒性的具体机制还不确定。本研究通过探索丙烯酰胺对体外大鼠睾丸间质细胞R2C的毒性损伤情况,探讨其引起生殖毒性的机制,为丙烯酰胺的安全性评估提供一定依据。
1 材料与方法
1.1材料、试剂与仪器
R2C细胞,由暨南大学生物医药中心实验室提供。
AA(CAS登录号:79-06-01,纯度98%) 德州市富凯化工有限责任公司;F12培养液、马血清 美国Life公司;胎牛血清、胰酶 美国Gibco公司;二甲基亚砜(dimethy l sulfoxide,DMSO)、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT) 美国Amresco公司;低熔点琼脂糖、正常熔点琼脂糖 美国FMC公司;Tris、乙二胺四乙酸二钠(ethylene diamine tetraacetic acid disodium salt,EDTA-Na2)、聚乙二醇辛基苯基醚(Triton X-100) 美国Genview公司;孕酮放射免疫试剂盒 北方生物技术研究所。
37℃细胞培养箱、酶标仪 美国Thermo公司;低温离心机 金坛市富华仪器公司;GC-1200γ放射免疫计数仪科大创新股份中佳公司。
1.2方法
1.2.1 MTT法检测AA对R2C细胞活性的影响
将生长对数期的R2C细胞接种于96孔板,每孔200μL悬液,4×103个细胞。24 h后,加入无血清F12培养液稀释的浓度为0.25、0.5、0.75、1、2、4、6 mmol/L的AA,每组3个复孔,并设置无细胞的空白组(只加200μLF12培养液)和对照组(加200μL细胞悬液,不加AA),重复3次。作用24 h后,每孔加10μL5 mg/mL的MTT试剂,放于37 ℃培养箱。4 h后,去除液体,加200μLDMSO,置于脱色摇床摇动10 min,于酶标仪570 nm波长处检测吸光度,按照下式计算AA对R2C细胞活性的抑制率。

式中:A0、A1、A2分别为空白组、AA给药组、对照组的吸光度。
将得到的数据通过Graphpad软件分析AA作用的IC25、IC50和IC75。
1.2.2倒置显微镜观察AA对R2C形态的影响
将R2C细胞以1×106个/mL的浓度接种于6孔板,加入IC25、IC50和IC75浓度的AA作用24 h后,用倒置显微镜观察细胞并拍照。
1.2.3彗星实验(Comet assay)检测AA对R2C细胞DNA的损伤
R2C细胞生长至对数期后,将细胞以1×105个/mL的浓度接种于6孔板。培养24 h,分别加入IC25、IC50和IC75浓度的AA作用于细胞。4 h后将对照组及经过3种浓度AA处理的R2C细胞消化、离心后,磷酸盐缓冲液(phosphate buffered saline,PBS)清洗1遍。
将细胞重悬于0.8%的低熔点琼脂糖(low melting agarose,LMP)中,取100μL到已预涂了一层正常熔点琼脂糖的载玻片上,然后在最上层再加一层LMP。待琼脂糖凝固后,将载玻片置于裂解液(0.1 mol/L EDTA-Na2、2.5 mol/L NaCl、10 mmol/L Tris、体积分数1%的Triton X-100、体积分数10%的DMSO,临用前配制,pH 10.0)中,5℃处理1 h。将载玻片放在碱性电泳缓冲液(0.3 mol/L NaOH、1 mmol/L EDTA-Na2,pH 13.6)中处理20 min。碱性条件下(pH 13.6)进行电泳(25 V、20 min)。电泳结 束后,用pH 7.5的Tris-HCl溶液将载玻片洗3次,每次5 min。用20μL25μg/mL的溴化乙锭(ethidium bromide,EB)对DNA染色,盖上盖玻片。荧光显微镜拍照,CASP软件分析电泳检测结果。
1.2.4放射免疫法(radioimmunoassav,RIA)检测AA对R2C细胞孕酮合成量的影响
将对数生长期的R2C细胞调整浓度为106个/mL,接种到6孔板,每孔1 mL。24 h后加入AA浓度为IC25、IC50和IC75的培养液。4 h或24 h后收集上清液,并保存于-20 ℃。按孕酮放射免疫试剂盒说明书方法进行孕酮合成量的测定。
1.3统计学分析
2 结果与分析
2.1 AA对R2C细胞生长的抑制作用
由图1可知,AA对R2C细胞活性的抑制率随其浓度的增加而升高。通过Graghpad软件分析得到AA对R2C细胞的IC25、IC50、IC75分别为1.140、1.925、3.250 mmol/L。

图1 不同浓度AA对R2C细胞的生长抑制率Fig.1 Inhibitory ratios of AA on the growth of R2C cells

图2 不同浓度AA作用24 h后的R2C细胞形态(×400)Fig.2 Morphological changes of R2C cells after being exposed tovarious concentrations of AA for 24 h (× 400)
由图2可知,浓度分别为1.140、1.925、3.250 mmol/L(IC25、IC50、IC75)的AA作用24 h后,R2C细胞变小,形状由不规则多边形变为椭圆形,细胞数目减少且贴壁能力降低,且AA对R2C细胞生长的抑制作用呈现剂量依赖性。
2.2 AA对R2C细胞DNA损伤的作用

图3 不同浓度AA刺激4 h后R2C细胞的尾部DNA含量Fig.3 Tail DNA content in R2C cells after being exposed to AA for 4 h
由图3~5可知,与对照组相比,不同浓度的AA作用于R2C细胞4 h后,细胞拖尾现象显著增加。R2C细胞的尾部DNA含量、尾长及Olive尾距(Olive tail moment,OTM)均随AA浓度增加而增大,尤其当AA浓度为1.925、3.250 mmol/L(IC50、IC75)时,其尾部DNA含量、尾长和OTM分别增加了1 166.6%、1 776.7%,106.4%、295.7%和329.3%、476.9%,结果较对照组具有统计学意义(P<0.05或P<0.01),表明AA可以诱导R2C细胞产生DNA损伤。

图4 不同浓度AA刺激4 h后R2C细胞的尾长Fig.4 Tail length of R2C cells after being exposed to AA for 4 h

图5 不同浓度AA刺激4 h后R2C细胞的Olive尾距Fig.5 Olive tail moment of R2C cells after being exposed to AA for 4 h
2.3 AA对R2C细胞孕酮合成量的影响
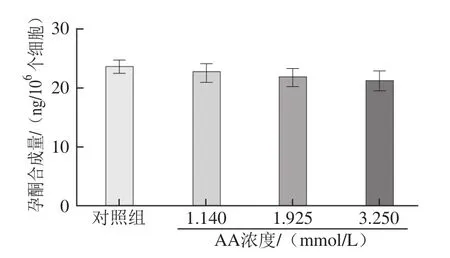
图6 不同浓度AA作用4 h后对R2C细胞孕酮合成量的影响Fig.6 Effect of AA exposure for 4 h on progesterone biosynthesis of R2C cells

图7 不同浓度AA作用24 h后对R2C细胞孕酮合成量的影响Fig.7 Effect of AA exposure for 24 h on progesterone biosynthesis of R2C cells
孕酮合成量检测结果表明,AA作用R2C细胞4 h后,各AA浓度组细胞的孕酮合成量与对照组相比无明显差异(图6)。AA继续作用R2C细胞24 h后,各AA浓度组细胞的孕酮合成量显著降低,与对照组相比分别降低了19.5%、28.6%及34.2%(图7),且均具有统计学意义(P<0.05或P<0.01),且随着AA作用浓度增加,抑制效果更加明显。
3 讨 论
研究报道丙烯酰胺具有遗传毒性、神经毒性和生殖毒性[10]。多项研究结果表明,AA能够对动物生殖器官产生毒性作用[11-12],并证明AA是通过干扰类固醇激素的合成来影响动物的生殖功能[13]。Chen等[14]研究表明,AA能够损伤大鼠睾丸,引起生殖功能的下降,但未通过体外细胞实验对其进行研究。从大鼠体内分离睾丸间质原代细胞程序复杂,并且不能传代培养,限制了其作为评估模型的应用[15],而R2C细胞是一个能在无激素刺激条件下持续大量分泌孕酮的睾丸间质细胞株,且具有无限传代的能力,可作为一种快速评价雄性生殖毒性的细胞模型[16-17]。故本研究以睾丸间质细胞R2C为体外实验对象,通过检测细胞的生物活性及功能等来探讨AA的毒性作用。
目前对AA体外生殖毒理的研究还比较少,因此本实验AA刺激剂量的选择主要是参考Mehri等[18]研究AA体外神经毒性的数据,进而确定AA刺激剂量范围以探讨其生殖毒性作用。实验结果显示,AA能够抑制R2C细胞的活性、影响细胞的正常生长状态,且上述抑制效果与AA的作用剂量成正相关。因此,AA可能通过抑制生殖细胞的活性来干扰生殖系统的功能。单细胞电泳结果表明,AA可以诱导R2C细胞发生明显的DNA损伤。有研究表明,DNA损伤能够引发细胞凋亡,降低细胞活力甚至导致细胞死亡[19-20]。由此推测,AA对R2C细胞生长的抑制作用可能与其诱导细胞DNA损伤有关。类固醇激素对于维持动物生殖功能起着重要的作用[21],睾丸间质细胞最主要的功能是分泌睾酮[22],而孕酮是睾酮合成的前体物,是其合成通路中最重要的中间产物,睾丸间质细胞模型R2C细胞株由于17β-羟化酶功能损坏、17β-羟类固醇脱氢酶缺失导致其仅能分泌孕酮,通过检测孕酮水平可间接反映睾酮的分泌量[23-24],所以将睾酮合成的前体物质——孕酮作为评价生殖功能的指标。有研究显示[25],体外培养睾丸间质细胞,在4 h时睾酮分泌量达到最大,考虑时间依赖的影响,本实验选取4 h和24 h两个时间点进行研究。结果发现,AA作用于R2C细胞4 h后对孕酮合成量无明显影响,作用24 h后与对照组相比,3种浓度的AA均能引起R2C细胞孕酮合成量显著降低,且AA浓度越大,降低程度越明显。该结果说明,AA能造成R2C细胞孕酮合成功能下降,进而能够影响睾酮的合成,且抑制呈时间-剂量依赖性。
根据上述结果可以推测,AA可能是通过损伤睾丸间质细胞DNA,造成相关蛋白合成受阻,从而影响细胞孕酮合成功能的下降或细胞活性下降,而细胞活性的下降可能也会影响细胞正常功能的发挥,最终导致生殖系统功能下降。下一步拟通过对孕酮合成途径中某些关键蛋白及其mRNA表达水平的研究来探讨AA毒性作用的具体机制,为阐明AA影响睾丸间质细胞功能的机理研究提供依据。
[1] 解瑞丽, 周启星. 丙烯酰胺的环境暴露, 生态行为与毒理效应研究进展[J]. 生态学杂志, 2013, 32(5)∶ 1347-1354.
[2] FRIEDMAN M. Chemistry, biochemistry, and safety of acrylamide. A review[J]. Journal of Agricultural and Food Chemistry, 2003, 51( 16)∶4504-4526.
[3] GARGAS M L, KIRMAN C R, SWEENEY L M, et al. Acrylamide∶consideration of species differences and nonlinear processes in estimating risk and safety for human ingestion[J]. Food and Chemical Toxicology, 2009, 47(4)∶ 760-768.
[4] KLAUNIG J E. Acrylamide carcinogenicity[J]. Journal of Agricultural and Food Chemistry, 2008, 56(15)∶ 5984-5988.
[5] 郑宗平, 秦川, 兰山, 等. 食品体系中丙烯酰胺的研究进展∶ 抑制剂及其抑制机理[J]. 食品科学, 2014, 35(1)∶ 282-288. doi∶ 10.7506/ spkx1002-6630-201401056.
[6] CLAUS A, CARLE R, SCHIEBER A. Acrylamide in cereal products∶a review[J]. Journal of Cereal Science, 2008, 47(2)∶ 118-133.
[7] PARK J, KAMENDULIS L M, FRIEDMAN M A, et al. Acrylamideinduced cellular transformation[J]. Toxicological Sciences, 2002, 65(2)∶ 177-183.
[8] WANG Hao, HUANG Pan, LIE Tietao, et al. Reproductive toxicity of acrylamide-treated male rats[J]. Reproductive Toxicology, 2010, 29(2)∶ 225-230.
[9] YANG H J, LEE S H, JIN Y, et al. Toxicological effects of acrylamide on rat testicular gene expression profile[J]. Reproductive Toxicology, 2005, 19(4)∶ 527-534.
[10] 李栋, 金成, 汤谷平, 等. 丙烯酰胺代谢机理及其体内毒性防护的研究进展[J]. 中国食品学报, 2011, 11(4)∶ 139-146.
[11] LEE J G, WANG Y S, CHOU C C. Acrylamide-induced apoptosis in rat primary astrocytes and human astrocytoma cell lines[J]. Toxicology in Vitro, 2014, 28(4)∶ 562-570.
[12] CAMACHO L, LATENDRESSE J R, MUSKHELISHVILI L, et al. Effects of acrylamide exposure on serum hormones, gene expression, cell proliferation, and histopathology in male reproductive tissues of Fischer 344 rats[J]. Toxicology Letters, 2012, 211(2)∶ 135-143.
[13] CENGIZ M F, G☒ND☒Z C P B. Acrylamide exposure among Turkish toddlers from selected cereal-based baby food samples[J]. Food and Chemical Toxicology, 2013, 60∶ 514-519.
[14] CHEN J H, YANG C H, WANG Y S, et al. Acrylamide-induced mitochondria collapse and apoptosis in human astrocytoma cells[J]. Food and Chemical Toxicology, 2013, 51∶ 446-452.
[15] SUN Jianxia, BAI Shun, BAI Weibin, et al. Toxic mechanisms of 3-monochloropropane-1,2-diol on progesterone production in R2C rat leydig cells[J]. Journal of Agricultural and Food Chemistry, 2013, 61(41)∶ 9955-9960.
[16] ZHANG Qihao, ZOU Ping, ZHAN Haichao, et al. Dihydrolipoamide dehydrogenase and cAMP are associated with cadmium-mediated leydig cell damage[J]. Toxicology Letters, 2011, 205(2)∶ 183-189.
[17] 管永波, 郝鹏飞, 唐春宇, 等. 氟化钠对小鼠睾丸间质瘤细胞StAR和P450scc mRNA表达的影响[J]. 卫生研究, 2012, 41(1)∶ 105-108.
[18] MEHRI S, ABNOUS K, MOUSAVI S H, et al. Neuroprotective effect of crocin on acrylamide-induced cytotoxicity in PC12 cells[J]. Cellular and Molecular Neurobiology, 2012, 32(2)∶ 227-235.
[19] ROOS W P, KAINA B. DNA damage-induced cell death by apoptosis[J]. Trends in Molecular Medicine, 2006, 12(9)∶440-450.
[20] NIXON B J, STANGER S J, NIXON B, et al. Chronic exposure to acrylamide induces DNA damage in male germ cells of mice[J]. Toxicological Sciences, 2012, 129(1)∶ 135-145.
[21] STOUT E P, la CLAIR J J, SNELL T W, et al. Conservation of progesterone hormone function in invertebrate reproduction[J]. Proceedings of the National Academy of Sciences, 2010, 107(26)∶11859-11864.
[22] 张杨杨. 以线粒体为靶点研究重金属铅对睾丸间质细胞损伤的毒理作用机制[D]. 广州∶ 暨南大学, 2013∶ 2-4.
[23] 白顺, 孙建霞, 白卫滨, 等. 1,3-二氯-2-丙醇对睾丸间质细胞R2C活性及孕酮合成的影响[J]. 食品科学, 2013, 34(9)∶ 292-295. doi∶10.7506/spkx1002-6630-201309059.
[24] SUN Jianxia, BAI Shun, BAI Weibin, et al. 1,3-Dichloro-2-propanol inhibits progesterone production through the expression of steroidogenic enzymes and cAMP concentration in leydig cells[J]. Food Chemistry, 2014, 154∶ 330-336.
[25] 王丽蕃. 藏党参中主要活性成分的测定及其多糖对睾丸间质细胞影响的研究[D]. 北京∶ 中央民族大学, 2009∶ 33-34.
Effect of Acrylamide on the Viability and Progesterone Biosynthesis Function of Rat R2C Leydig Cells
LI Mingwei1, SUN Jianxia2, XU Wei1, ZOU Feiyan1,*, BAI Shun1, ZHU Cuijuan1, HU Yunfeng1, JIAO Rui1,
WU Shi1, OU Shiyi1, FENG Mengge1, BAI Weibin1,*
(1. The First Affiliated Hospital, College of Life Science and Technology, Department of Food Science and Engineering, College of Science and Engineering, Jinan University, Guangzhou 510632, China; 2. Faculty of Chemical Engineering and Light Industry, Guangdong University of Technology, Guangzhou 510006, China)
Objective∶ To examine the effect of acrylamide (AA) on cell growth and progesterone synthesis in rat R2C cells. Methods∶ R2C cells were treated with AA at concentrations of 0.25, 0.5, 0.75, 1, 2, 4 and 6 mmol/L, respectively. Three inhibitory concentrations (IC25, IC50and IC75) were determined by MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide) assay. Cell morphology was observed after being sti mulated by the three inhibitory concentrations of AA for 24 h. DNA damage in R2C cells was measured by comet assay. The amounts of progesterone biosynthesis after being exposured to AA for 4 h and 24 h were detected by radioimmunoassay (RIA). Results∶ AA could inhibit the cell viability. The IC25, IC50and IC75were determined to be 1.140, 1.925 and 3.250 mmol/L, respectively. At these three concentrations, AA could affect cell morphology to different extends. DNA was significantly damaged at three concentrations of AA for 4 h, whereas the progesterone levels were significantly reduced after being exposed to AA for 24 h. Conclusion∶ AA can inhibit the cell growth and reduce the progesterone synthesis of R2C cells.
acrylamide; R2C cell; cell activity; DNA damage; progesterone
Q26
1002-6630(2015)17-0247-05
10.7506/spkx1002-6630-201517046
2015-04-16
广东省高等学校优秀青年教师培养计划项目(Yq2013024);教育部“新世纪优秀人才支持计划”项目;
国家自然科学基金青年科学基金项目(31201402;31201340)
李名薇(1989—),女,硕士研究生,研究方向为生殖毒性评价。E-mail:limingwei_2008@163.com
*通信作者:邹飞雁(1963—),女,副教授,博士,研究方向为生殖与发育。E-mail:zoufeiyan6364@yahoo.com.cn
白卫滨(1978—),男,副研究员,博士,研究方向为食品营养与毒理安全性评价。E-mail:baiweibin@163.com
