中国葡萄酒产区酒酒球菌种质资源遗传多样性分析
2015-01-03金刚,王华,2,3,张昂,李华,2,3,*
金 刚,王 华,2,3,张 昂,李 华,2,3,*
中国葡萄酒产区酒酒球菌种质资源遗传多样性分析
金 刚1,王 华1,2,3,张 昂4,李 华1,2,3,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.西北农林科技大学,合阳葡萄试验示范站,陕西 合阳 715300;3.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100;4.秦皇岛出入境检验检疫局,河北 秦皇岛 066004)
为了解我国葡萄酒产区酒酒球菌种质资源遗传多样性,对22株筛选自我国不同葡萄酒产区的乳酸细菌进行了种特异性聚合酶链式反应(species-specific polymerase chain reaction,PCR)分析、16S rRNA序列分析和扩增片段长度多态性分析(amplified fragment length polymorphism,AFLP)基因分型。种特异性PCR和16S rRNA序列分析表明22株分离株为酒酒球菌(Oenococcus oeni)。建立了O. oeni基于HindⅢ和MseⅠ为内切酶的AFLP分析体系,对16对引物组合进行了筛选,结果表明HT-MA、HT-MT、HT-MC、HG-MA、HG-MT、HC-MT为O. oeniAFLP分析的最佳引物组合,且实验重复性在98%以上。对O. oeni的AFLP分析结果显示:22株O. oeni分为3个簇群,且簇群间遗传相似性系数较小。所以,以HindⅢ和MseⅠ为内切酶的AFLP技术是研究O. oeni基因分型的有效方法,我国葡萄酒产区的O. oeni具有丰富的遗传多样性,O. oeni菌株间的遗传相似性系数不仅仅与其生态地理分布有关,可能还与其所处的微生态和其他因素有关。
酒酒球菌;种特异性PCR;16S rRNA序列分析;扩增片段长度多态性分析技术
苹果酸-乳酸发酵(malolactic fermentation,MLF)是葡萄酒酿造过程中基本的生物化学过程,它发生于酒精发酵之后,细菌把苹果酸转化成乳酸和二氧化碳[1]。酒酒球菌(Oenococcus oeni)被认为是MLF的主要完成者,它能降低葡萄酒的酸度、改善葡萄酒的质量和增强稳定性[2]。
随着我国葡萄酒产业的发展壮大,葡萄酒产业已开始由单一的饮料葡萄酒到饮料葡萄酒和酒庄葡萄酒共同发展的局面。酒庄酒不仅对葡萄酒的质量有较高要求,而且突出了对葡萄酒个性风格的要求,葡萄酒的个性风格是葡萄酒对不同产地的包括酿酒微生物的风土条件的总体反映。所以,自然发酵和筛选当地微生物进行接种发酵对于酿造高品质的酒庄酒有重要意义。O. oeni在葡萄酒中的活性依赖于它对葡萄酒恶劣生境(高酸、高SO2含量、高酒精体积分数)的耐受性[1,3]。不同的菌株对于逆境的适应性不同。我国葡萄酒产区分布比较广泛,各产区生态地理条件差异很大,必然蕴含着丰富和多样性的O. oeni种质资源。因此,分离筛选我国葡萄酒产区O. oeni,研究它们的遗传多样性及其与生态地理分布的关系对于我国葡萄酒的生产具有重要意义。
分子生物学的发展使得微生物的分类鉴定变得更为高效和可靠。目前,各种分子生物学方法已广泛应用于微生物的分类鉴定。不同种类的乳酸菌可能存在于同一发酵过程中,所以对于乳酸菌种水平上的鉴定是必要的。近年来,16S rRNA测序[4-5]、16S~23S rRNA间隔区序列分析[6-7]、种特异性聚合酶链式反应(species-specific polymerase chain reaction,PCR)技术[4-5,8-9]被广泛应用于O. oeni的鉴定。
对于O. oeni菌株的基因分型,只有对于基因型微弱差异敏感的分子标记方法才能完成。这些分子标记方法包括随机扩增多态性DNA-PCR(random amplified polymorphic DNA-PCR,RAPD-PCR)[10-11],多位点序列分析(multiple locus sequence typing,MLST)[12-13],脉冲电场凝胶电泳(pulsed field gel electrophoresis,PFGE)[14],扩增片段长度多态性分析技术(amplified fragment length polymorphism,AFLP)[5,15-16]。它们已被越来越多地应用于O. oeni及其他乳酸细菌的分类鉴定研究中。
AFLP是基于对基因组限制性酶切片段选择性PCR扩增结果分析的基础上来对不同基因组进行分型的技术[17]。AFLP结合了限制性片段长度多态性分析技术(restriction fragment length polymorphism,RFLP)和RAPD两种技术的优点,被认为是目前最有效最理想的一种DNA分子标记技术。但它在葡萄酒微生物研究中仍然较少应用。目前,在对O. oeni的基因分型研究时仍然应用的是经典的EcoRⅠ和MseⅠ内切酶组合,本研究采用HindⅢ和MseⅠ两种内切酶组合,以期较好的将AFLP应用于O. oeni基因研究中。
1 材料与方法
1.1菌株与培养基
供试菌株是分别从山东青岛(SD-1a、SD-1b、SD-1c、SD-1d、SD-1e、SD-1f、SD-1g)、山东烟台(SD-2a、SD-2b、SD-2d、SD-2ee、SD-2gf、SD-2gh、SD-2h、SD-2ji、SD-2kj)、河北沙城(HB-1a、HB-1b、HB-1c、HB-2b)、陕西杨凌(SX-1a、SX-1b)等地的葡萄酒中分离、初步鉴定得到的22株O. oeni。本实验收集了1株O. oeni的标准菌株作为阳性对照,它是酒酒球菌31-DH,由中国食品发酵工业研究院提供。另外还收集了一株嗜酸乳杆菌(中国工业微生物菌种保藏管理中心,编号6005)作为阴性对照菌株,用于O. oeni的鉴定。
O. oeni的培养采用ATB培养基:蛋白胨10 g/L、酵母浸出物5 g/L、葡萄糖10 g/L、MgSO40.2 g/L、MnSO40.05 g/L、盐酸半胱氨酸0.5 g/L,番茄汁250 mL/L,调节pH值至4.8,ATB固体培养基中加20 g/L的琼脂,121℃灭菌15 min。
嗜酸乳杆菌的培养采用MRS培养基:蛋白胨10 g、酵母提取物5 g、牛肉膏10 g、葡萄糖20 g、乙酸钠5 g、柠檬酸二铵2 g、吐温-80 1 mL、MgSO40.58 g、MnSO40.05 g、K2HPO42 g,水1 000 mL。固体培养基加琼脂粉17 g,121℃,1×105Pa灭菌20 min。
1.2试剂与仪器
DNA聚合酶 日本TaKaRa公司;内切酶HindⅢ、MseⅠ,T4 DNA连接酶Fermentas公司;DNA聚合酶天根生化科技(北京)有限公司。
凝胶成像分析系统 英国Syngene公司;Veriti梯度基因扩增仪 美国ABI公司;NanoDrop1000核酸蛋白测定仪 美国Thermo公司;JY 3000型电泳仪、JY-CX 2B型测序电泳槽 北京君意东方电泳设备有限公司。
1.3方法
1.3.1细菌的培养
1.3.1.1O. oeni的培养
固体培养:在28℃厌氧箱培养箱中充CO2培养,培养时间为5~7 d。液体培养:28℃静置培养72 h。
1.3.1.2嗜酸乳杆菌的培养
固体培养:培养皿密封、倒置于37℃恒温培养箱培养30 h。液体培养:37℃静置培养48 h[18]。
1.3.2细菌总DNA的提取
参照文献中的十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)法和溶菌酶法[19]。
1.3.3O. oeni的种特异性PCR扩增
参照Zapparoli等[8]设计的引物On1:5’-TAATGTGG TTCTTGAGGAGAAAAT-3’和On2:5’-ATCATCGTCAAA CAAGAGGCCTT-3’,引物由生工生物工程(上海)股份有限公司合成。反应体系(2 0 ☒L):10×PCR Buffer 2.0 ☒L,dNTPs 1.6 ☒L(2.5 mmol/L),Mg2+1.6 ☒L(25 mmol/L),上下游引物各0.8 ☒L(10 ☒mol/L),模板DNA 1.0 ☒L,DNA聚合酶0.1 ☒L(5 U/☒L),加ddH2O至终体积为20 ☒L。反应条件:94℃预变性2 min;94℃变性45 s,64℃退火2 min,72℃延伸2 min,30个循环。最后72℃延伸10 min。PCR产物上样到1.0%的琼脂糖凝胶上100 V电压下电泳40 min,溴化乙锭染色,用凝胶成像分析系统照相。
1.3.4细菌16S rRNA序列分析
参照Klijn等[20]的引物P1(41~60:5’-GCGGCGTG C C T A A T A C A T G C-3’)和P 3(6 8 6~7 0 5:5’-ATCTACGCATTTCACCGCTA-3’),引物由生工生物工程(上海)股份有限公司合成。反应体系(50 ☒L):10×PCR Buffer 5.0 ☒L、dNTPs 4 ☒L(2.5 mmol/L)、Mg2+5 ☒L(25 mmol/L)、上下游引物各5 ☒L(10 ☒mol/L)、模板DNA 2.0 ☒L、DNA聚合酶0.3 ☒L(5 U/☒L),加ddH2O至终体积为50 ☒L。反应条件:94℃预变性5 min;94℃变性1 min,50℃退火1 min,72℃延伸1.5 min,35个循环;最后72℃延伸10 min。PCR产物琼脂糖凝胶电泳检测后对合格样品送南京金斯瑞生物科技有限公司进行纯化和测序。
1.3.5O. oeniAFLP分析方法的建立
1.3.5.1 DNA提取方法的建立
DNA模板的纯度和质量对AFLP的成功起着关键作用,实验中优化和比较了CTAB法和溶菌酶法两种常见的细菌DNA提取方法。
1.3.5.2双酶切反应体系的建立
通过实验优化,获得了O. oeni的HindⅢ和MseⅠ酶切和连接反应体系:在20 ☒L反应体系中加入约200 ng基因组DNA、5 UMseⅠ和2 ☒L 10×Buffer R,65℃酶切4 h,冷却后加入10 UHindⅢ、MseⅠ接头(5’-GACGATGAGTCCTGAG-3’;5’-TACT CAGGACTCAT-3’)各0.5 ☒L(10 ☒mol/L)、HindⅢ接头(5’-CTCGTAGACTGCGTACC-3’;5’-AGCTGGTACGCAGTC-3’)各0.25 ☒L(10 ☒mol/L)、1 ☒L ATP、10 U T4 DNA连接酶、1 ☒L Buffer R、3 ☒L T4 DNA连接酶Buffer,加ddH2O至30 ☒L,37℃酶切链接4 h。产物稀释5倍用于预扩增反应。
1.3.5.3 PCR扩增反应体系优化
通过实验优化反应条件得到的预扩增反应体系(25 ☒L):10×PCR Buffer 2.5 ☒L、d N T P s 0.5 ☒L(2.5 m m o l/L)、引物H 0(5’-G A C T G C G T A C C A G C T T-3’)1 ☒L(10 ☒mol/L)、M0(5’-GATGAGTCCTGAGTAA- 3’)1 ☒L(10 ☒mol/L)、模板4 ☒L(酶切连接产物稀释5倍)、D N A聚合酶0.6 ☒L(2.5 U/☒L)。反应条件:94℃2 min;94℃30 s,56℃60 s,72℃1 min,30个循环;最后72℃延伸7 min。预扩增产物稀释20倍用于选择性扩增。
通过实验优化反应条件得到的选择性扩增反应体系(25 ☒L):10×PCR Buffer 2.5 ☒L、dNTPs 0.5 ☒L(2.5 mmol/L)、引物Hx 1 ☒L(10 ☒mol/L)、My 1 ☒L(10 ☒mol/L)(引物组合见表2)、模板2.0 ☒L(预扩增产物稀释20倍)、DNA聚合酶0.6 ☒L(2.5 U/☒L)。反应条件:94℃2 min,66℃30 s(每个循环下降1℃),72℃2 min,10个循环。然后94℃20 s,56℃20 s,72℃2 min,20个循环。最后60℃延伸30 min。
1.3.5.4选择性扩增产物的聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)与银染
选择性扩增产物加入1/3体积的变性上样缓冲液(98%去离子甲酰胺、10 mmol/L pH 8.0乙二胺四乙酸、0.25%溴酚蓝、0.25%二甲苯氰)混匀后95℃变性5 min,立即置于冰上。取5 ☒L样品于6%的PAGE上80 W恒功率进行电泳检测,电泳结束后采用硝酸银染色法显色[21]。
1.3.5.5O. oeniAFLP引物组合的筛选
为筛选出O. oeniAFLP扩增效率高、多态性好的引物组合,16对引物组合被用于O. oeni菌株的扩增和分析。比较不同引物组合扩增的条带数以及多态性位点数。
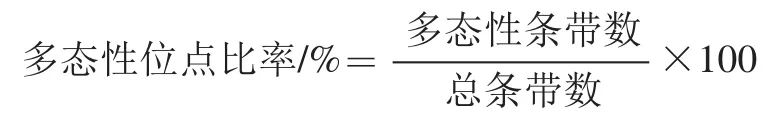
1.3.5.6中国葡萄酒产区筛选的O. oeni的AFLP分析
对从我国葡萄酒主产区筛选的22株O. oeni菌株进行AFLP分析,了解我国葡萄酒产区酒酒球菌的遗传多样性。
1.4数据分析
对变性聚丙烯酰胺凝胶电泳图谱中扩增的条带进行人工统计,按照等位基因有条带的记为1,无条带的记为0的方法,将AFLP指纹图谱转换成1和0构成的数字矩阵,输入到Microsoft Excel表格中。用NTSYS 2.10软件进行数据分析,用软件中的SHAN程序和非加权配对算术平均法(unweighted pair-group method with arithmetic means,UPGMA)进行聚类分析,生成22株O. oeni遗传相似性系数表,并通过系统发育树生成聚类图。
2 结果与分析
2.1细菌的种特异性PCR鉴定
依据Zapparoli等[8]设计的引物,22株菌株都能扩增得到一条长1 025 bp的片段(图1),阴性对照嗜酸乳杆菌(Lactobacillus acidophilus)不能扩增出条带。

图1 222 株O..oeni的种特异性PPCCRR鉴定Fig.1 Identification of 22 O. oeni by species-specific PCR
2.2细菌的16S rRNA序列分析
使用扩增细菌16S rRNA基因序列41~705 bp的一对引物,对22株细菌进行16S rRNA测序,分析测序报告并完成序列处理,得到约600 bp的细菌16S rRNA基因序列。将这些序列与GenBank数据库里的O. oeni菌株IOB 8413(登录号:AJ831548)的16S rRNA基因序列进行比较,同源性为99.8%~100%。通过利用序列分析软件ClustalX 1.83进行比对分析22株分离菌及O. oeniIOB 8413的16S rRNA基因的73~650 bp序列,发现除SD-2d在76~77 bp处插入了碱基“C”外,其余碱基全部相同。这说明O. oeni种内菌株间16S rRNA基因差异小。
种特异性PCR和16S rRNA基因序列分析表明22 株细菌为O. oeni。
2.3O. oeniAFLP分析方法的建立
2.3.1适于O. oeniAFLP分析的DNA提取方法的建立

表1 两种DNA提取方法所得DNA质量浓度和纯度的比较Table1 Concentrations and purities of DNA samples extracted by two different methods

图2 O. oeni oeni两种提取方法提取的DNA的PAGE结果AGEFig.2 Electrophoresis photograph of O. oeni DNA extracted by two different methods
本研究优化并比较了溶菌酶法和CTAB法两种方法对O. oeniDNA的提取效果,结果表明溶菌酶法提取的O. oeniDNA浓度高、纯度较差;CTAB法提取的DNA浓度低、纯度很好(表1,图2)。对于AFLP技术,酶切连接的效果直接决定了AFLP是否成功,由于后续需要对基因组DNA进行酶切链接,DNA提取物里的杂质会严重影响酶切连接效果,所以高纯净度的基因组DNA对于AFLP的成功与否是起决定性作用的。而且,AFLP技术不需要很高的模板浓度,所以CTAB法提取的基因组DNA可适用于AFLP分析,后续的研究也表明CTAB法提取的基因组DNA酶切连接效果比溶菌酶法更稳定。
2.3.2O. oeniAFLP分析引物组合的筛选

表2 16 对引物组合的序列及其相应的O. oeni AFLP扩增总条带数和多态性比率Table2 Average number of fragments and polymorphism bands obtained from 16 pairs of selective primers and sequences to detect AFLPs among O. oeni strains isolated from Chinese wines
16对引物被用于O. oeni的AFLP分析,结果表明不同引物组合扩增得到的总条带数和多态性条带数差别很大。引物组合中HT-MA、HG-MA、HC-MA、HA-MT、HC-MT能够扩增出最多的总条带数,其中HC-MA扩增的条带最多,达到最多70条,HC-MG扩增的总条带数最少,最少为21条。引物组合HT-MC、HT-MA、HT-MT、HG-MT、HC-MT、HA-MG、HG-MG具有较高的多态性位点比率,其中HT-MC多态性位点比率最高达到52.9%,HA-MA多态性位点比率最低,最低达到10%。综合分析总条带数和多态性位点比率,引物组合HT-MA、HT-MT、HT-MC、HG-MA、HG-MT、HC-MT为O. oeniAFLP分析的最佳引物组合(表2)。重复性实验表明,这些引物组合在O. oeniAFLP分析中的重复性为98%以上。
2.3.3中国葡萄酒产区筛选的O. oeni的AFLP分析
引物组合HC-MT被用于22株O. oeni的AFLP分析。由图3可知,22株O. oeni的最小遗传相似系数仅为0.45,表明不同产区O. oeni的种内遗传多样性丰富。在相似性系数0.565处,22株O. oeni可分为3个簇群,第一簇群包括:HB-1a、SD-1g、SX-1a、HB-2b、SX-1b、SD-2ji、SD-1f、SD-1c、SD-2kj、SD-1b、HB-1c分离自河北、陕西、山东的11株O.oeni菌株。这些菌株间的遗传相似性系数差异很大,遗传多样性丰富,其中HB-1a、SD-1g、SX-1a、HB-2b、SX-1b具有较高的相似性形成一个亚簇,且亚簇内菌株间遗传相似性系数差异也较大;第二簇群包括:SD-2gh、SD-2gf、SD-1a、SD-2d、SD-1e、HB-1b、SD-2b、SD-2a、SD-1d、SD-2ee分离自河北、山东的10株O. oeni,菌株间遗传相似性系数差异小,遗传多样性单一;第三簇群仅有SD-2h一株,其与其他两个簇群的相似系数仅有0.45。研究结果表明AFLP在O. oeni基因分型研究中具有很高的分辨率。

图3 中国葡萄酒产区O. oeni的AFLP指纹图谱聚类分析Fig.3 UPGMA dendrogram derived from AFLP patterns of 22 O. oeni isolated from Chinese wines
3 讨 论
本研究采用了目前最为高效和可靠的方法对从中国葡萄酒产区分离的22株O. oeni进行了鉴定。同时首次发展了采用HindⅢ和MseⅠ两种限制性内切酶进行酶切的高重现性的O. oeni的AFLP分析方法。
种特异性PCR和16S rRNA序列分析相结合是目前从种的水平上对O. oeni进行鉴定最高效和可靠的方法,被广泛应用于O. oeni的鉴定。Lòpez等[22]从204株葡萄酒分离菌株中鉴定得到201株O. oeni;Cappello等[5]从葡萄酒中分离得到220株乳酸菌,鉴定出其中87株为O. oeni。本研究从107株葡萄酒分离菌株中鉴定得到22株O. oeni。
由于O. oeni菌株间差异较小,所以灵敏并且可靠的菌株区分方法对于O. oeni的分类鉴定非常重要。一些经典的分子生物学方法已经被应用于O. oeni的分类鉴定研究中。在这些方法中,PFGE显示出强大的菌株区分能力[23-24],但是PFGE对操作者的技术和设备有较高要求,而且其工作量很大,这些限制了其的广泛应用[25-26]。RAPD技术快速、实验成本低并且容易操作,然而PCR扩增的固有缺陷使得RAPD的实验结果在不同实验室间重现性差[17,27]。AFLP是一项非常有用的技术,它集合了PFGE和RAPD的优点,被证明是细菌包括乳酸菌种内菌株间基因分型的最佳技术[26,28-29]。到目前为止,在有限的O. oeniAFLP研究中仍然使用传统的EcoRⅠ和MseⅠ两种内切酶,但研究表明,EcoRⅠ和MseⅠ作为识别富含A+T序列的内切酶,更适用于分析G+C含量低的基因组DNA。在常用的限制性内切酶中,HindⅢ显示出适用于消化G+C含量在40%~50%(物质的量百分比)左右的基因组DNA,MseⅠ则被选用于消化G+C含量低于50%的基因组DNA,O. oeni基因组的G+C含量在40%左右,所以HindⅢ和MseⅠ会是分析O. oeni基因组的完美组合。研究结果也表明以HindⅢ和MseⅠ为内切酶的O. oeniAFLP分析技术具有高扩增效率、高分辨率、高重现性的特点,而且以聚丙烯酰胺凝胶电泳和银染体系作为检测手段的AFLP技术对设备要求不高,适合于绝大多数实验室应用。
目前,AFLP的检测手段已发展为毛细管电泳检测,采用专门的软件进行数据分析,这大大提高了AFLP分析的效率,所以以HindⅢ和MseⅠ为内切酶的AFLP分析技术是分析O. oeni遗传多样性的有效工具。
本研究中,22株O. oeni菌株可分为3个簇群,第一簇群包含的菌株最多,簇群内菌株间遗传多样性丰富,可能跟菌株来源的多样性有关(分别来源河北、陕西、山东)。第二簇群内菌株间遗传多样性单一,可能跟菌株来源单一有关(90%来源于山东)。第三簇群只有一株来源于山东烟台的SD-2h,其与其他21株菌株之间遗传相似性系数较低,遗传距离较远,说明来源于同一地区的菌株间也有可能遗传差异很大,可能跟葡萄与葡萄酒微生态有相关性。
葡萄酒酒精发酵结束后,不同品种,甚至于不同发酵罐的葡萄酒酒精体积分数、温度、营养物质都不尽相同,这些微生态环境会影响葡萄酒中细菌的种类、数量、细菌不同基因的表达等,进而影响葡萄酒的品质。所以需要更深入的研究来揭示生态地理和葡萄酒生态与酿酒微生物之间的关系。
参考文献:
[1] 李华. 现代葡萄酒工艺学[M]. 2版. 西安∶ 陕西人民出版社, 2000∶68-80.
[2] CLAIRE L M, ELISABETH B, ALINE L F. Tolerance to high osmolality of the lactic acid bacterium Oenococcus oeni and identification of potential osmoprotectants[J]. International Journal of Food Microbiology, 2007, 115(3)∶ 335-342.
[3] RENOUF V, DELAHERCHE A, CLAISSE O, et al. Correlation between indigenous Oenococcus oeni strain resistance and the presence of genetic markers[J]. Journal of Industrial Microbiology & Biotechnology, 2008, 35(1)∶ 27-33.
[4] du PLESSIS H W, DICKS L M T, PRETORIUS I S, et al. Identification of lactic acid bacteria isolated from South African brandy base wines[J]. International Journal of Food Microbiology, 2004, 91(1)∶ 19-29.
[5] CAPPELLO M S, STEFANI D, GRIECO F, et al. Genotyping by amplified fragment length polymorphism and malate metabolism performances of indigenous Oenococcus oeni strains isolated from Primitivo wine[J]. International Journal of Food Microbiology, 2008, 127(3)∶ 241-245.
[6] ZAVALETA A J, MARTINEZ-MURCIA A J, RODRI GUEZVALERA F. Intraspecific genetic diversity of Oenococcus oeni as derived from DNA fingerprinting and sequence analyses[J]. Applied and Environmental Microbiology, 1997, 63(4)∶ 1261-1267.
[7] HIRSCHH☒USER S, FR☒HLICH J, GNEIPEL A, et al. Fast protocols for the 5S rDNA and ITS-2 based identification of Oenococcus oeni[J]. FEMS Microbiology Letters, 2005, 244(1)∶ 165-171.
[8] ZAPPAROLI G, TORRIANI S, PESENTE P, et al. Design and evaluation of malolactic enzyme gene targeted primers for rapid identification and detection of Oenococcus oeni in wine[J]. Letters in Applied Microbiology, 1998, 27(5)∶ 243-246.
[9] MARIA A S, MARIA G B, GIOVANNI S. Isolation and characterization of Oenococcus oeni from Aglianico wines[J]. World Journal of Microbiology & Biotechnology, 2008, 24(9)∶ 1829-1835.
[10] ZAPPAROLI G, REGUANT C, BORDONS A, et al. Genomic DNA fingerprinting of Oenococcus oeni strains by pulsed-field gel electrophoresis and randomly amplified polymorphic DNA-PCR[J]. Current Microbiology, 2000, 40(6)∶ 351-355.
[11] LI Hua, ZHANG Chunhui, LIU Yanlin. Species attribution and distinguishing strains of Oenococcus oeni isolated from Chinese wines[J]. World Journal of Microbiology & Biotechnology, 2006, 22(5)∶ 515-518.
[12] de las RIVAS B, MARCOBAL A, MU☒OZ R. Allelic diversity and population structure in Oenococcus oeni as determined from sequence analysis of housekeeping genes[J]. Applied and Environmental Microbiology, 2004, 70(12)∶ 7210-7219.
[13] DELAHERCHE A, BON E, DUP☒ A, et al. Intraspecific diversity of Oenococcus oeni strains determined by sequence analysis of target genes[J]. Applied Microbiology and Biotechnology, 2006, 73(2)∶ 394-403.
[14] MELANIE L, HARALD C, HELMUT K. Pulsed-field gel electrophoresis for the discrimination of Oenococcus oeni isolates from different wine-growing regions in Germany[J]. International Journal of Food Microbiology, 2008, 123(1/2)∶ 171-176.
[15] CAPPELLO M S, ZAPPAROLI G, STEFANI D, et al. Molecular and biochemical diversity of Oenococcus oeni strains isolated during spontaneous malolactic fermentation of Malvasia Nera wine[J]. Systematic and Applied Microbiology, 2010, 33(8)∶ 461-467.
[16] CAPPELLO M S, STEFANI D, LOGRIECO A, et al. Bio-molecular characterisation of indigenous Oenococcus oeni strains from Negroamaro wine[J]. Food Microbiology, 2014, 42∶ 142-148.
[17] VOS P, HOGERS R, BLEEKER M, et al. AFLP∶ a new technique for DNA fingerprinting[J]. Nucleic Acids Research, 1995, 23(21)∶4407-4414.
[18] 张帆, 王建华, 刘立恒, 等. 嗜酸乳杆菌的培养条件及其生物学特性[J].食品与发酵工业, 2005, 31(3)∶ 43-46.
[19] 金刚. 中国葡萄酒主产区酒酒球菌的鉴定及SE-AFLP分析[D]. 杨凌∶ 西北农林科技大学, 2010∶ 17.
[20] KLIJN N, WEERKAMP A H, de VOS W G. Detection and characterization of lactose utilizing Lactococcus subsp. in natural ecosystems[J]. Applied and Environmental Microbiology, 1995, 61(2)∶788-792.
[21] 卢圣栋. 现代分子生物学实验技术[M]. 2版. 北京∶ 中国协和医科大学出版社, 1999∶ 101-104.
[22] L☒PEZ I, TENORIO C, ZARAZAGA M, et al. Evidence of mixed wild populations of Oenococcus oeni strains during wine spontaneous malolactic fermentation[J]. European Food Research and Technology, 2007, 226(1/2)∶ 215-223.
[23] LECHIANCOLE T, BLAIOTTA T, MESSINA D, et al. Evaluation of intra-specific diversities in Oenococcus oeni through analysis of genomic and expressed DNA[J]. Systematic and Applied Microbiology, 2006, 29(5)∶ 375-381.
[24] VIGENTINI I, PICOZZI C, TIRELLI A, et al. Survey on indigenous Oenococcus oeni strains isolated from red wines of Valtellina, a cold climate wine-growing Italian area[J]. International Journal of Food Microbiology, 2009, 136(1)∶ 123-128.
[25] GIAMMANCO G M, MAMMINA C, ROMANI C, et al. A Evaluation of a modified single-enzyme amplified fragment length polymorphism (SE-AFLP) technique for subtyping Salmonella enterica serotype Enteritidis[J]. Research in Microbiology, 2007, 158(1)∶ 10-17.
[26] DIMITROV Z P, MINKOVA S, MICHAYLOVA M. Comparative evaluation of three molecular typing methods in their applicability to differentiate Lactobacillus strains with human origin[J]. World Journal of Microbiology & Biotechnology, 2008, 24(8)∶ 1305-1312.
[27] SALMINEN S, ISOLAURI E, SALMINEN E. Clinical uses of probiotics for stabilizing the gut mucosal barrier∶ successful strains and future challenges[J]. Antonie Van Leeuwenhoek, 1996, 70(2/4)∶ 347-358.
[28] RICO A, ORTIZ-BARREDO A, RITTER E, et al. Genetic characterization of Erwinia amylovora strains by amplified fragment length polymorphism[J]. Journal of Applied Microbiology, 2004, 96(2)∶ 302-310.
[29] HONG Y, GARCA M, LEVISOHN S, et al. Differentiation of Mycoplasma gallisepticum strains using amplified fragment length polymorphism and other DNA-based typing methods[J]. Avian Diseases, 2005, 49(1)∶ 43-49.
Genetic Diversity Analysis of Oenococcus oeni Strains Isolated from Chinese Wines
JIN Gang1, WANG Hua1,2,3, ZHANG Ang4, LI Hua1,2,3,*
(1. College of Enology, Northwest A&F University, Yangling 712100, China; 2. Heyang Experimental Demonstration Station, Northwest A&F University, Heyang 715300, China; 3. Shaanxi Engineering Research Center for Viti-Viniculture, Yangling 712100, China; 4. Qinhuangdao Entry-Exit Inspection and Quarantine Bureau, Qinhuangdao 066004, China)
Oenococcus oeni(O. oeni)is considered as the key processer of malolactic fermentation (MLF), which will influence wine quality. Indigenous microorganisms are increasingly considered as one of the factors influencing the quality of individual wines. In order to understand the genetic diversity ofO. oeni, species-specific PCR and 16S rRNA sequence were used to identify 22 bacterial strains isolated from wines from different producing regions in China. Amplified fragment length polymorphism (AFLP) based onHindIIIandMseI was developed to analyze the genotypes of 22O. oenistrains.The results of species-specific PCR and 16S rRNA sequence analysis showed that the 22 isolates wereO. oeni. Double restriction enzyme digestion and ligation system, PCR reaction system, polyacrylamide gel electrophoresis were developed to analyzeO. oeni. The combinations of 16 AFLP primers were tested. The results showed that HT-MA, HT-MT, HT-MC, HG-MA, HG-MT, and HC-MT were the optimal primer combinations for analyzingO. oeni. The 22O. oenistrains were analyzed by AFLP, and cluster analysis indicated that the 22O. oenistrains fell into three groups and their genetic similarity was low. In conclusion, AFLP is a good method to genotypeO. oeniby usingHindIIIandMseI. TheO. oenistrains in China have very rich genetic diversity. The genetic similarity ofO.oenistrains is related to their ecological geographic distribution and other factors.
Oenococcus oeni; species-specific polymerase chain reaction; 16S rRNA sequence; amplified fragment length polymorphism (AFLP)
TS261.1
1002-6630(2015)17-0134-06
10.7506/spkx1002-6630-201517026
2015-01-13
国家自然科学基金面上项目(31471708)
金刚(1984—),男,博士研究生,研究方向为酿酒微生物。E-mail:gjinwine@hotmail.com
*通信作者:李华(1959—),男,教授,博士,研究方向为葡萄与葡萄酒学。E-mail:lihuawine@nwsuaf.edu.cn
